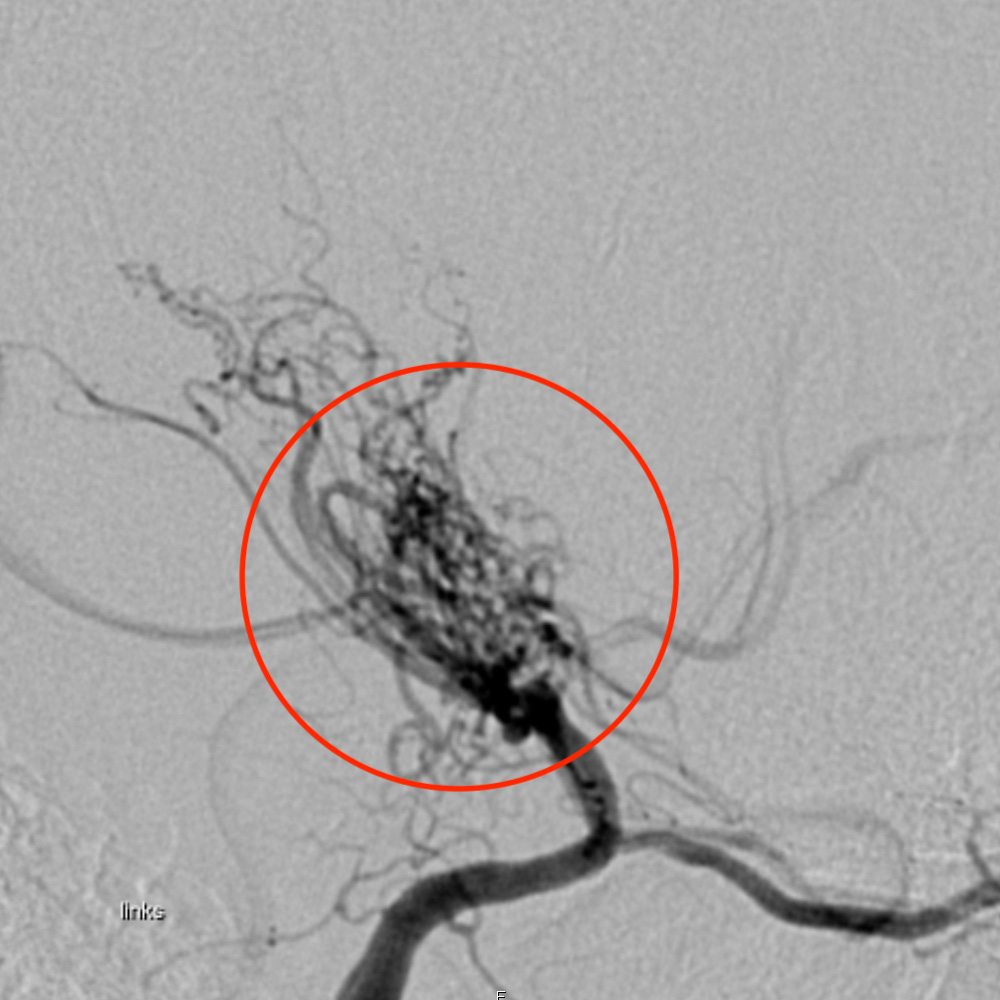
La maladie de Moyamoya est une maladie rare des vaisseaux cérébraux qui se caractérise par un rétrécissement ou une occlusion lentement progressive de l'artère carotide et de ses principales branches. Il s'ensuit la formation de circuits de contournement constitués de petits vaisseaux sanguins qui, à l'angiographie, ressemblent à un nuage de brouillard - d'où le nom de la maladie, dérivé du japonais «moyamoya» signifiant brouillard. Les personnes atteintes sont exposées à un risque important d'accident vasculaire cérébral avec des déficits neurologiques potentiels. Le traitement neurochirurgical reste le seul traitement efficace.
Contexte et causes
La maladie de Moyamoya est une maladie rare, non inflammatoire et non athérosclérotique des vaisseaux sanguins du cerveau. Sa cause n'est pas encore élucidée. Au cours de la maladie, les parois internes des vaisseaux des artères cérébrales bilatérales s'épaississent progressivement, principalement au niveau de la partie intracrânienne terminale de l'artère carotide interne (ICA), de l'artère cérébrale moyenne (MCA) et de l'artère cérébrale antérieure (ACA). Il s'ensuit le développement de vaisseaux collatéraux qui forment une circulation de contournement. * Ces petits vaisseaux collatéraux anormaux et réticulaires sont responsables de l'aspect caractéristique de la maladie sur l'angiographie cérébrale par soustraction numérique (DSA). L'aspect nuageux de ces vaisseaux compensateurs donne son nom à la maladie (du japonais «moyamoya» = brumeux).
Le plus souvent, la maladie est bilatérale, mais la gravité peut varier d'un côté à l'autre. Le terme de maladie de Moyamoya est réservé à cette forme, parfois familiale, chez les patients dont les vaisseaux sont atteints des deux côtés. Chez les patients présentant une atteinte unilatérale, la maladie est appelée syndrome de Moyamoya. Cependant, une maladie du côté opposé peut également survenir dans le syndrome de Moyamoya dans jusqu'à 40 % des cas.*
La maladie de Moyamoya est-elle fréquente?
Bien que la cause de la maladie soit inconnue, l'incidence est plus élevée au Japon, où l'on observe un regroupement familial chez environ 10 à 15 % des patients, ce qui suggère une cause potentiellement génétique. 10 La maladie est globalement très rare et touche le plus souvent les enfants mais aussi les adultes, généralement entre 30 et 50 ans. La maladie présente deux pics d'âge et une nette prédominance féminine, les femmes étant touchées presque deux fois plus souvent que les hommes. *, * , * Le premier pic d'âge se situe pendant l’enfance, vers l'âge de cinq ans, avec un autre pic dans la quatrième décennie de vie. L'incidence estimée en dehors du Japon est d'environ 1 sur 1 000 000. *
Plusieurs autres pathologies sont associées au syndrome de Moyamoya. Il s'agit notamment, mais pas exclusivement, de * :
- Neurofibromatose de type 1
- Sclérose tubéreuse
- Méningite
- Lupus érythémateux systémique
- Maladie drépanocytaire
- Dysplasie fibromusculaire
- Syndrome de Down
- Maladie cardiaque congénitale
- Radiothérapie du cerveau dans l'enfance
Pourquoi les accidents vasculaire cérébraux se produisent-ils?
Le rétrécissement de l'artère carotide interne et de ses branches principales entraîne une baisse de la perfusion sanguine cérébrale, qui peut être compensée dans un premier temps par la formation de vaisseaux collatéraux ainsi que par une vasodilatation (dilatation des artères) réflexe. Au fur et à mesure que la maladie évolue, le débit sanguin finit par tomber en dessous de la valeur critique nécessaire au fonctionnement normal du cerveau, un processus qui ne peut plus être compensé par les mécanismes compensatoires habituels. L'insuffisance d'apport sanguin entraîne alors de brèves crises ressemblant à des accidents vasculaires cérébraux, appelées accidents ischémiques transitoires (AIT). Ces AIT provoquent des déficits neurologiques temporaires, mais peuvent également entraîner des infarctus cérébraux ischémiques (ou accidents vasculaire cérébraux, AVC) avec des dommages permanents. La rupture des vaisseaux collatéraux peut également entraîner une hémorragie intracérébrale.
Comment la maladie de Moyamoya est-elle diagnostiquée?
Le diagnostic a souvent lieu lors de la détection d’accidents vasculaires cérébraux récurrents. L'imagerie par résonance magnétique (IRM) révèle les modifications vasculaires typiques du Moyamoya : Rétrécissement de l'artère carotide interne et présence de vaisseaux collatéraux. Ces résultats doivent ensuite être confirmés par une angiographie par soustraction numérique (ASN), qui permet de visualiser les vaisseaux de manière sélective. Il est essentiel d'exclure que les AVC soient dus à d'autres causes, ce qui nécessiterait un traitement différent. En outre, il est important d'apporter la preuve d'une reduction significative du flux sanguin vers le cerveau. Cette preuve peut être fournie par plusieurs méthodes : Mesure de la perfusion par résonance magnétique, tomographie par émission de positons au H2O (H2O-PET), examen SPECT (single photon emission computed tomography). La tomographie par émission de positrons (PET) est une technique d'imagerie diagnostique qui permet de visualiser efficacement les altérations de perfusion cérébrale. Fin 2020, le scanner PET-CT le plus rapide du monde a été mis en service au département universitaire de médecine nucléaire de l'Inselspital. Ce scanner de toute dernière technologie permet une excellente qualité d'examen avec des temps d'examen plus courts et une exposition réduite aux radiations pour nos patients.
Quel est le traitement de Moyamoya ?
La progression de la maladie peut être très variable. Indépendamment du fait que la progression de la maladie soit lente ou rapide, la maladie progresse chez presque tous les patients symptomatiques et même chez les patients asymptomatiques si le traitement est uniquement médicamenteux. *, *, * Des publications scientifiques montrent que jusqu'à ⅔ des patients atteints de la maladie de Moyamoya symptomatique subissent une aggravation significative de leurs symptômes dans les 5 ans sans opération. *, *
La chirurgie permet de réduire considérablement ce risque. Environ 96 % des patients opérés n'ont plus d'accident vasculaire cérébral 5 ans après l'opération. *, * Même chez les patients qui ne souffrent pas encore de la maladie de Moyamoya, le risque annuel d'AVC (hémorragique ou non) est de 3,2 %. *
Méthodes chirurgicales
L'objectif du traitement chirurgical est de prévenir les accidents vasculaires cérébraux en améliorant la circulation sanguine (revascularisation). Deux méthodes de revascularisation sont disponibles: la revascularisation directe et la revascularisation indirecte.
Les deux méthodes peuvent également être utilisées en combinaison. Dans les essais cliniques, la revascularisation directe s'avère généralement plus efficace *, *, * Cependant, le choix de la technique chirurgicale appropriée est pris individuellement pour chaque patient, sur la base de plusieurs facteurs clinique, radiologique et anatomiques.
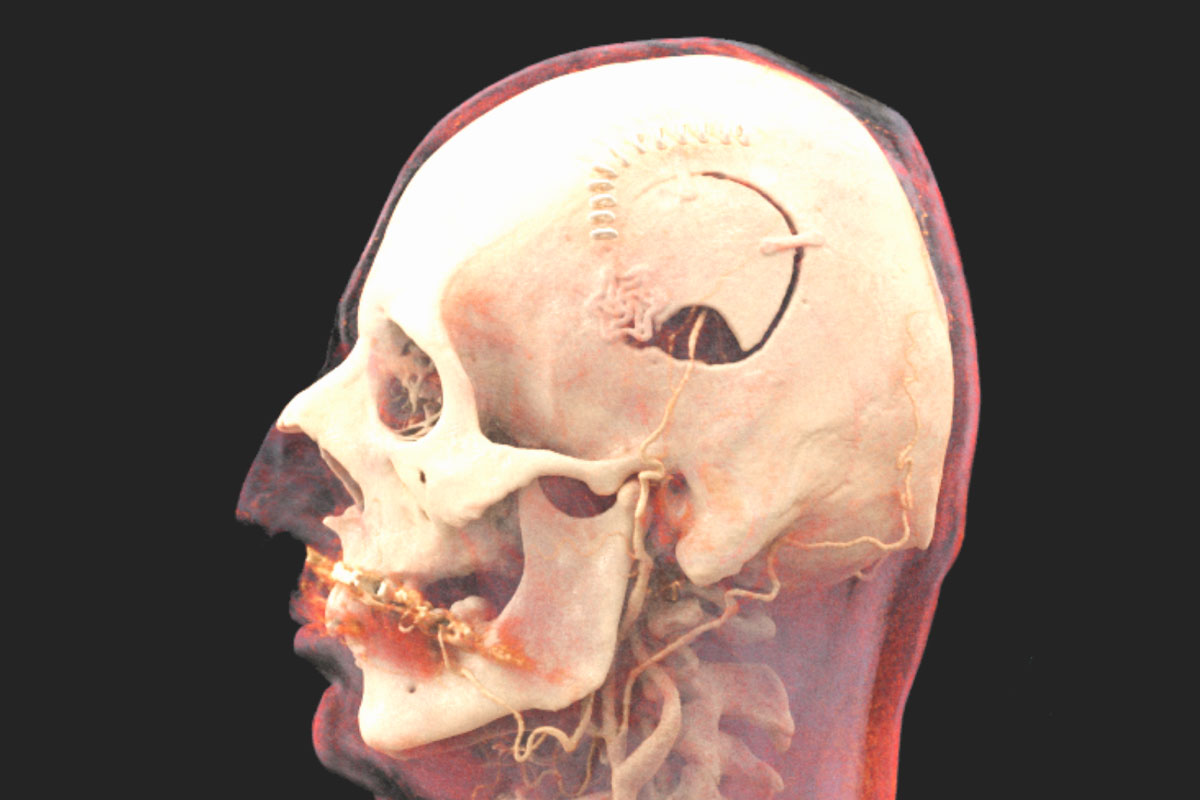
Revascularisation directe
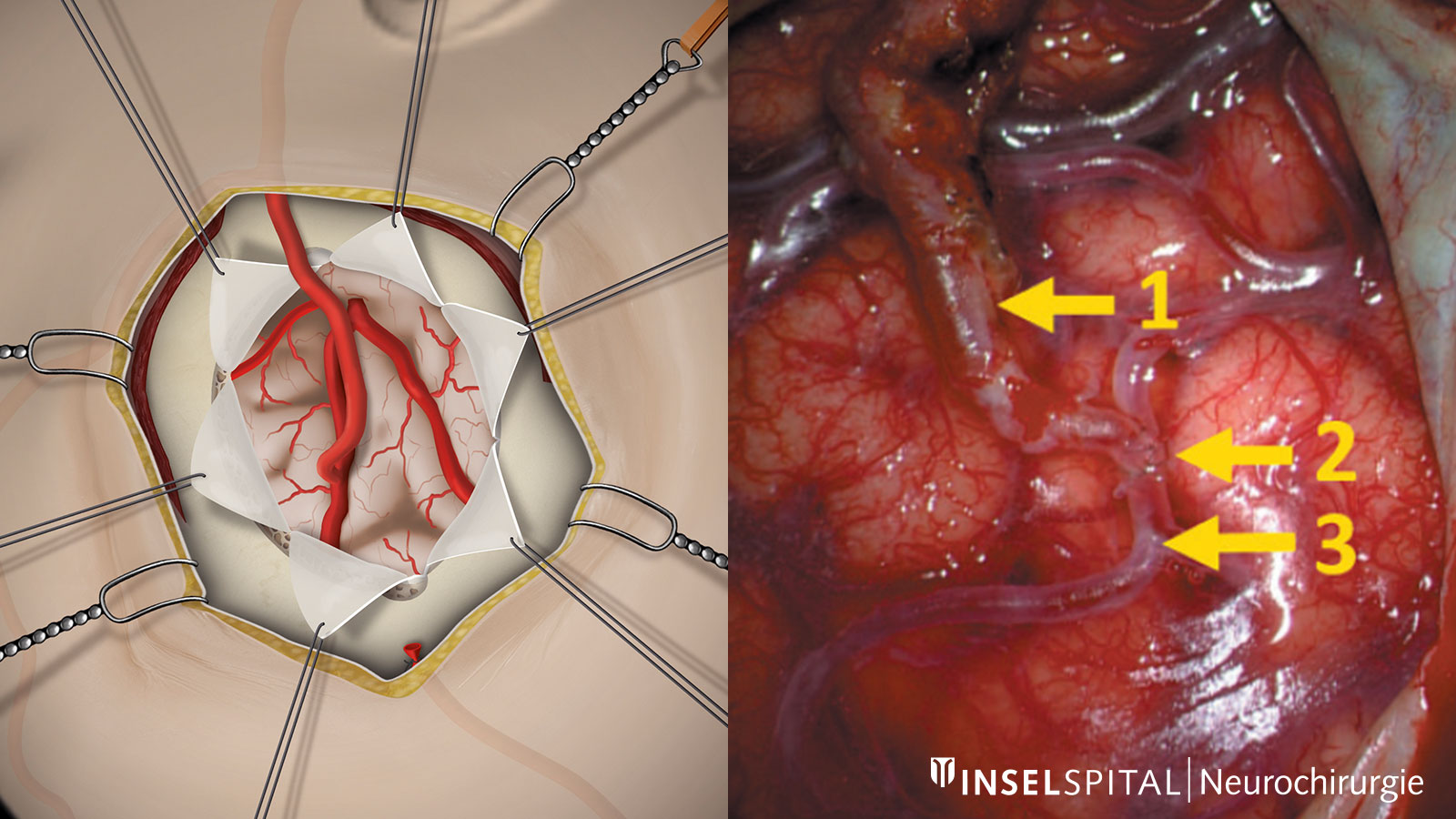
La revascularisation directe comporte une anastomose (connexion chirurgicale) directement entre une artère extracrânienne à une artère au niveau de la surface du cerveau. Cette anastomose peut détourner le manque d’apport sanguin lié au rétrécissement de l'artère carotide interne malade et fournir un flux sanguin alternatif et supplémentaire au cerveau. L'opération de ce type la plus couramment réalisée est le pontage STA-MCA (pontage de l'artère temporale superficielle à l'artère cérébrale moyenne). Dans cette procédure, l'artère temporale superficielle (STA), qui en temps normal alimente le cuir chevelu et peut souvent être palpée sur le côté de la tempe, est transplantée vers l’espace intracrânien à travers une ouverture dans le crâne (craniotomie) et connectée à une branche de l'artère cérébrale moyenne (ACM) qui court à la surface du cerveau. Ces vaisseaux ont une épaisseur d'environ 1 à 2 mm et sont suturés au microscope avec un fil très fin, du diamètre d’un cheveu.
Revascularisation indirecte
Dans la revascularisation indirecte, le tissu alimenté par l'artère carotide externe est placé à la surface du cerveau sans suturer une connexion vasculaire directe. Au fil du temps, les artères du tissu se développent et se connectent aux vaisseaux de la surface du cerveau et peuvent ainsi également former une revascularisation cérébrale suffisante (néoangiogenèse). Les tissus qui peuvent être utilisés comprennent notamment les méninges (encéphalodurosynangiose) et le muscle temporal (encéphalomyosynangiose). Les différentes variantes de la revascularisation indirecte sont souvent utilisées en combinaison les unes avec les autres ou en plus des pontages directs (voir ci-dessus). En général, la revascularisation indirecte est utilisée principalement chez les enfants jusqu'à l’âge de puberté, car le développement d’une néoangiogenèse suffisante est plus probable que chez la population adultes. *
Pourquoi se faire soigner à l'Inselspital ?
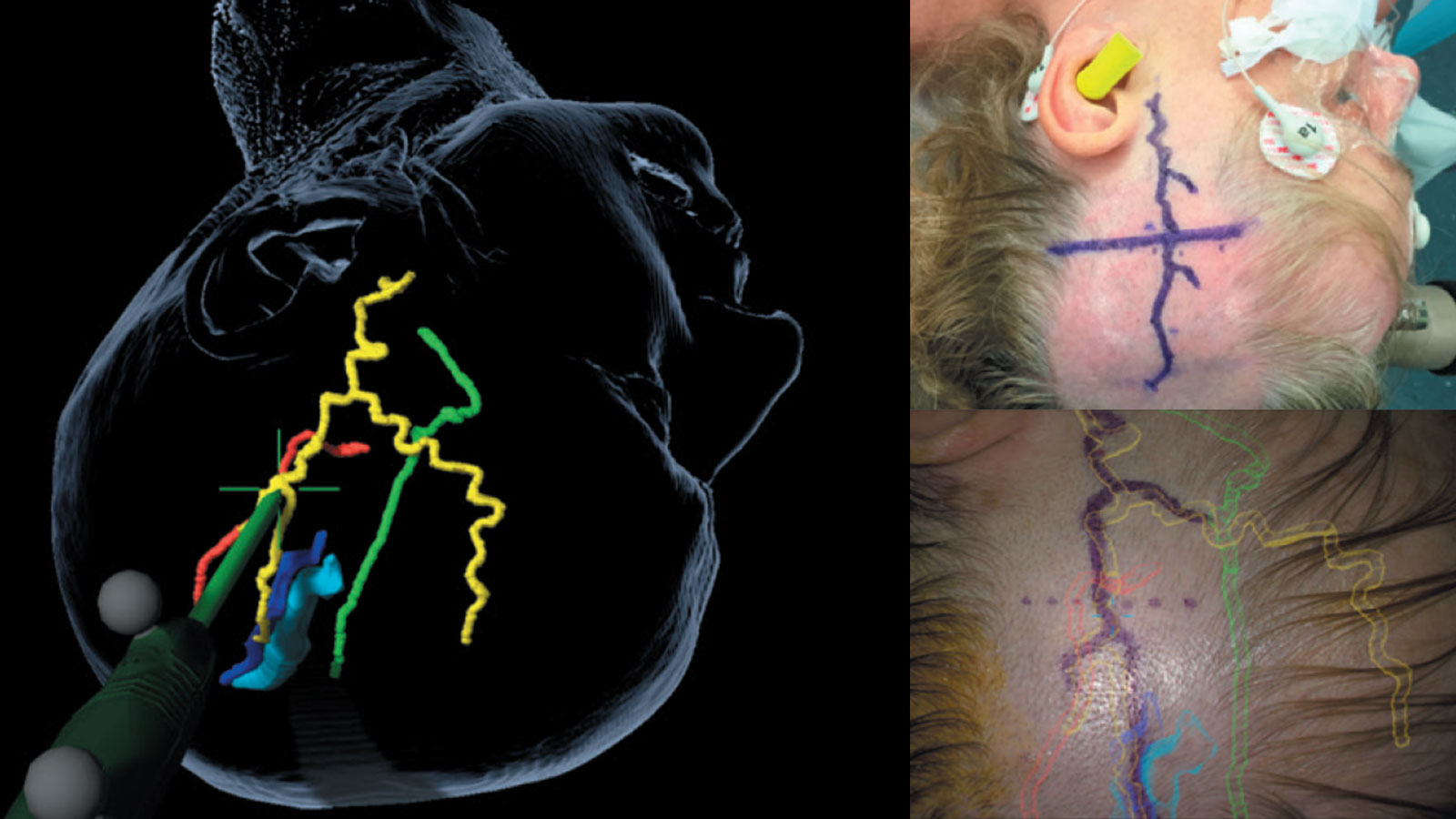
À l'Inselspital, nous utilisons les techniques chirurgicales de pointe :
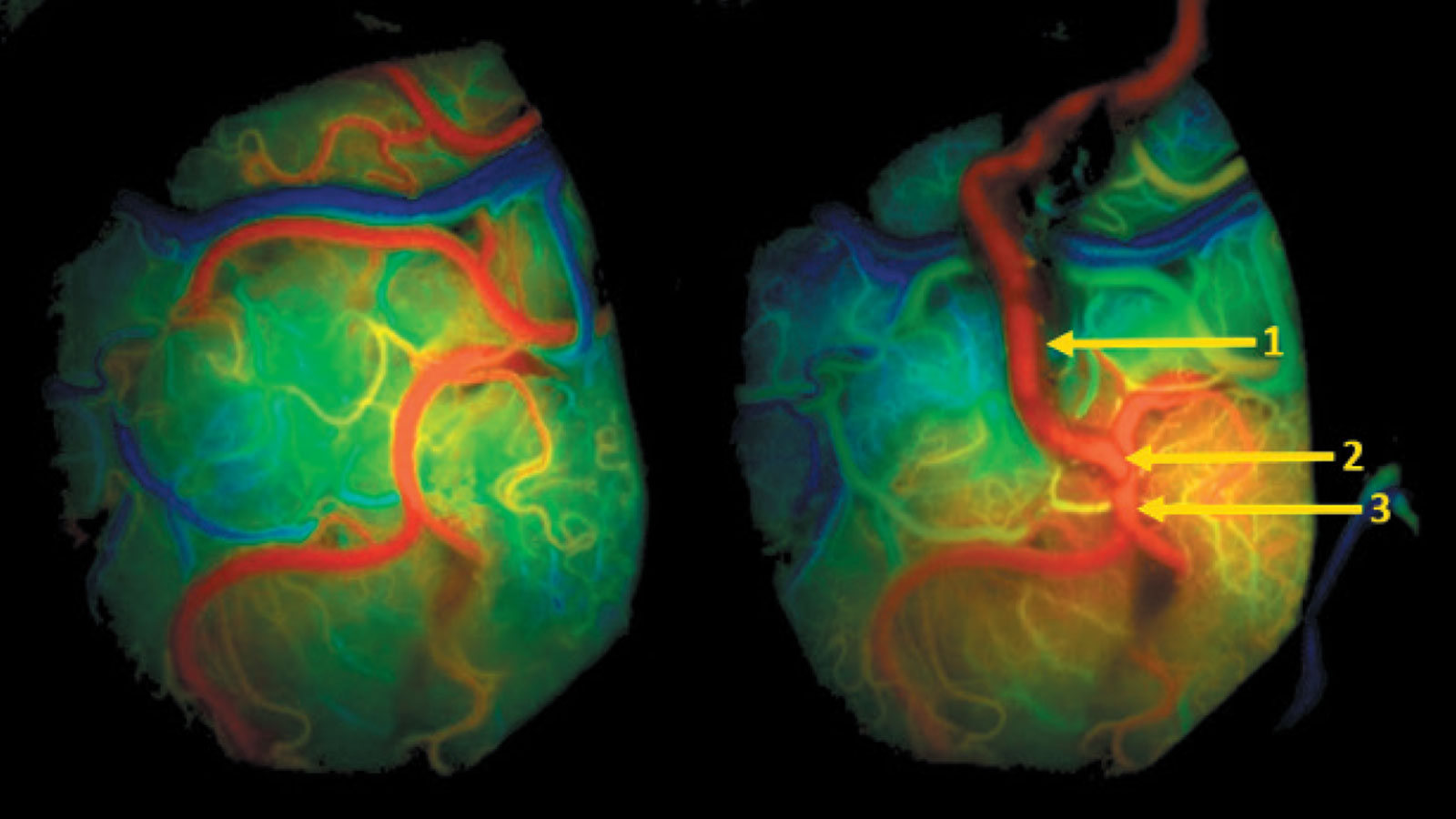
La navigation vasculaire et la réalité augmentée permettent d'augmenter la précision pendant l'opération et de faciliter la recherche du vaisseau donneur. Dès que l'anastomose vasculaire est terminée, la perméabilité des vaisseaux peut être vérifiée pendant l'opération à l'aide d'une angiographie infrarouge au vert d'indocyanine (en abrégé angiographie infrarouge ICG) dans une analyse de flux supplémentaire.
-
Imaizumi T, Hayashi K, Saito K, Osawa M, Fukuyama Y. Long-Term Outcomes of Pediatric Moyamoya Disease Monitored to Adulthood. Pediatric Neurology. 1998;18(4):321-325.
-
Suzuki J. Cerebrovascular "Moyamoya" Disease. Archives of Neurology. 1969;20(3):288.
-
Kuroda S, Ishikawa T, Houkin K, Nanba R, Hokari M, Iwasaki Y. Incidence and Clinical Features of Disease Progression in Adult Moyamoya Disease. Stroke. 2005;36(10):2148-2153.
-
Choi J, Seok Kim D, Kim E, Lee K. Natural history of Moyamoya disease: comparison of activity of daily living in surgery and non surgery groups. Clinical Neurology and Neurosurgery. 1997;99:S11-S18.
-
Kurokawa T, Chen Y, Tomita S, Kishikawa T, Kitamura K. Cerebrovascular Occlusive Disease with and without the Moyamoya Vascular Network in Children. Neuropediatrics. 1985;16(01):29-32.
-
Scott R, Smith J, Robertson R, Madsen J, Soriano S, Rockoff M. Long-term outcome in children with moyamoya syndrome after cranial revascularization by pial synangiosis. Journal of Neurosurgery: Pediatrics. 2004;100(2):142-149.
-
Kuroda S, Hashimoto N, Yoshimoto T, Iwasaki Y. Radiological Findings, Clinical Course, and Outcome in Asymptomatic Moyamoya Disease. Stroke. 2007;38(5):1430-1435.
-
Suzuki J, Kodama N. Moyamoya disease--a review. Stroke. 1983;14(1):104-109.
-
Scott, R. and Smith, E., 2009. Moyamoya Disease and Moyamoya Syndrome. New England Journal of Medicine, 360(12), pp.1226-1237.
-
Kamada F, Aoki Y, Narisawa A, Abe Y, Komatsuzaki S, Kikuchi A et al. A genome-wide association study identifies RNF213 as the first Moyamoya disease gene. Journal of Human Genetics. 2010;56(1):34-40.
-
Baba T, Houkin K, Kuroda S. Novel epidemiological features of moyamoya disease. Journal of Neurology, Neurosurgery & Psychiatry. 2008;79(8):900-904.
-
Wakai K, Tamakoshi A, Ikezaki K, Fukui M, Kawamura T, Aoki R et al. Epidemiological features of Moyamoya disease in Japan: findings from a nationwide survey. Clinical Neurology and Neurosurgery. 1997;99:S1-S5.
-
Uchino, K., Johnston, S., Becker, K. and Tirschwell, D., 2005. Moyamoya disease in Washington State and California. Neurology, 65(6), pp.956-958.
-
Roach ES, Golomb MR, Adams R, et al. Management of stroke in infants and children: a scientific statement from a Special Writing Group of the American Heart Association Stroke Council and the Council on Cardiovascular Disease in the Young. Stroke; a journal of cerebral circulation 2008;39:2644-91.
-
Deng X, Gao F, Zhang D, Zhang Y, Wang R, Wang S et al. Direct versus indirect bypasses for adult ischemic-type moyamoya disease: a propensity score–matched analysis. Journal of Neurosurgery. 2018;128(6):1785-1791.
-
Komotar R, Starke R, Otten M, Merkow M, Garrett M, Marshall R et al. The role of indirect extracranial-intracranial bypass in the treatment of symptomatic intracranial atheroocclusive disease. Journal of Neurosurgery. 2009;110(5):896-904.
-
Mizoi K, Kayama T, Yoshimoto T, Nagamine Y. Indirect revascularization for moyamoya disease: Is there a beneficial effect for adult patients?. Surgical Neurology. 1996;45(6):541-548.
-
Rychen J, Goldberg J, Raabe A, Bervini D. Augmented Reality in Superficial Temporal Artery to Middle Cerebral Artery Bypass Surgery: Technical Note. Operative Neurosurgery. 2019;.
-
Raabe A, Nakaji P, Beck J, Kim L, Hsu F, Kamerman J et al. Prospective evaluation of surgical microscope—integrated intraoperative near-infrared indocyanine green videoangiography during aneurysm surgery. Journal of Neurosurgery. 2005;103(6):982-989.
-
Abla A, Gandhoke G, Clark J, Oppenlander M, Velat G, Zabramski J et al. Surgical Outcomes for Moyamoya Angiopathy at Barrow Neurological Institute With Comparison of Adult Indirect Encephaloduroarteriosynangiosis Bypass, Adult Direct Superficial Temporal Artery–to–Middle Cerebral Artery Bypass, and Pediatric Bypass. Neurosurgery. 2013;73(3):430-439.
-
Finkenstaedt S, Krejci V, Raabe A, Bervini D. Moyamoya-Erkrankung: Es braucht hoch-spezialisierte Zusammenarbeit. Anästhesie Journal 4/2019