Le glioblastome est la tumeur cérébrale maligne la plus fréquente chez l’adulte. Issu des cellules gliales du cerveau, il touche principalement les personnes âgées. Le traitement standard repose sur une combinaison de chirurgie, radiothérapie et chimiothérapie, selon le protocole de Stupp. Son pronostic étant défavorable, la priorité est donnée à l’amélioration de la qualité de vie et à l’optimisation de la survie des patients.
Inselspital Neurochirurgie - nos chiffres et faits
- Excellence: neurochirurgiens hautement spécialisés et infirmiers/infirmières en oncologie spécialement formés (Advanced Practice Nurses ou APN en abrégé).
- Expertise: 417 opérations de tumeurs (biopsies et résections) en 2024, dont 359 gliomes.
- Équipe interdisciplinaire : notre tumor boardhebdomadaire réunit des spécialistes de 7 disciplines – neurochirurgie, neurologie, neuroradiologie, oncologie, médecine nucléaire, radio-oncologie, pathologie.
- Développées et étudiées à l'Inselspital: techniques de neuromonitoring et de navigation innovantes pour la sécurité des opérations et laprévention des déficits.
- Taux de déficits parmi les plus bas au monde: le taux documenté et publié de 3 à 5 % de déficits permanents liés à l'opération pour les tumeurs à risque d'éloquence motrice est l'un des plus bas au monde !
- Taux de résection parmi les plus élevés au monde: le taux de résection complète > 90 % pour les gliomes est l'un des plus élevés au monde !
- Équipement technologique de pointe avec imagerie peropératoire, techniques de fluorescence, thermothérapie au laser et plus encore.
- Concept de traitement complémentaire: notre protocole OPTIMISST (OPTIMISST signifie OptimizedStandardand SupportiveTherapy).
- Certification: centre certifié pour les tumeurs cérébrales depuis 2016, garant d'un haut niveau de qualité dans le traitement oncologique.
Qu'est-ce qu'un glioblastome ?
Les glioblastomes (également appelés glioblastomes multiformes en raison de l'aspect différent des parties de la tumeur) sont les tumeurs cérébrales malignes les plus fréquentes et représentent 55 % des tumeurs cérébrales primaires qui se développent dans le cerveau et ne sont pas des métastases.
Les glioblastomes se développent le long des voies fibreuses du cerveau et se propagent ainsi localement, régionalement et suprarégionalement. En règle générale, les glioblastomes ne provoquent pas de métastases en dehors du système nerveux.
Selon l'Organisation mondiale de la santé (OMS), un glioblastome est classé au niveau 4 de l'OMS, ce qui représente le degré de malignité le plus élevé. Cette classification se base sur des caractéristiques telles que
- taux élevé de division cellulaire
- nécrose (mort des tissus)
- croissance rapide de nouveaux vaisseaux sanguins (prolifération vasculaire)
En outre, l'analyse moléculaire peut révéler des altérations génétiques spécifiques telles que des mutations dans le gène IDH1/IDH2 ou la méthylation du promoteur MGMT, qui ont une importance pronostique et thérapeutique.
Les variantes rares du glioblastome sont le gliosarcome, le glioblastome à cellules géantes et le glioblastome épithélioïde.
- Sous-groupes moléculaires
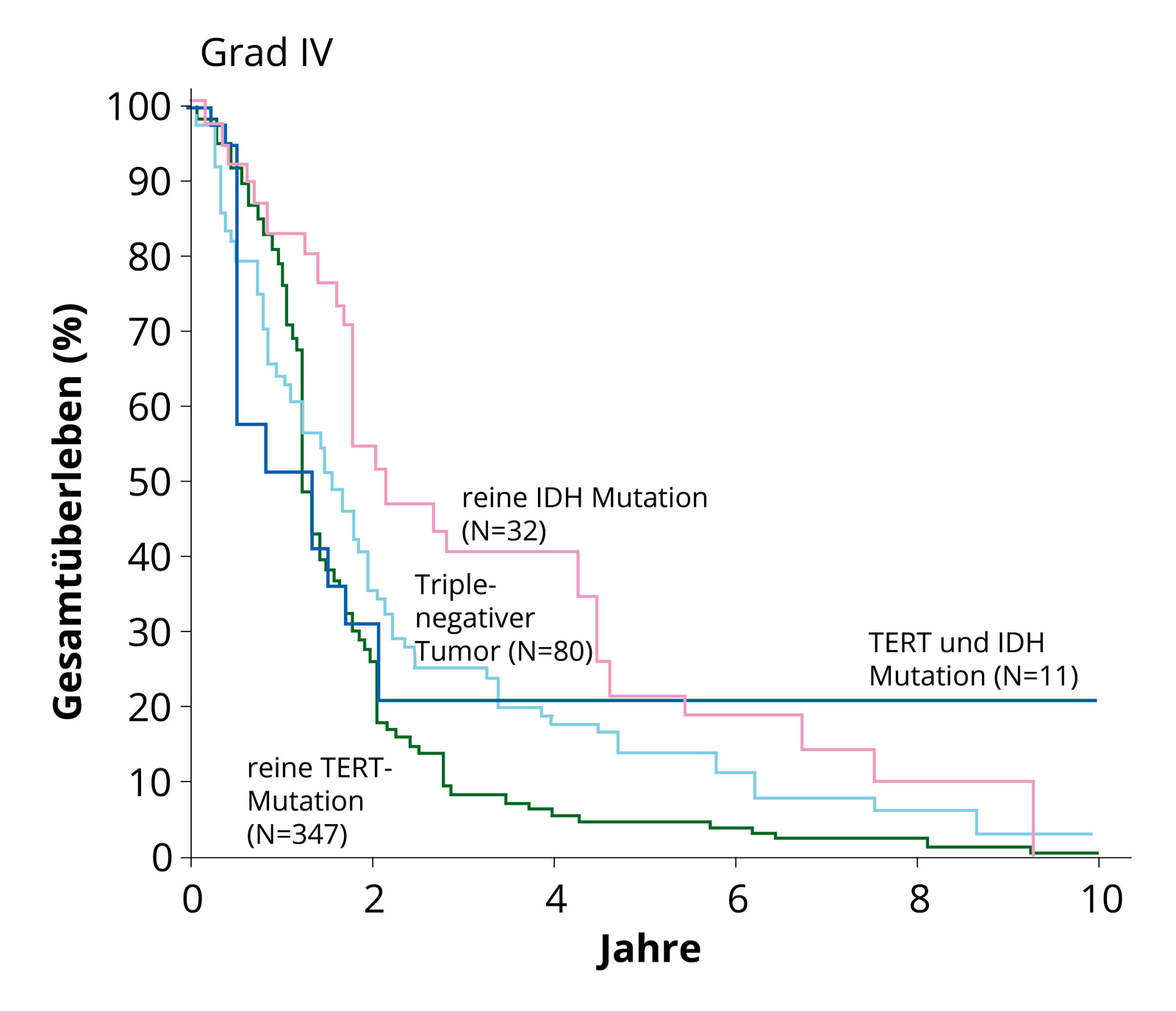
Courbes de survie des sous-groupes moléculaires. Il est clair que les glioblastomes sans mutation IDH (IDH de type sauvage) avec mutation TERT ont une survie plus faible (ligne verte) que les tumeurs avec mutation IDH. Quelle: Eckel-Passow et al, N Engl J Med 2015; 372:2499–508. On trouve fréquemment dans les glioblastomes primaires
- des mutations dans le récepteur de l'EGF
- Mutations dans le gène PTEN
- Mutations dans le gène TERT
Le récepteur EGF (de l'anglais epidermal growth factor receptor) capte les signaux de l'environnement d'une cellule, qui permettent la croissance et la division d'une cellule, et est souvent trop actif dans les glioblastomes primaires.
Le produit du gène PTEN est un suppresseur de tumeur qui joue un rôle de contrôle important dans la régulation de la croissance cellulaire.
Le produit du gèneTERTest une enzyme qui empêche le raccourcissement progressif des extrémités des chromosomes lors d'une division cellulaire rapide. Cela permet de retarder le vieillissement biologique d'une cellule, appelé sénescence cellulaire.
Les glioblastomes secondaires se caractérisent par une mutation dans le gène de l'IDH ainsi que, souvent, par une mutation dans le gène p53, un suppresseur de tumeur.
Des études génétiques à grande échelle, telles que les analyses du projet Génome du cancer (The Cancer Genome Atlas ou TCGA), ont fourni d'autres informations importantes sur l'empreinte génétique de différents sous-types de glioblastomes *.
Les différents sous-groupes génétiques de glioblastomes se distinguent par leur comportement.
- Méthylation
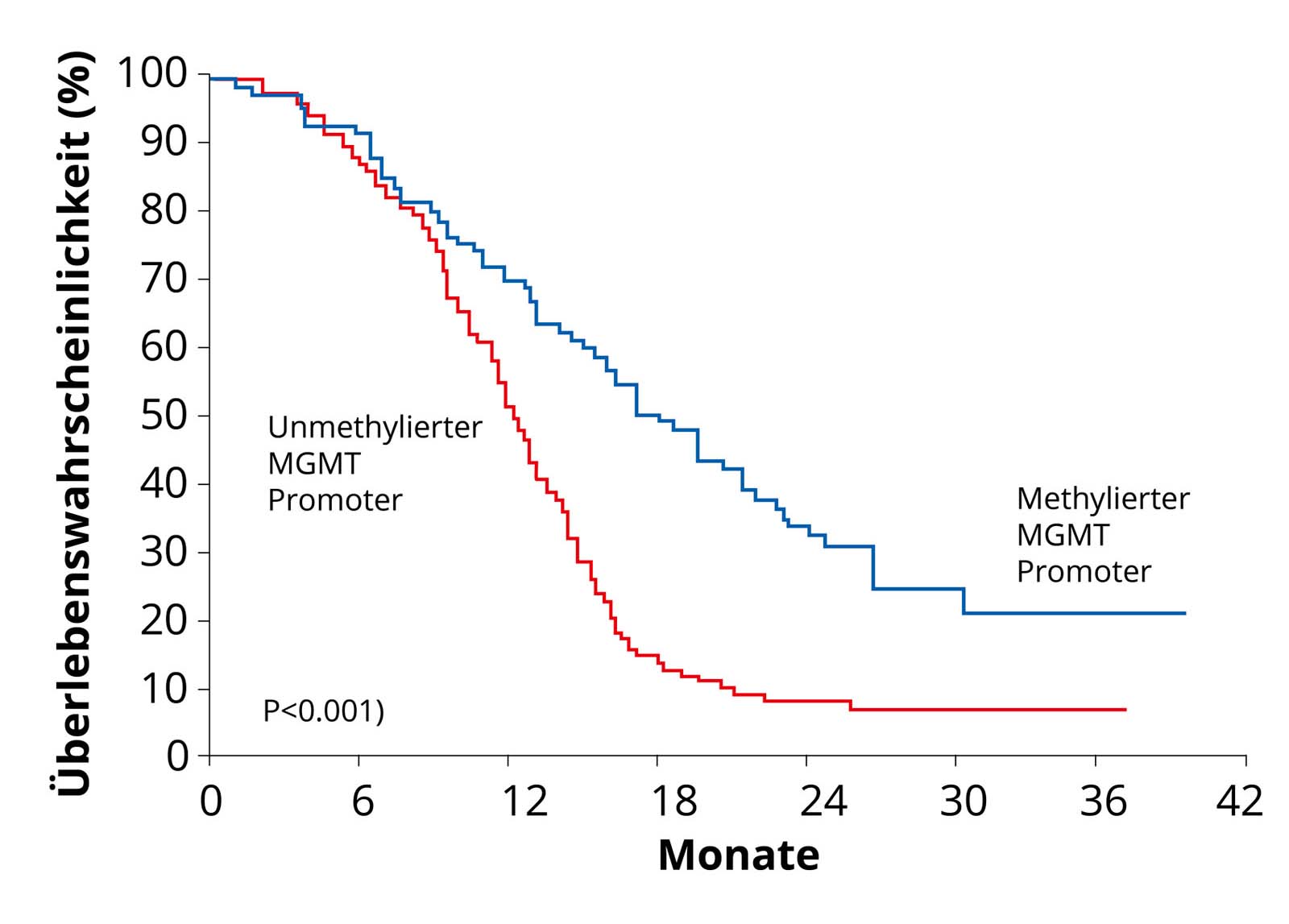
Glioblastomes avec méthylation du promoteur MGMT. Ces tumeurs réagissant mieux à la chimiothérapie, les patients présentent une meilleure courbe de survie (courbe bleue) que les patients dont le promoteur MGMT n'est pas méthylé (courbe rouge). Quelle: Hegi et al. MGMT Gene Silencing and Benefit from Temozolomide in Glioblastoma. N Engl J Med 2005; 352: 997-1003. Une modification génétique importante des cellules de glioblastome du point de vue thérapeutique est ce que l'on appelle la méthylation de l'ADN du promoteur MGMT. Par méthylation de l'ADN, on entend le transfert de groupes méthyle à certains endroits du matériel génétique (ADN) d'une cellule. Lors de la méthylation, l'ADN d'une cellule de glioblastome est donc modifié. Cette modification entraîne l'arrêt de la production de la protéine de réparation de l'ADN MGMT. Si une tumeur ne peut plus réparer son ADN, elle est tuée plus rapidement par une chimiothérapie. Environ la moitié des glioblastomes présentent cette modification génétique. Ces patients atteints de glioblastome répondent mieux à la chimiothérapie au Temodal - la méthylation est donc un avantage.
A l'avenir, la classification des tumeurs basée sur le méthylome gagnera en importance *. Dans ce cas, l'ADN de la tumeur est examiné pour détecter des groupes méthyle supplémentaires. Ces groupes méthyle peuvent d'une part être acquis et donnent d'autre part une indication sur l'origine cellulaire de la tumeur. De plus, cette méthode promet un haut degré de standardisation. La nature numérique des données de méthylation permet en outre un échange plus facile entre les groupes de recherche et une meilleure attribution des cas peu clairs.
Quelle est la fréquence du glioblastome et qui est concerné?
Le glioblastome survient typiquement chez les adultes âgés (50-85 ans), avec un âge moyen de 64 ans *. Les glioblastomes peuvent certes apparaître chez les enfants, mais ils ne représentent que 2,9 % de toutes les tumeurs cérébrales dans le groupe d'âge de 0 à 19 ans *.
Dans l'ensemble, il s'agit de tumeurs rares avec environ 3 à 4 nouveaux diagnostics par an pour 100 000 habitants *. Les hommes sont 1,5 fois plus touchés que les femmes.
Quelles sont les causes d'un glioblastome ?
Le seul facteur de risque confirmé pour le développement d'un glioblastome est une irradiation antérieure de la tête.
Un lien avec des traumatismes crâniens antérieurs, des toxines ou l'alimentation n'a pas pu être clairement établi *, *.
Les facteurs héréditaires ne jouent qu'un rôle secondaire.
Il est intéressant de noter que les patients souffrant de maladies allergiques (asthme, dermatite atopique, allergies alimentaires, etc.) présenteraient un risque plus faible de développer un glioblastome *.
Selon de nouvelles hypothèses, la première cellule de glioblastome peut se former jusqu'à 7 ans avant le diagnostic. Selon cette hypothèse, les mutations précoces et critiques dans le développement de la tumeur ont lieu 2 à 7 ans avant le diagnostic. Mais c'est l'apparition de mutations supplémentaires qui déclenche ensuite la croissance rapide typique du glioblastome. On sait que chez des patients dont l'IRM était auparavant normale, le glioblastome visible à l'imagerie s'est développé rapidement en l'espace de quelques mois *, *.
Les radiations des téléphones portables provoquent-elles des tumeurs cérébrales ?
À ce jour, les études épidémiologiques de grande envergure menées sur l’homme n’ont apporté aucune preuve que l’utilisation des téléphones mobiles augmente le risque de développer une tumeur cérébrale *, *.
Des recherches expérimentales approfondies sur les animaux ont toutefois montré un risque accru de tumeurs chez les rats et souris mâles exposés aux ondes des téléphones portables. Cependant, ces études n’ont pas mis en évidence de relation dose-effet et n’expliquent pas pourquoi cet effet n’a pas été observé chez les femelles.
Chez l’homme, l’étude INTERPHONE a identifié une légère augmentation du risque de gliome en cas d’utilisation excessive du téléphone portable *. Une autre étude cas-témoins suédoise, souvent débattue, a également suggéré un lien entre l’utilisation du téléphone mobile et l’apparition de gliomes *, *. Sur la base de ces résultats, le Centre international de recherche sur le cancer (CIRC) de l’OMS a classé les champs électromagnétiques de radiofréquence comme « potentiellement cancérigènes » *.
En revanche, plusieurs autres études épidémiologiques de grande ampleur n’ont trouvé aucune preuve d’un risque accru de tumeur cérébrale *, *, *, *. Parmi elles, la Million Women Study, publiée après le rapport du CIRC, a analysé des données prospectives sur près de 800 000 participantes et n’a pas mis en évidence d’augmentation du risque *.
Les conclusions varient donc selon les sources : certaines autorités estiment qu’il n’existe aucun danger avéré, tandis que d’autres considèrent qu’un effet légèrement cancérigène ne peut être totalement exclu.
Quels sont les symptômes d'un glioblastome?
Les symptômes dépendent en principe de la localisation de la tumeur dans le cerveau. Il en va de même pour toutes les tumeurs cérébrales :
- Crises: activité épileptique ou hyperexcitabilité des tissus sains en périphérie de la tumeur.
- Déficits ou troubles fonctionnels: Altération du langage, de la motricité, des sensations, de la vision, du calcul, de la pensée, de la mémoire, de l'équilibre, de l'orientation, de l'humeur, du comportement, de l'éveil, de la propulsion, du comportement social, etc. en raison de la pression exercée par la tumeur sur les structures cérébrales voisines ou de l'invasion des tissus environnants.
- Maux de tête, nausées, vomissements: une tumeur avancée entraîne une augmentation de la pression dans le crâne.
- Symptômes non spécifiques: Si la tumeur se développe dans des parties fonctionnellement silencieuses (non-éloquentes) du cerveau, elle peut passer inaperçue pendant un certain temps, jusqu'à ce que des troubles non spécifiques apparaissent, tels qu'un changement de caractère, de la fatigue, des oublis, une désorientation et de la confusion. La plupart du temps, les symptômes durent déjà depuis quelques semaines ou quelques mois au moment du diagnostic.
Imagerie par résonance magnétique
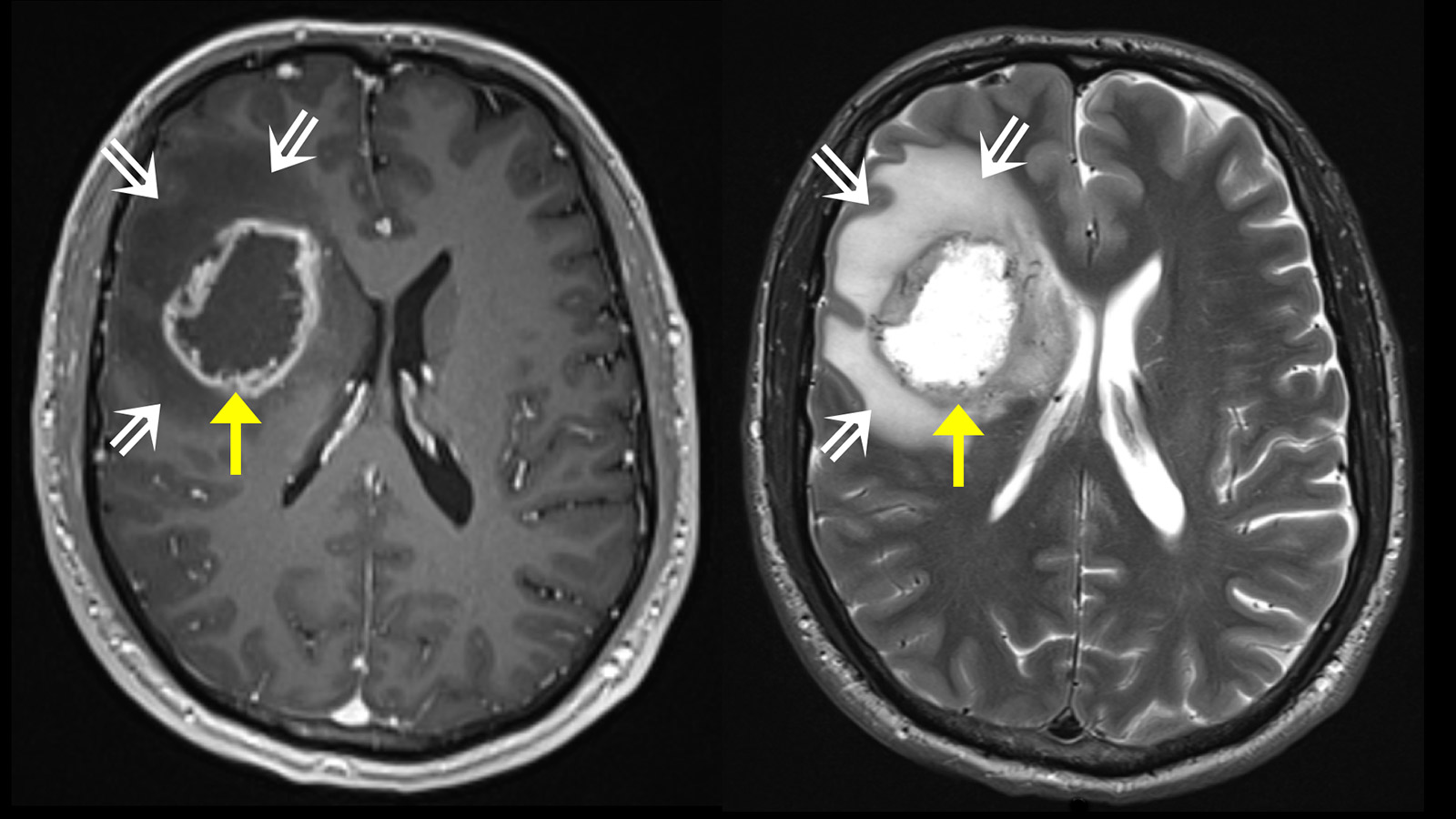
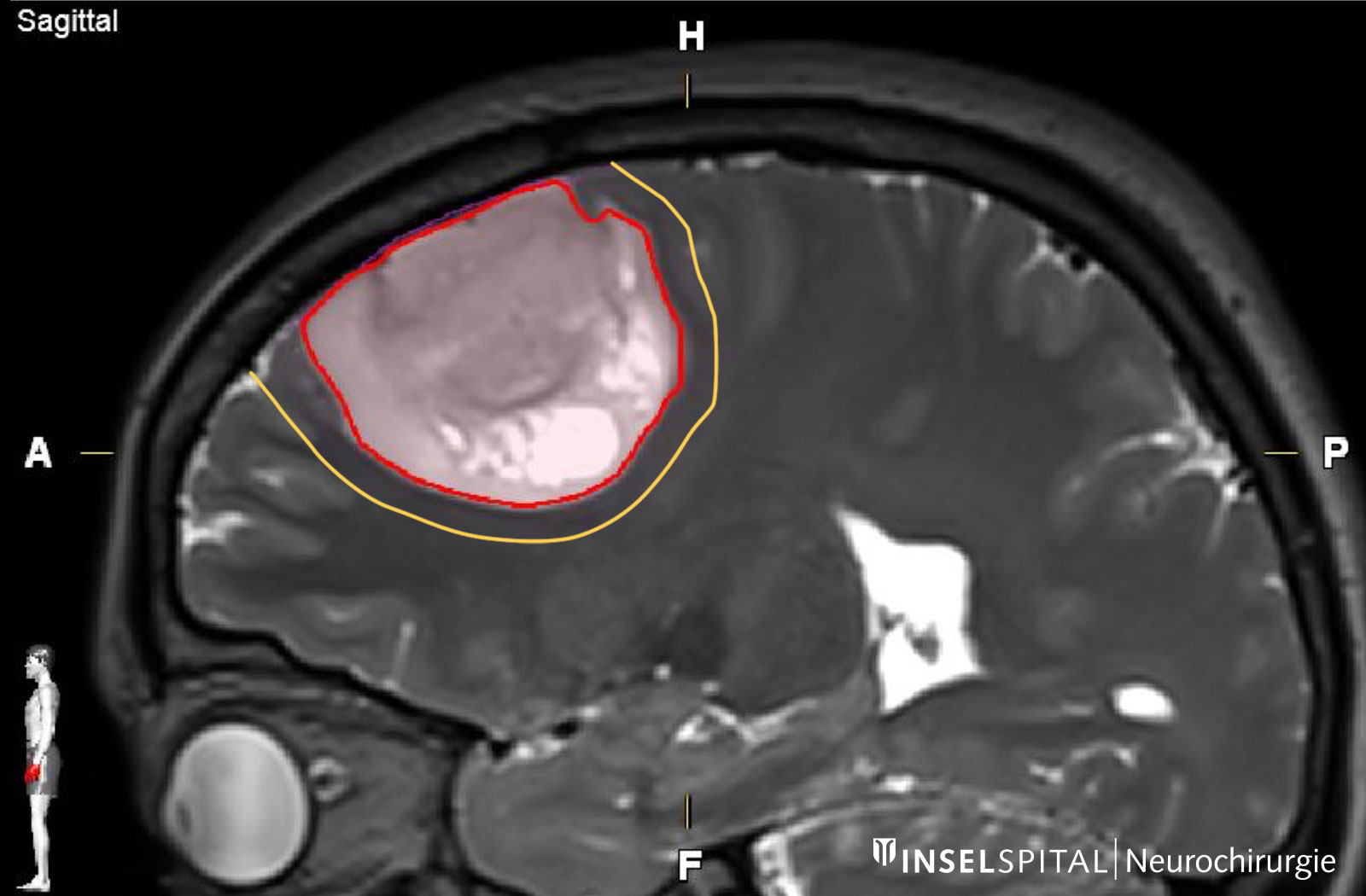
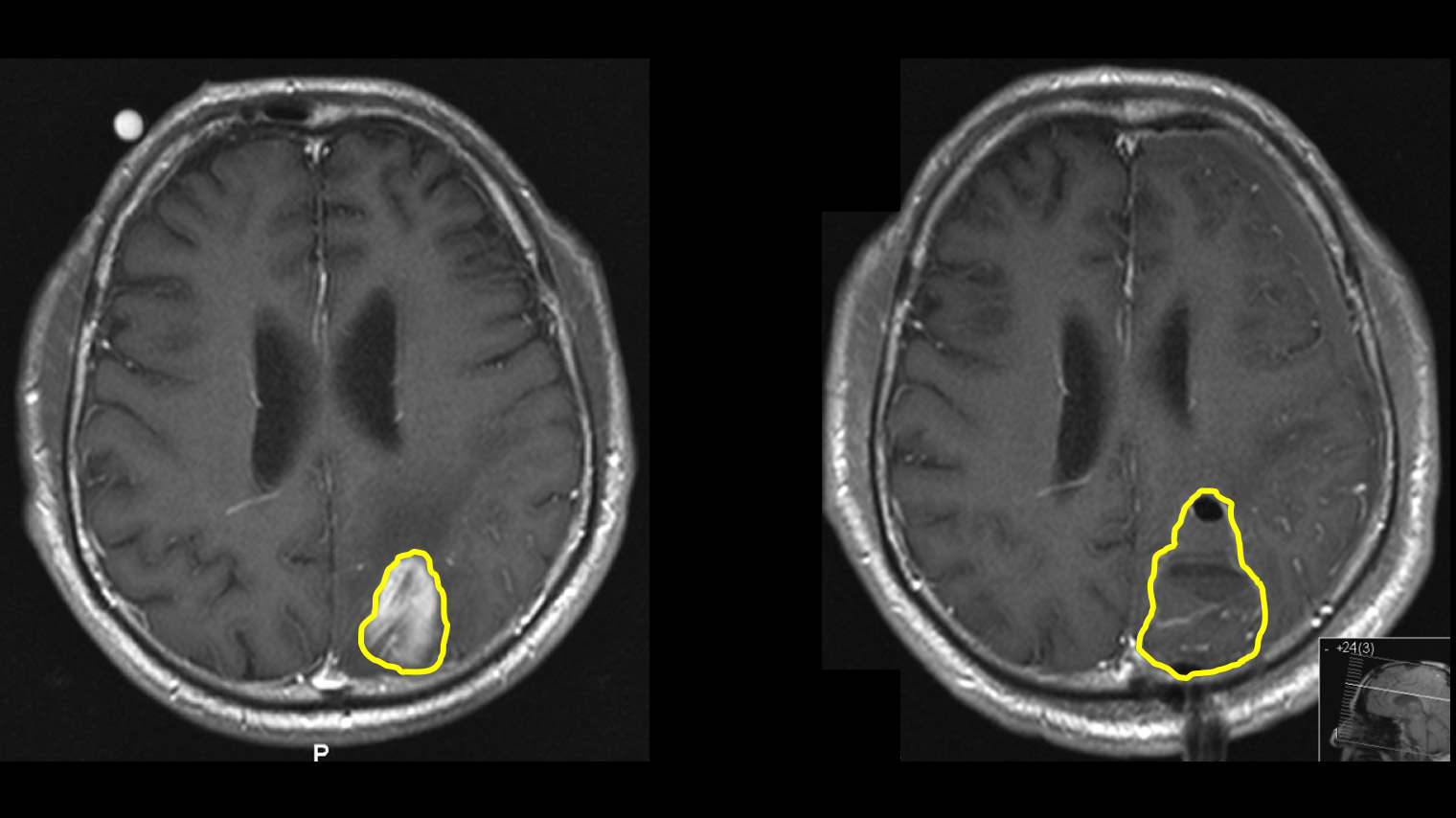
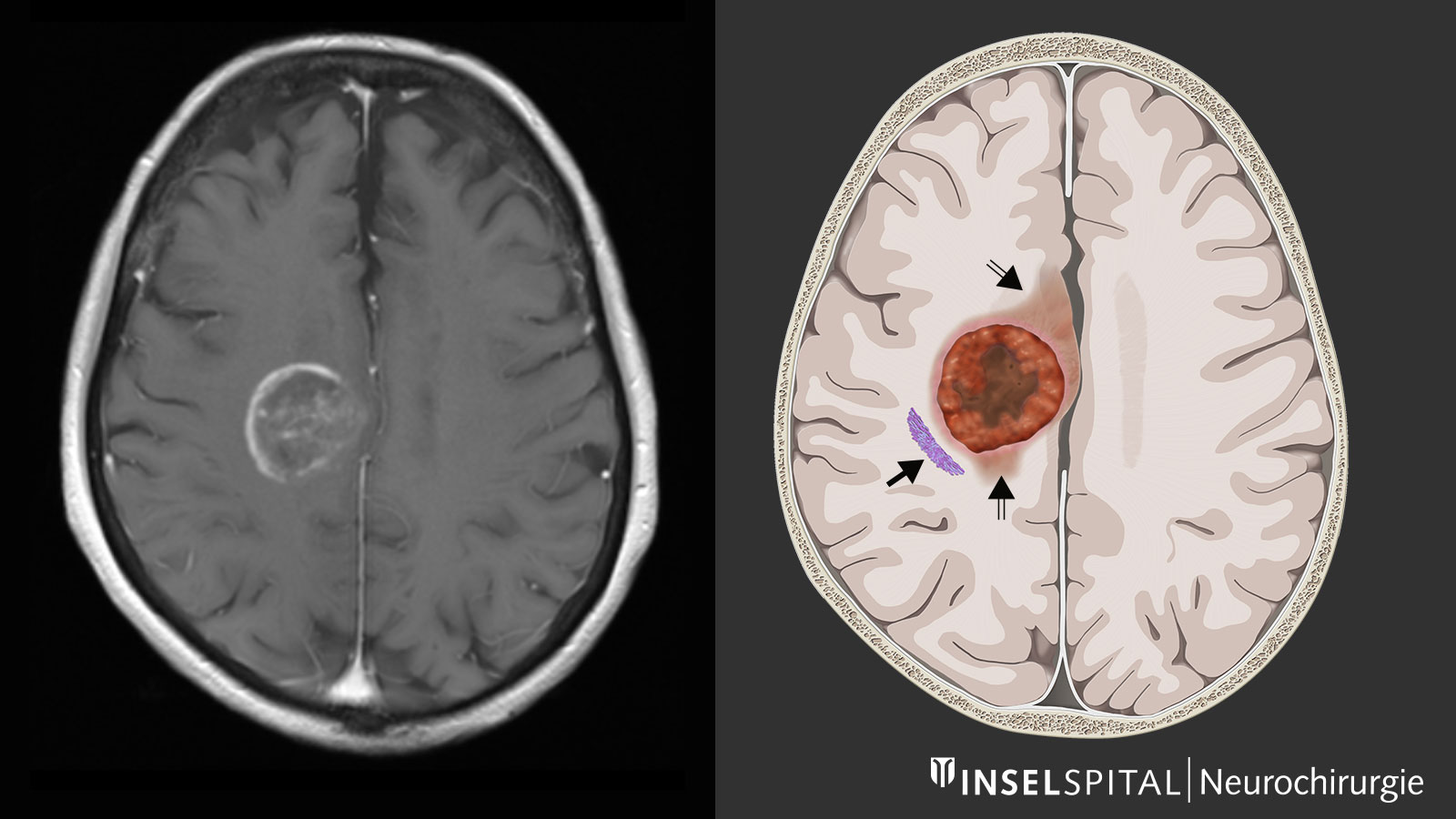
En règle générale, un examen par résonance magnétique du cerveau est effectué pour clarifier les troubles. L'imagerie par résonance magnétique (IRM) montre la tumeur comme une zone hétérogène qui absorbe le produit de contraste. On observe typiquement une prise de contraste annulaire et irrégulière avec une zone sombre au centre, où les cellules sont mortes (nécrose). On observe parfois une propagation le long des voies fibreuses, ce qui peut entraîner l'implication de différents lobes cérébraux. Autour de la tumeur, la séquence pondérée en T2 de l'IRM révèle une zone claire d'étendue variable. Il s'agit d'un œdème cérébral. Contrairement aux métastases, où cet œdème résulte d'une simple réaction tissulaire, cette zone contient également des cellules tumorales actives dans le cas des glioblastomes.
La neuro-imagerie avancée (Advanced Neuroimaging)
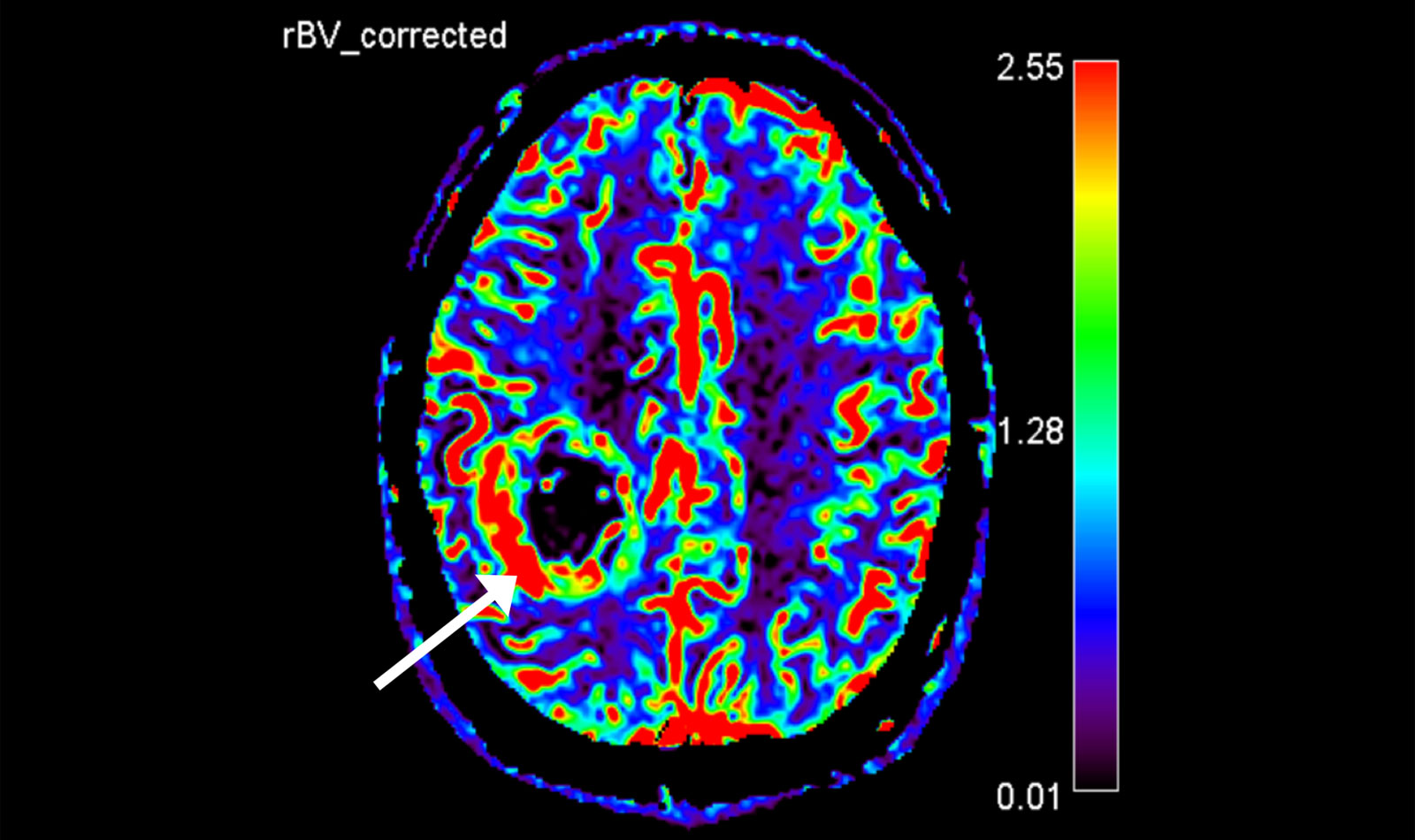
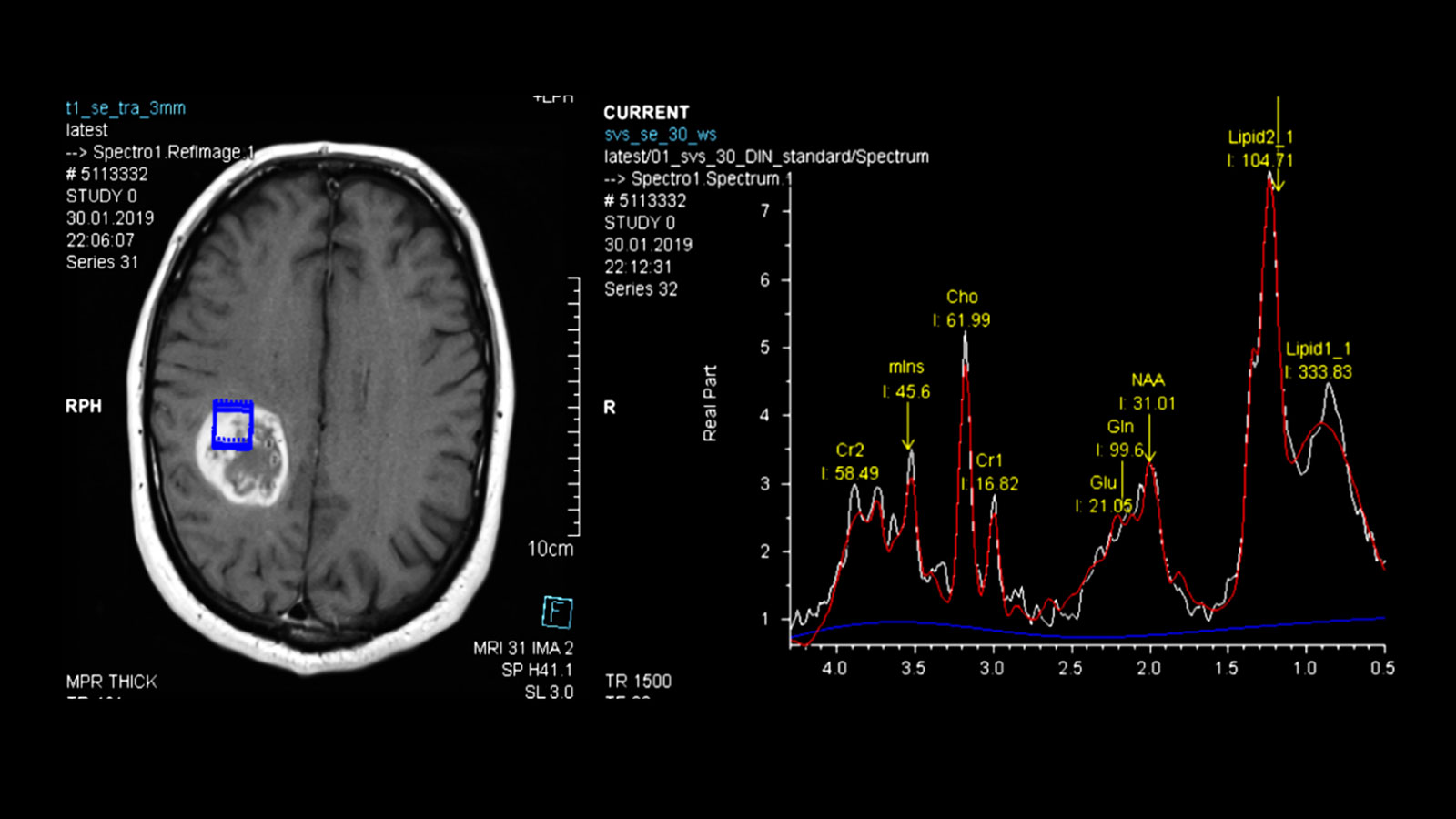
Une différenciation supplémentaire par imagerie peut être réalisée à l'aide de la neuro-imagerie avancée.
Il s'agit notamment d'une méthode de mesure du flux sanguin local (perfusion), étant donné que le volume sanguin est augmenté dans la zone de la tumeur, et d'une mesure des métabolites locaux (métabolites) par spectroscopie par résonance magnétique (spectroscopie RM ou MRS), étant donné que certains métabolites sont également augmentés ou diminués dans les gliomes.
Les résultats de ces mesures peuvent notamment être utiles pour distinguer les glioblastomes d'autres tumeurs comme les métastases ou les lymphomes.
Opération – la première étape de la thérapie
Le traitement standard des glioblastomes consiste en une combinaison de résection microchirurgicale, de radiothérapie et de chimiothérapie.
La résection chirurgicale fait aujourd'hui partie intégrante du concept de traitement *, *, *, *, *, *, *. Plus la masse tumorale peut être retirée, plus l'évolution de la maladie est favorable *, *, *, *, *, *, *, *, *. C'est pourquoi l'objectif de l'opération est une résection complète de la tumeur, confirmée par une IRM. En outre, l'ablation de la tumeur atténue l'effet de la masse sur les tissus cérébraux environnants et donc les symptômes causés par la tumeur. Le tissu tumoral prélevé peut ensuite être examiné par histologie et biologie moléculaire.
Cependant, comme les glioblastomes infiltrent le tissu cérébral de manière diffuse et se développent le long des voies de fibres de la substance blanche, des cellules tumorales subsistent même après une résection complète. Celles-ci doivent être détruites par une radiothérapie et une chimiothérapie.
Pourquoi faut-il viser une opération radicale en cas de glioblastome ?
Selon les études actuelles, on part du principe qu'au moins 80 % de la tumeur doivent être retirés ou qu'il ne doit rester que moins de 5 cm3 detumeur résiduelle pour que le patient ait un avantage de survie grâce à l'opération.
Un avantage significatif en termes de survie ne peut être obtenu que par une ablation complète de la tumeur vérifiée par IRM *, *.
Par conséquent, l'objectif principal de l'opération devrait être l'ablation complète de la tumeur cérébrale, idéalement y compris la zone d'infiltration visible sur l'image IRM, et ce, sans causer de dommages neurologiques permanents.
Résection avec marge : la résection supramarginale
Les glioblastomes contiennent des cellules tumorales qui s’étendent au-delà des limites visibles à l’IRM. Cette zone d’infiltration autour de la tumeur présente un profil biologique différent de celui du noyau tumoral * et pourrait influencer le pronostic thérapeutique. Cependant, cette zone infiltrante ne capte pas le produit de contraste, ce qui la rend difficile à délimiter radiologiquement. Une focalisation exclusive sur la partie du tumor visible à l’imagerie n’est donc pas optimale d’un point de vue oncologique.
Une résection plus large, jusqu’aux limites fonctionnelles, permet de réduire davantage la charge tumorale. On parle alors de résection supratotale ou supramarginale *, *, *. Aujourd’hui, ces résections supratotales font partie intégrante des stratégies thérapeutiques pour certains patients sélectionnés.
En chirurgie tumorale, il est connu que des portions importantes de zones cérébrales dites non éloquentes, donc « fonctionnellement silencieuses », peuvent être réséquées sans provoquer de déficits permanents chez le patient *. Toutefois, une résection supramarginale doit toujours être réalisée avec un monitoring et un mapping neurophysiologiques afin d’éviter des séquelles neurologiques durables.
Dans quel délai doit-on opérer ?
En raison de la rapide croissance des glioblastomes, l'opération doit être réalisée rapidement. Plus le temps passe, plus les cellules tumorales migrent dans les environs. La tumeur se développe et grossit, le risque opératoire augmente et la radicalité possible de la résection diminue. L'opération doit donc idéalement être réalisée dans les 1 à 2 semaines suivant le diagnostic.
Notre protocole OPTIMISST
Il existe un certain nombre de facteurs qui contribuent à la réussite du traitement d'une tumeur. Sur la base de ces facteurs, nous avons développé notre propre concept de traitement, le protocole OPTIMISST. OPTIMISST signifie «Optimized Standard and Supportive Therapy» (thérapie standard optimisée et de soutien) et complète la thérapie classique des tumeurs cérébrales. Ce protocole n'existe sous cette forme que dans notre clinique.
Imagerie par résonance magnétique
Pour une préparation optimale, on commence par réaliser une IRMspéciale. Cela permet d'évaluer la tumeur le plus précisément possible et de planifier l'opération avec précision. Selon la localisation de la tumeur, d'autres examens peuvent être nécessaires.
Une IRM fonctionnelle (IRMf) peut fournir des informations précieuses sur la localisation de la fonction du langage et des centres de mouvement.
Stimulation magnétique transcrânienne guidée par navigation
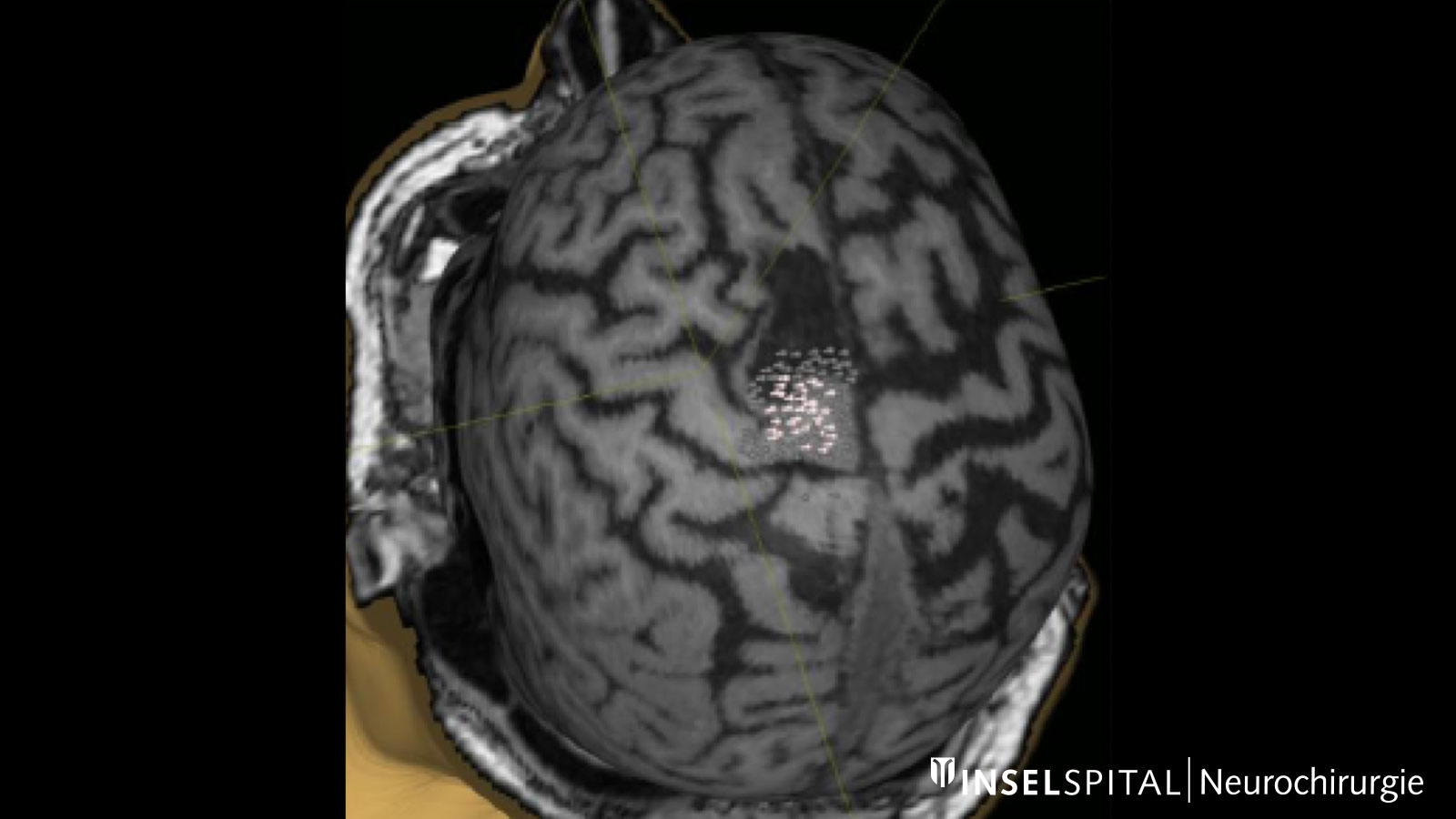
Pour localiser précisément les centres de mouvement, on a souvent recours à la stimulation magnétique transcrânienne guidée par navigation (nTMS). Il s'agit d'un examen non invasif, bien toléré par la plupart des patients, qui est proposé à l'Inselspital dans le cadre d'une étude multicentrique. Les données ainsi recueillies aident le chirurgien à planifier l'accès chirurgical et à déterminer la stratégie opératoire.
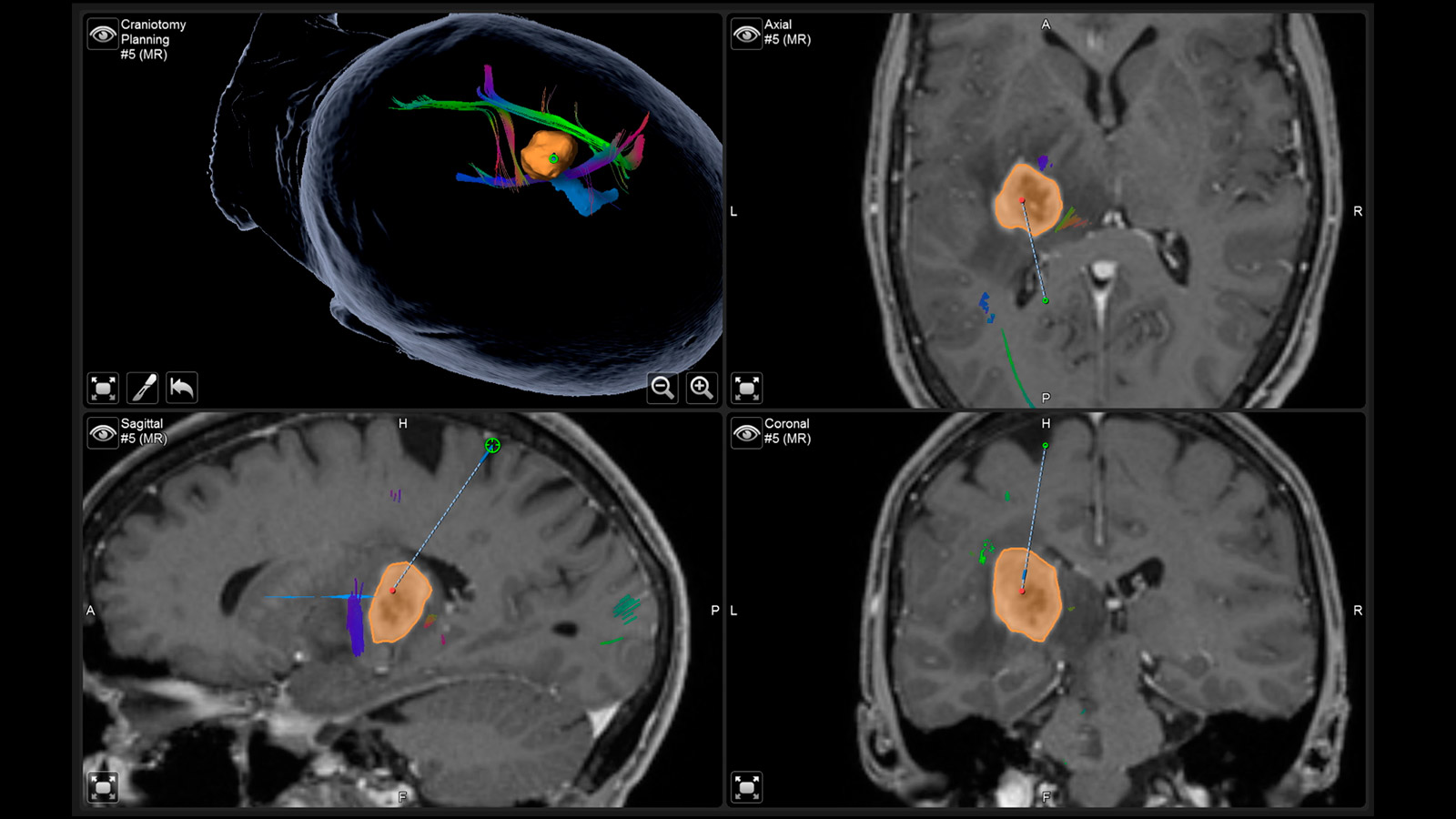
Fiber tracking: représentation des voies de fibres cérébrales
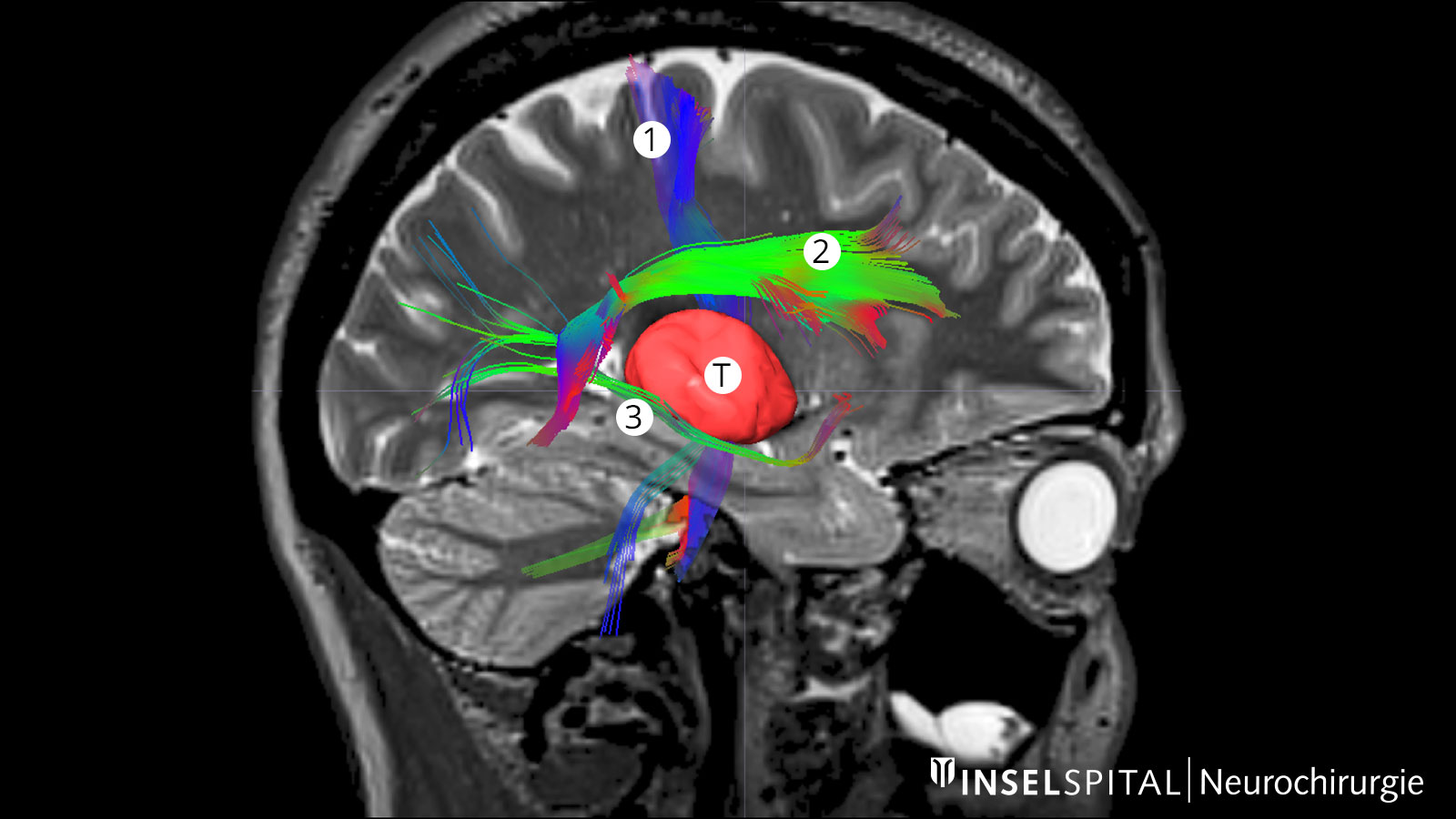
La tractographie, ou fiber tracking (fibre optique), est une technique permettant de visualiser les faisceaux de fibres dans le cerveau. La représentation de ces trajets avant une intervention chirurgicale aide le chirurgien à choisir le chemin le plus optimal et le plus sûr pour contourner la tumeur, tout en évitant les structures essentielles.
Cela est particulièrement crucial pour la voie pyramidale, qui constitue la connexion directe entre le centre moteur du cerveau et la moelle épinière et doit impérativement être préservé lors de l’opération. D'autres voies de fibres importantes concernent principalement les fonctions cérébrales telles que la parole et la vision.
Faut-il faire une biopsie avant l'opération ?
Si la tumeur peut être réséquée facilement, nous ne procédons pas à une biopsie séparée au préalable. Si la résection n'est pas possible en raison de la localisation de la tumeur dans un centre fonctionnellement important ou en raison de son extension diffuse, il convient au moins de procéder à une biopsie pour examiner les tissus et confirmer le diagnostic. Le risque de complications lié à une biopsie est faible, les saignements graves ne surviennent que dans environ 1 % des cas.
Cependant, un problème plus fréquent est la mauvaise classification des tumeurs dans jusqu'à 25 % des cas * : comme un gliome est souvent composé de différentes parties de cellules hétérogènes, il peut arriver que des cellules d'une partie moins maligne soient prélevées lors de la biopsie et qu'un gliome de bas grade soit diagnostiqué à tort, alors qu'il s'agit en réalité d'un gliome agressif de haut grade.
Afin de réduire le nombre d'erreurs de diagnostic, nous planifions systématiquement des biopsies à l'aide de
- méthodes de neuro-imagerie avancées telles que la spectroscopie par résonance magnétique (spectroscopie RM ou SRM) ou
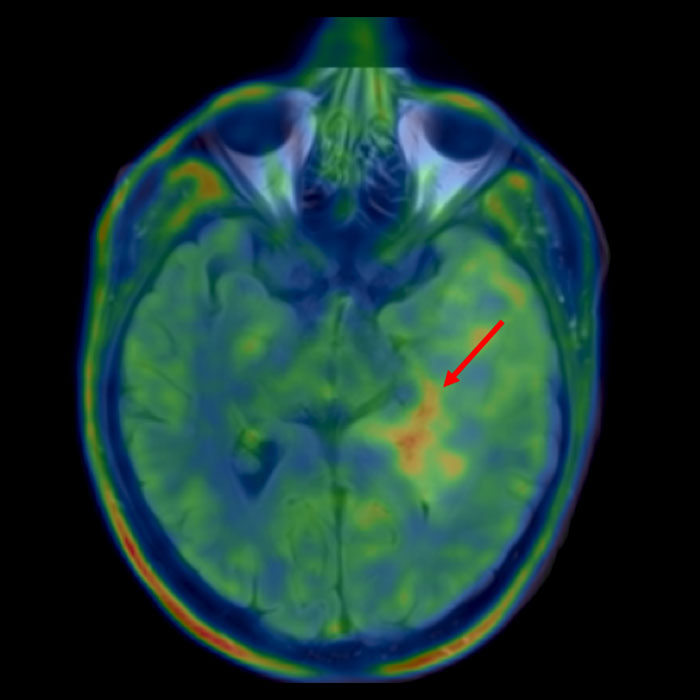
- des méthodes de médecine nucléaire telles que la TEP au FET. La TEP (tomographie par émission de positons) est une méthode d'imagerie qui permet de mettre en évidence les parties particulièrement actives de la tumeur grâce à l'administration d'une molécule «intelligente», en général de la fluoréthyltyrosine (FET) dans notre cas. La FET est un acide aminé marqué qui indique un métabolisme accru des acides aminés dans les cellules tumorales. Ce phénomène peut être enregistré à l'aide d'une caméra. Cette méthode permet souvent d'identifier un point chaud avec des cellules tumorales particulièrement actives en superposant les données TEP avec les données IRM. Ce point chaud constitue une bonne cible pour une biopsie.
La sécurité des opérations est garantie par différentes techniques innovantes. Grâce à des procédures chirurgicales précises et à une surveillance peropératoire étendue, le taux de complications des résections tumorales est aujourd'hui très faible *, *, *, *, *, *, *, *.
Neuronavigation
La «neuronavigation» fonctionne comme un GPS pendant l'opération et indique au neurochirurgien le chemin à suivre. L'IRM réalisée avant l'opération fournit les «cartes» individuelles.
Augmented Reality
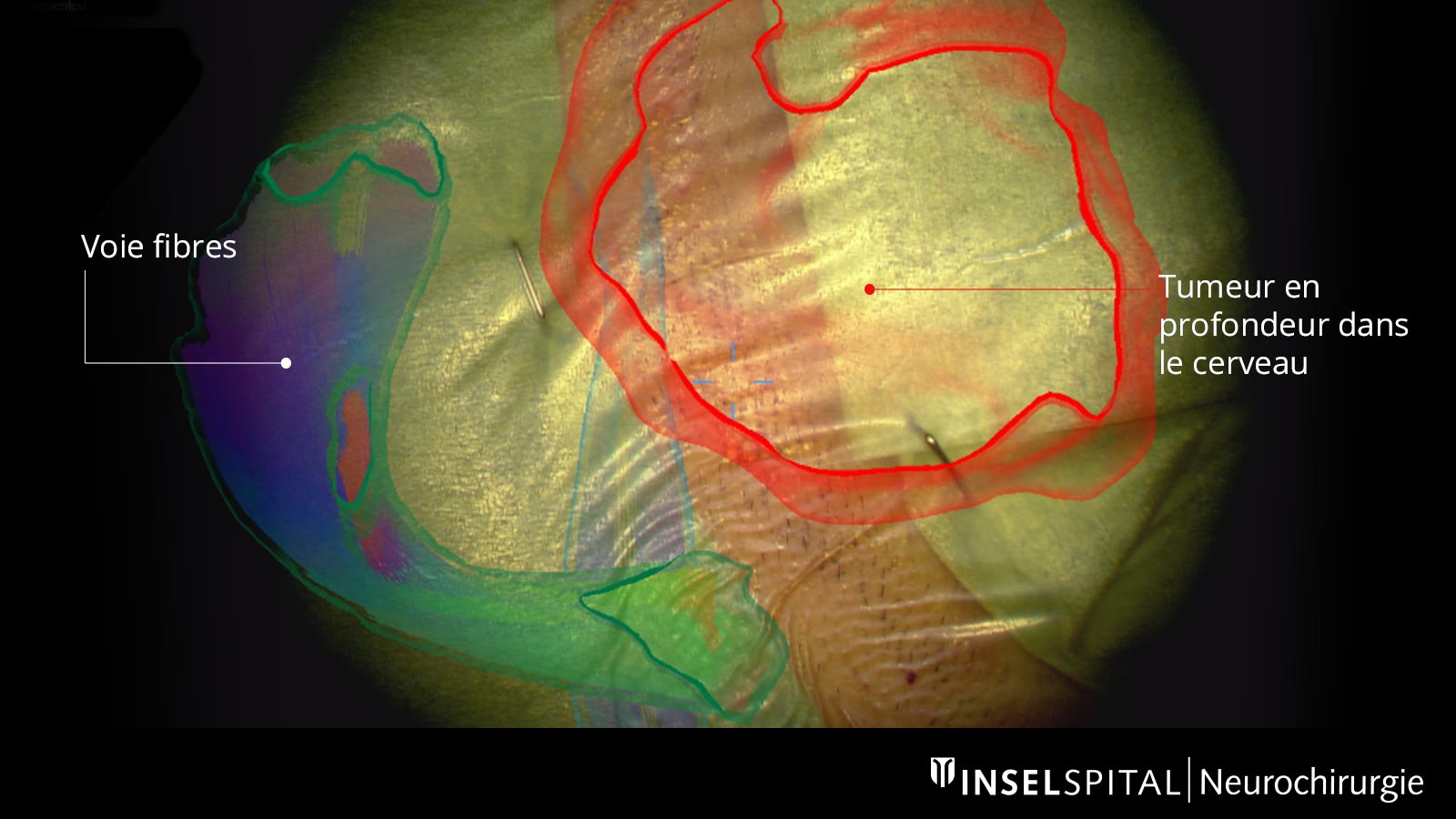
Les voies fibreuses tracées avant l'opération, ainsi que la tumeur elle-même et d'autres centres importants, peuvent être affichés virtuellement au microscope chirurgical et projetés sur la surface de la tête. Grâce à cette réalité augmentée (augmented reality), le chirurgien peut mieux s'orienter et planifier l'accès à la tumeur aussi petit que possible, mais aussi grand que nécessaire.
Neuromonitoring peropératoire (IONM)
Les avantages de l'opération radicale du glioblastome ne s'appliquent que si l'on peut éviter des paralysies permanentes, des troubles du langage ou d'autres dommages graves. Sinon, le temps de survie diminue à nouveau *. Une surveillance fonctionnelle spécialisée – le neuromonitoring peropératoire (IONM) – vise à prévenir les dommages liés à l'opération et constitue dans de nombreux cas l'instrument chirurgical le plus important et un domaine de spécialité de notre clinique.
Le type de surveillance est déterminé individuellement pour chaque patient en tenant compte des fonctions cérébrales voisines. En règle générale, une distance d'environ 3 mm d'une zone importante du cerveau nous suffit pour retirer la tumeur sans déficits neurologiques permanents. Les procédures suivantes sont généralement utilisées :
- Monitoring : une fréquence de surveillance électrique pour tester les fonctions de l'ensemble du trajet de conduction nerveuse et cérébrale
- Mapping dynamique : un radar basé sur des micro-courants continus pour déterminer la distance par rapport au centre ou à la voie cérébrale
- Une stimulation de courte durée par «courant parasite» lors de chirurgies éveillées
Monitoring
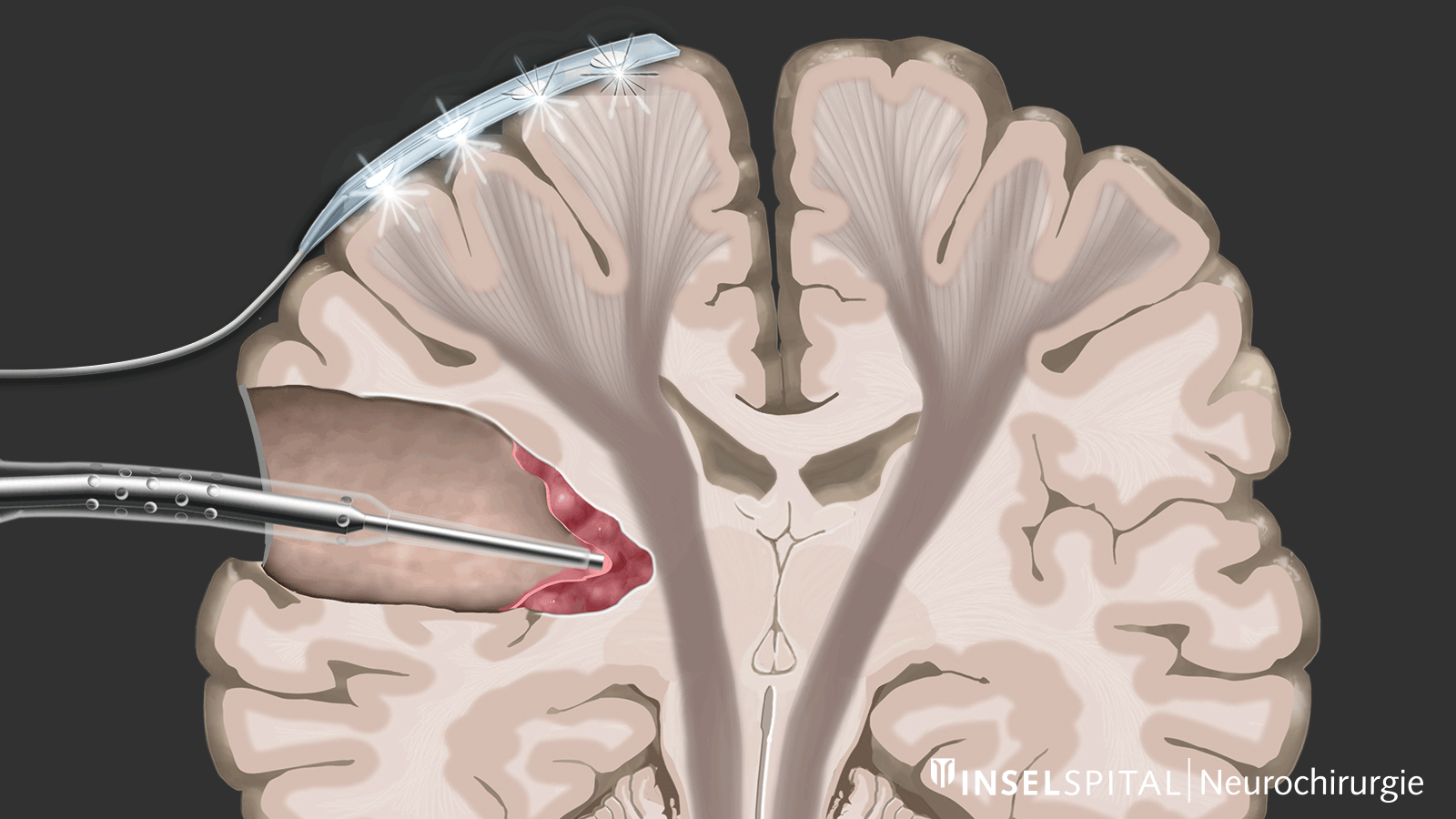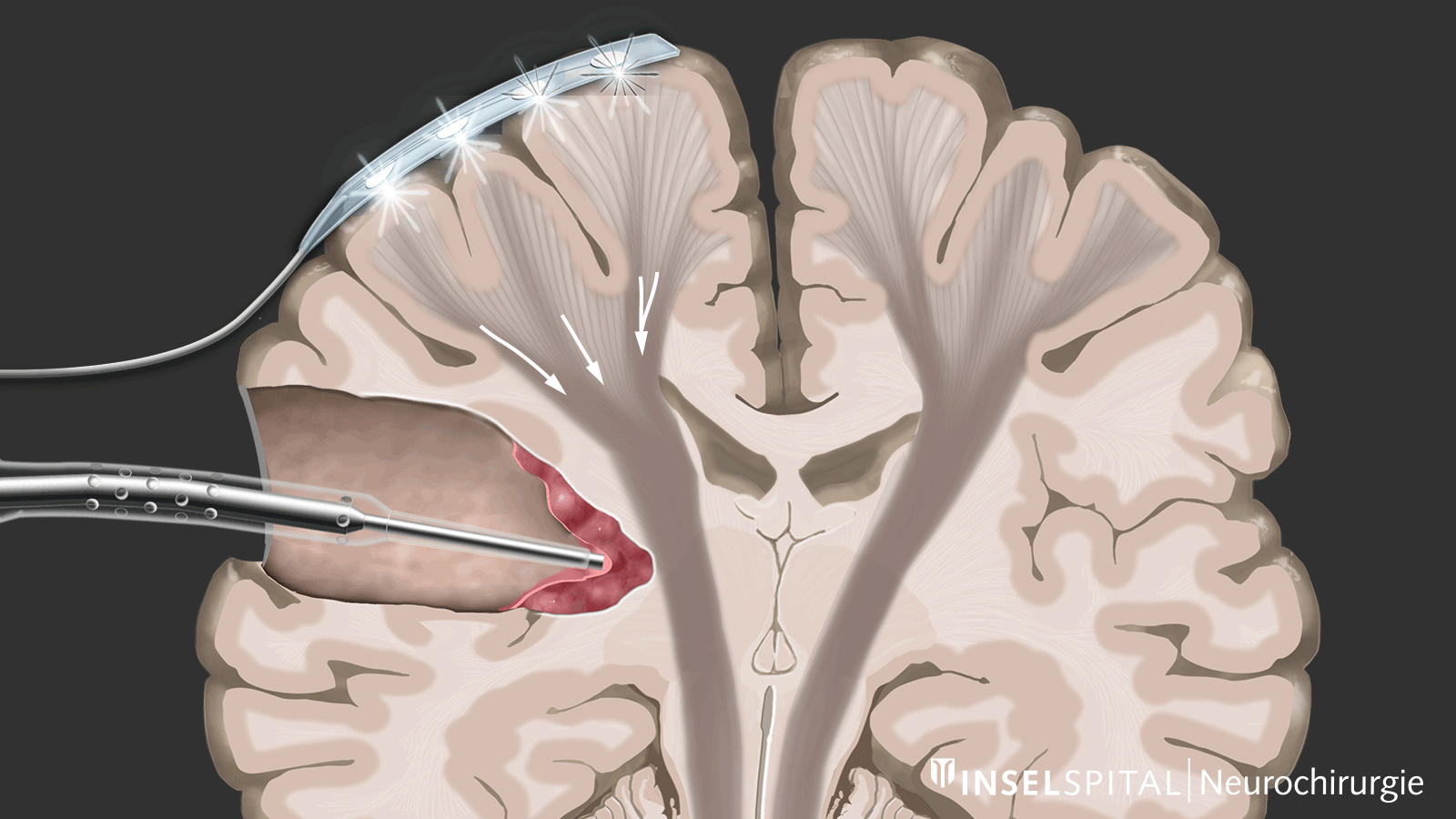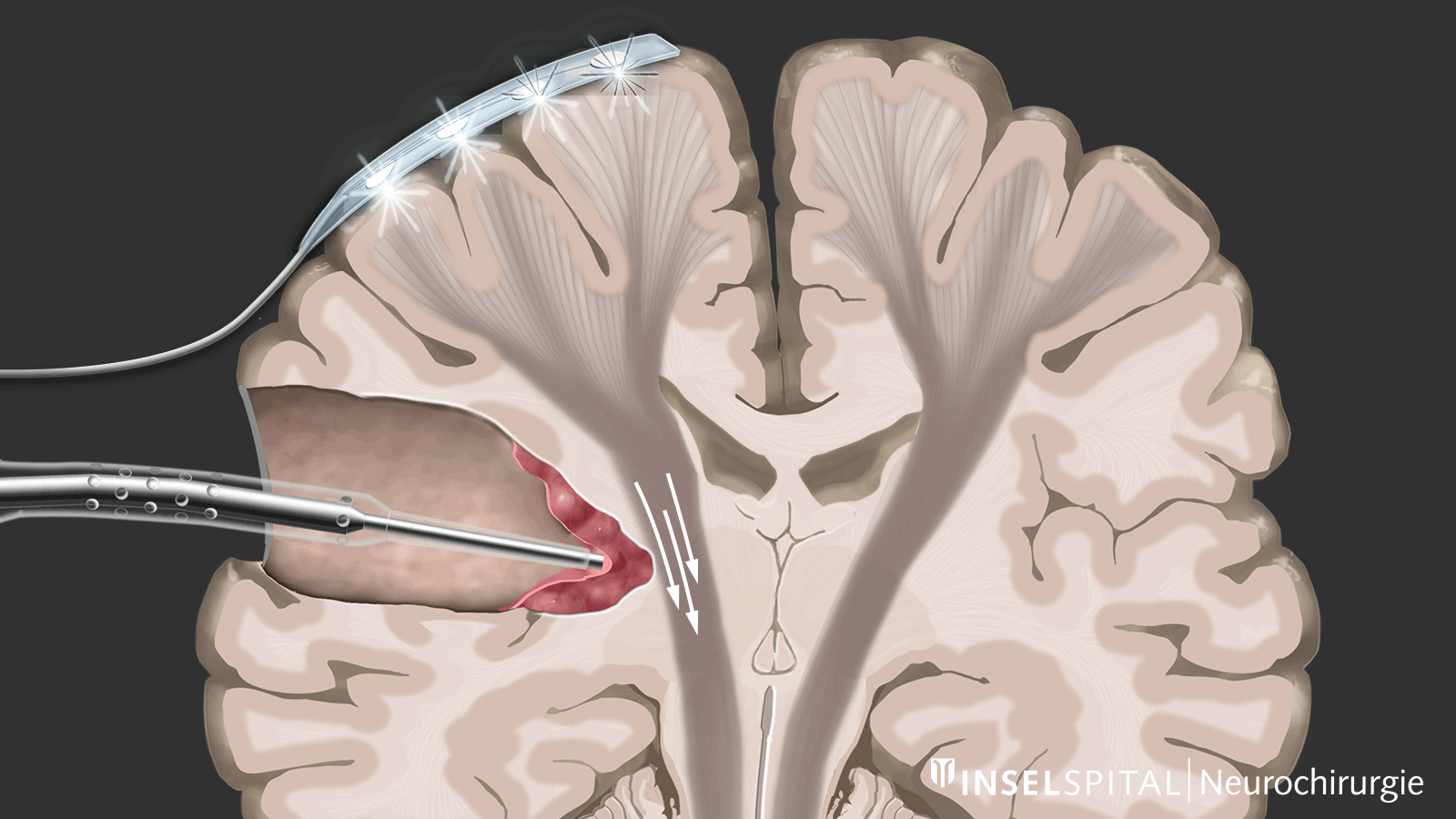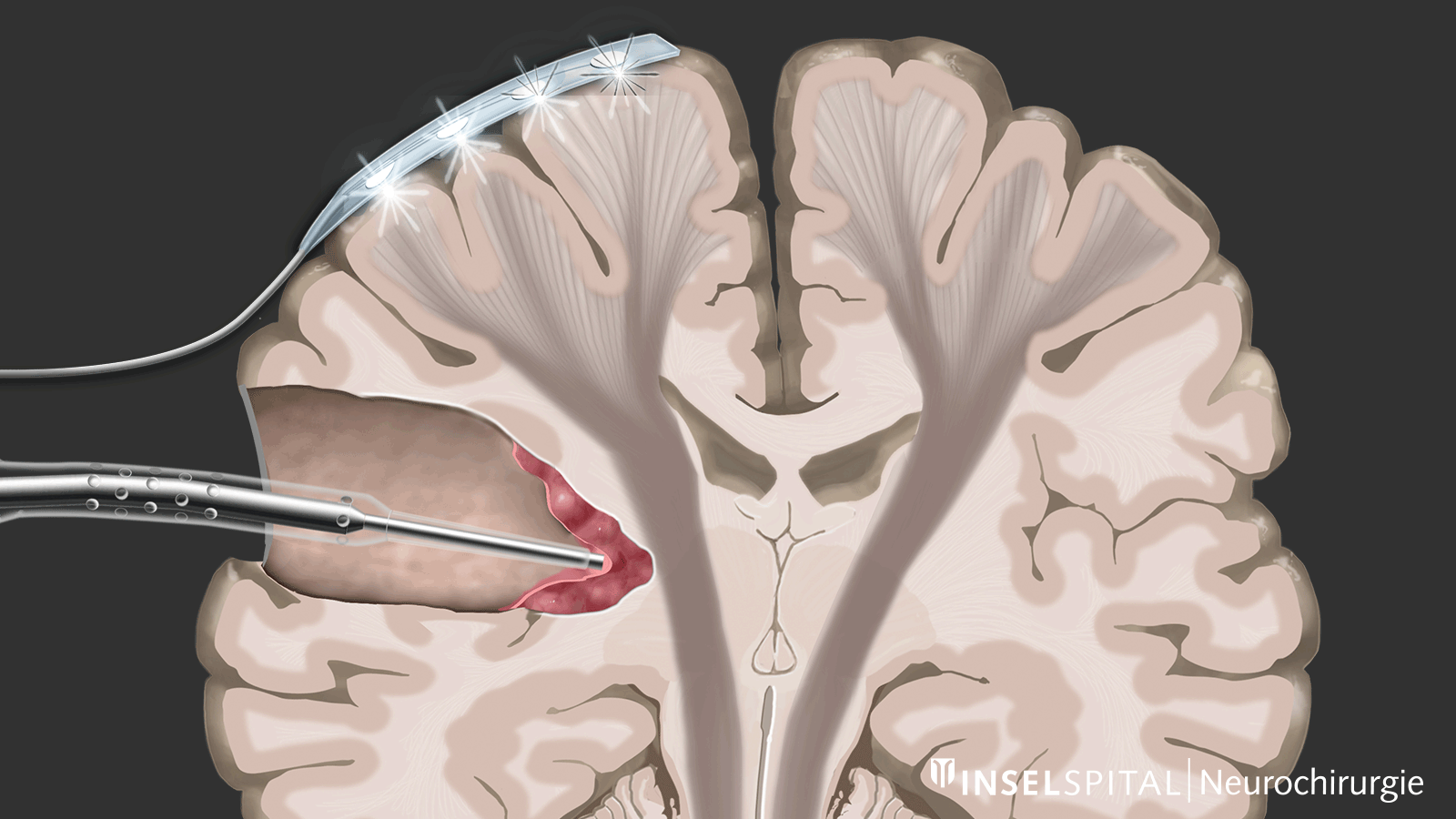
Le monitoring est une méthode de surveillance. Une électrode de surveillance, placée sur le centre du mouvement, émet en continu une impulsion électrique. Cette impulsion déclenche un mouvement unique qui est reçu par le muscle cible. L’émission de l’impulsion dans le cerveau et sa réception dans le muscle cible signalent une voie motrice intacte et fonctionnelle.
Mapping dynamique
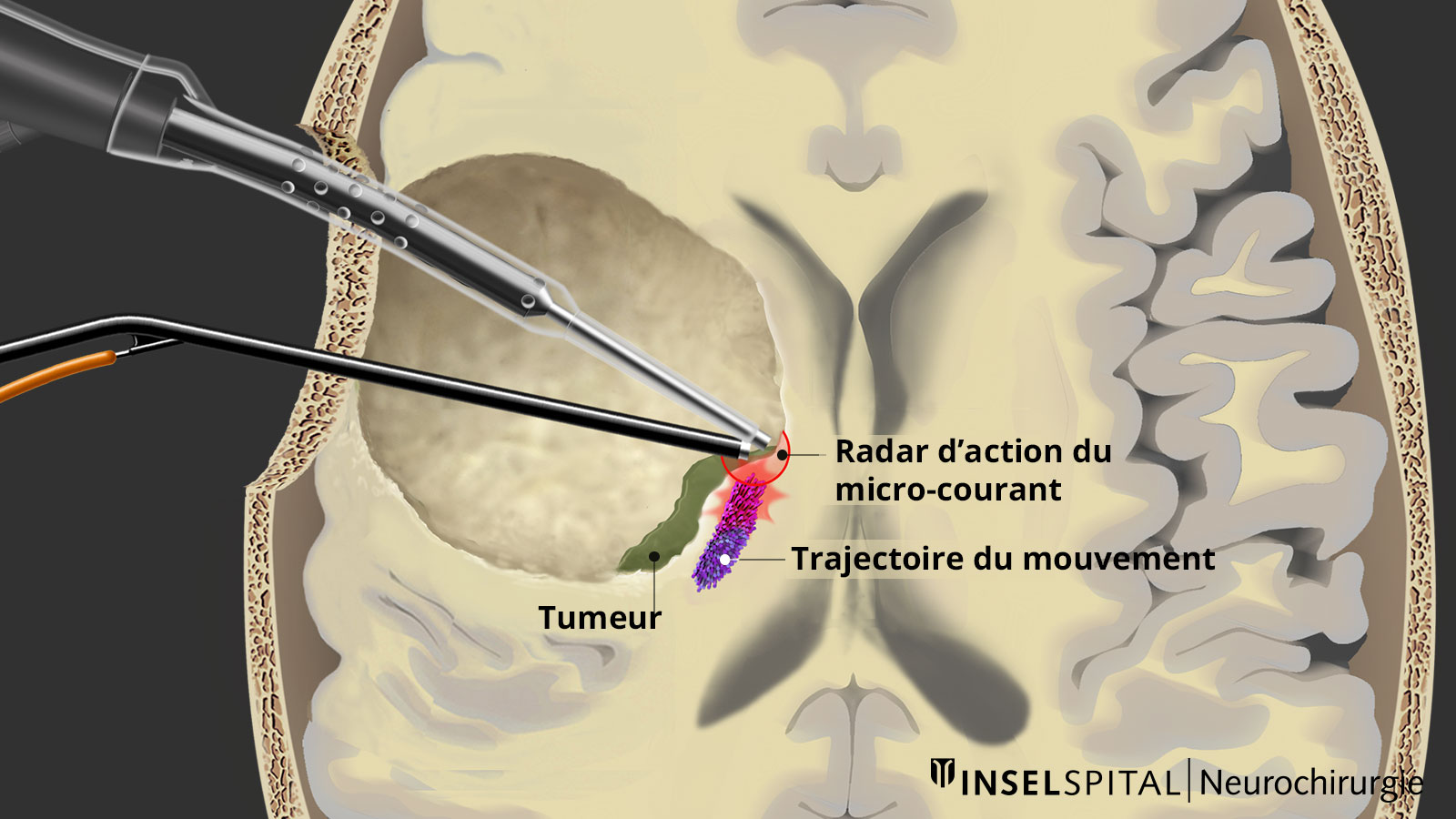
Le mapping est une méthode de localisation utilisée lorsque le site fonctionnel à protéger est inconnu. À l’Inselspital, nous utilisons le mapping dynamique continu, où la stimulation par micro-courants est intégrée à l’instrument chirurgical d’aspiration. À chaque étape de l’ablation tumorale, la distance de sécurité par rapport à la voie motrice est enregistrée, de manière similaire à un radar. Cette technique est désormais utilisée dans plus de 50 pays à travers le monde.
Chirurgie éveillée
Contrairement à la motricité, il est impossible de surveiller des fonctions complexes telles que le langage, la compréhension du langage, le calcul, la pratique d'un instrument de musique ou la lecture chez un patient sous anesthésie. Si la tumeur se trouve à proximité de ces centres, il est nécessaire que le patient soit éveillé pendant une partie de l'opération et effectue des tests spéciaux avec un neuropsychologue. La tumeur est retirée pendant qu'une microsonde pénètre et stimule le tissu cérébral environnant à environ 5 mm de profondeur à l'aide de micro-courants pulsés. Si une fonction importante se trouve à proximité, le courant atteint le centre et le patient commet des erreurs dans ses tâches. La localisation d'une fonction invisible peut ainsi être déterminée et être épargnée pendant l'opération.
Fluorescence 5-ALA
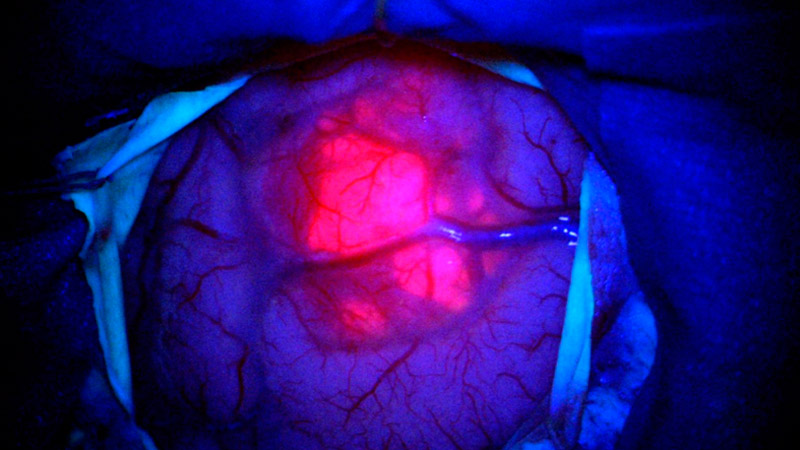
L'utilisation systématique de 5-ALA (Gliolan®) est un élément important de la chirurgie moderne des tumeurs *. Le 5-ALA est administré aux patients sous forme liquide quelques heures avant l'opération. Il se forme un produit métabolique qui s'accumule dans les cellules tumorales des gliomes de haut grade et présente des propriétés fluorescentes *, *, *. Lors de l'opération sous lumière bleue, le chirurgien peut reconnaître la tumeur comme une structure rougeâtre fluorescente et retirer le tissu malade de manière plus ciblée *, *, *. Le tissu cérébral sain ne présente aucune fluorescence.
Une étude que nous avons menée sur la résection par fluorescence des glioblastomes nous a appris que lorsque l'on utilise le 5-ALA pendant l'opération, les bords de la tumeur dépassent de plus de 0,5 cm le volume de la tumeur, absorbent le produit de contraste et sont visibles sur l'image IRM *.
Thérapie thermique interstitielle au laser (LITT)
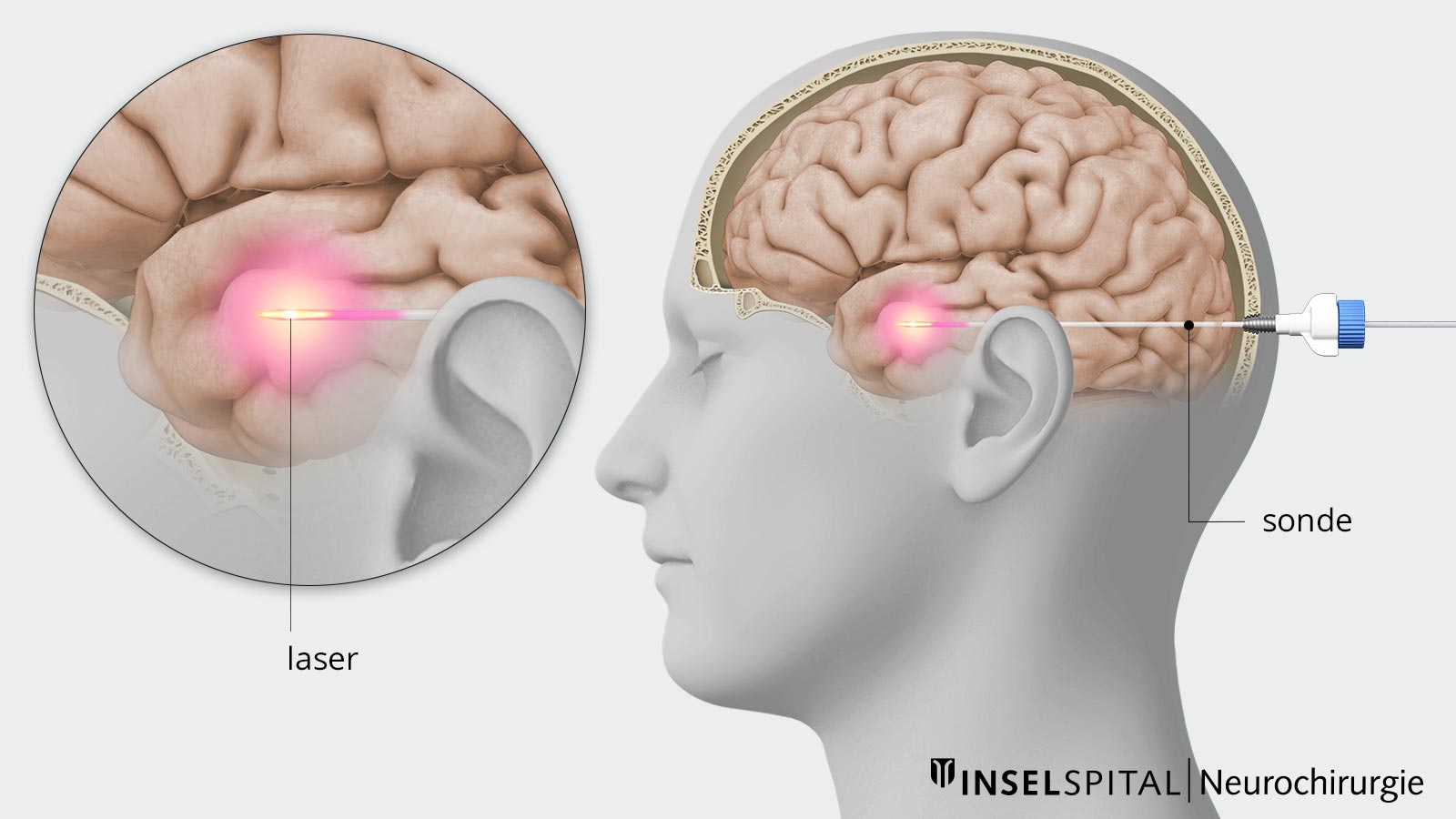
La thérapie thermique interstitielle au laser (LITT) est une procédure mini-invasive assistée par imagerie. Elle consiste à chauffer et détruire des tissus de manière ciblée à l'aide d'énergie laser. La LITT est principalement utilisée pour traiter les foyers épileptiques, les tumeurs cérébrales ou d'autres lésions profondes du cerveau.
Imagerie peropératoire
Comme il est difficile de distinguer un tissu sain d'un tissu tumoral, même au microscope, on a recours à différentes modalités d'imagerie pendant l'opération pour vérifier directement l'étendue de la résection.
Les ultrasonssont utilisés de manière routinière, mais ils ont leurs limites lorsqu'il s'agit de visualiser les tissus tumoraux résiduels.
La méthode la plus précise est l'examen par IRM peropératoire. Pour ce faire, le patient est transféré en IRM après l'ablation de la tumeur, pendant l'opération. Ainsi, s'il reste des résidus tumoraux, ils peuvent être retirés pendant l'opération. À cet effet, une salle d'opération a été construite à l'Inselspital, avec une connexion directe à un appareil d'IRM à haut champ.
IRM 24 à 48 heures après l'opération
Il est possible que des résidus de tumeur subsistent après l'opération, car la tumeur ressemble souvent à du tissu cérébral normal dans sa périphérie et il n'est pas toujours possible en neurochirurgie d'opérer en laissant une marge de sécurité d'un centimètre autour de la tumeur.
Si une IRM de contrôle précoce réalisée 24 à 48 heures après l'intervention montre qu'il reste encore un minuscule résidu tumoral, celui-ci doit être retiré lors d'une seconde opération le lendemain, à condition que cela soit possible en raison de la localisation. Notre expérience montre que malgré l'utilisation de toutes les aides techniques, il reste des tissus tumoraux résiduels pouvant être retirés chez 5 à 10 % des patients et qu'une seconde opération est alors nécessaire *. Dans une étude menée sur nos propres patients, nous avons pu montrer que la deuxième opération permet presque toujours une ablation complète, qu'elle est bien tolérée et qu'elle ne présente qu'un risque minime pour le patient *. Le séjour à l'hôpital n'est prolongé que d'environ deux jours.
Histologie
Après l'examen histologique des tissus prélevés, la suite de la procédure est discutée par une équipe interdisciplinaire de spécialistes composée de neurochirurgiens, de radio-oncologues et d'oncologues médicaux. Cela se fait dans le cadre de notre tumor board, une conférence hebdomadaire interdisciplinaire sur les tumeurs, à laquelle participent régulièrement par vidéoconférence des experts en neuro-oncologie de renommée internationale.
Rééducation neurologique
Une rééducation neurologique est indiquée en cas de déficits neurologiques, mais ne doit pas retarder le traitement ultérieur. Les patients ne présentant pas de déficits neurologiques n'ont généralement pas besoin d'être hospitalisés en rééducation.
La radiothérapie et la chimiothérapie : la prochaine étape de la thérapie
Le traitement standard après l'opération pour les patients en bon état général consiste en une combinaison de chimiothérapie et de radiothérapie. La radiothérapie et la chimiothérapie commencent généralement 3 à 4 semaines après l'opération, afin que la plaie ait suffisamment de temps pour guérir *, *.
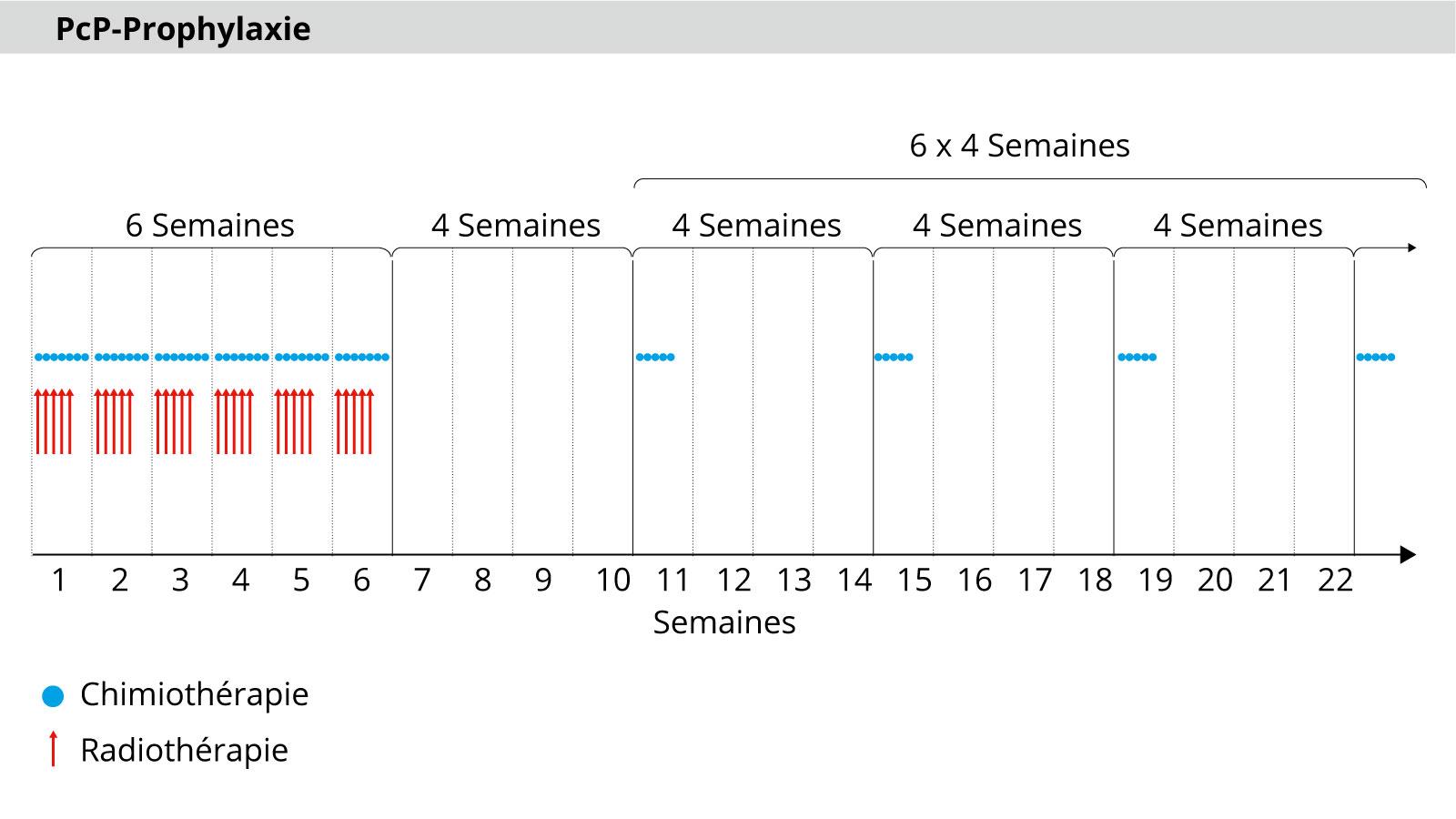
En radiothérapie, l'irradiation est réalisée en 30 séances au total sur une période de 6 semaines. En règle générale, il y a 5 séances par semaine, chacune avec une dose de 2 Gy, jusqu'à une dose totale de 60 Gy.
Les effets secondaires les plus fréquents de l'irradiation sont :
- Fatigue
- Nausées
- Irritations cutanées
- Perte de cheveux
Parallèlement aux irradiations, une chimiothérapie quotidienne est réalisée. Après 30 séances, la dose maximale possible d'irradiation est atteinte. La chimiothérapie est ensuite poursuivie en tant que traitement de maintien. Cela signifie qu'un cycle de 5 jours a lieu toutes les 4 semaines – pour un total de 6 cycles.
Patients âgés
Les patients âgés (plus de 70 ans) constituent un cas particulier. Afin de ne pas trop les solliciter, ils sont traités selon un schéma raccourci. L'irradiation est alors généralement effectuée en 15 séances jusqu'à une dose totale de 40 Gy *.
Pour les patients dont l'état général est plus mauvais, il est également possible de se limiter à une radiothérapie ou à une chimiothérapie, en fonction de l'ADN de la tumeur *.
Temodal
Le médicament chimiothérapeutique utilisé est le temozolomide (Temodal®). Dans la grande étude EORTC-NCIC, l'efficacité de la chimiothérapie en complément de la radiothérapie a été démontrée *, *. Les résultats à long terme de cette étude confirment également cette efficacité *. En particulier, les patients présentant une méthylation du promoteur MGMT, chez lesquels les cellules tumorales ne peuvent plus réparer leurs dommages à l'ADN, bénéficient d'une chimiothérapie supplémentaire.
En général, le traitement par Temodal est bien toléré. L'effet secondaire le plus fréquent est unelégère nausée. Un effet secondaire rare mais grave est la suppression de la moelle osseuse.
Après 6 cycles de traitement avec Temodal, le patient passe en phase d'observation avec des IRM de contrôle tous les 3 mois.
Plusieurs essais avec des doses supplémentaires, des traitements plus longs ou intensifiés n'ont pas montré les résultats attendus *, *, *, *.
Lomustine
Il n'est pas encore clair si les patients présentant une hyperméthylation du promoteur MGMT bénéficient de l'ajout du médicament Lomustine en complément de la radiothérapie et de la chimiothérapie par Temodal. Dans l'étude NOA-09 publiée en 2019, un avantage en termes de survie a été trouvé pour le traitement combiné, mais en raison du faible nombre de patients, ces résultats ne sont pas encore concluants *.
Nous traitons les patients avec une méthylation claire du MGMT et un bon état général selon le schéma Lomustine/Temodal.
Immunothérapie
L'immunothérapie représente une approche thérapeutique prometteuse. La modulation du système immunitaire vise à renforcer la réponse immunitaire contre les cellules cancéreuses. L'immunothérapie au sens large regroupe plusieurs approches thérapeutiques :
Vaccin peptidique
Il s'agit d'une sorte de vaccination qui tente de sensibiliser le système immunitaire de l'organisme à des molécules de surface spécifiques des cellules du glioblastome. La reconnaissance de ces molécules de surface déclenche l'attaque du système immunitaire contre les cellules tumorales.
Les études à grande échelle menées jusqu'à présent, comme par exemple avec le vaccin peptidique spécifique à l'EGFR Rindopepimut, n'ont pas about *. L'étude NOA-21 est une étude récente sur le sujet. Elle examine l'effet d'un vaccin peptidique IDH1 seul ou en combinaison avec un inhibiteur de point de contrôle immunitaire sur les tumeurs mutées IDH1.
Virus oncolytiques
Ces virus infectent de préférence les cellules tumorales. L'infection par le virus entraîne la mort de la cellule tumorale ou la rend vulnérable au système immunitaire. Des résultats encourageants ont été obtenus avec des poliovirus recombinants (PVSRIPO), des adénovirus (DNX-2401) et le TOCA 511 *, *, * pour le traitement des glioblastomes.
Radio-immunothérapie
Dans ce cas, un radionucléide radioactif est couplé à un anticorps spécifique du gliome. Grâce à l'anticorps, les radionucléides radioactifs adhèrent aux cellules du gliome et atteignent ainsi une dose locale élevée. Les essais avec les isotopes iode-131 et yttrium-90 ont donné des résultats encourageants *. L'approche est poursuivie dans l'étude NOA-22 en cours.
Inhibiteurs de points de contrôle immunitaire.
Ce principe repose sur l'inhibition de les points de contrôle du système immunitaire de l'organisme. Ces points de contrôle inhibent normalement la réponse immunitaire et empêchent une activation incontrôlée du système immunitaire. Certaines tumeurs peuvent activer ces points de contrôle de manière ciblée et échapper ainsi au système immunitaire. C'est pourquoi le traitement par inhibiteurs de points de contrôle vise à supprimer ces points de contrôle et, par conséquent, à activer le système immunitaire. L'interaction entre PD-1 et le ligand PD-1 est le point de contrôle le mieux étudié. Les anticorps contre PD-1, par exemple le nivolumab, le durvalumab ou l'avélumab, sont utilisés avec succès pour différents types de cancer et sont également testés pour le glioblastome. L'étude NOA-21 teste actuellement l'avélumab avec ou sans combinaison avec un vaccin peptidique.
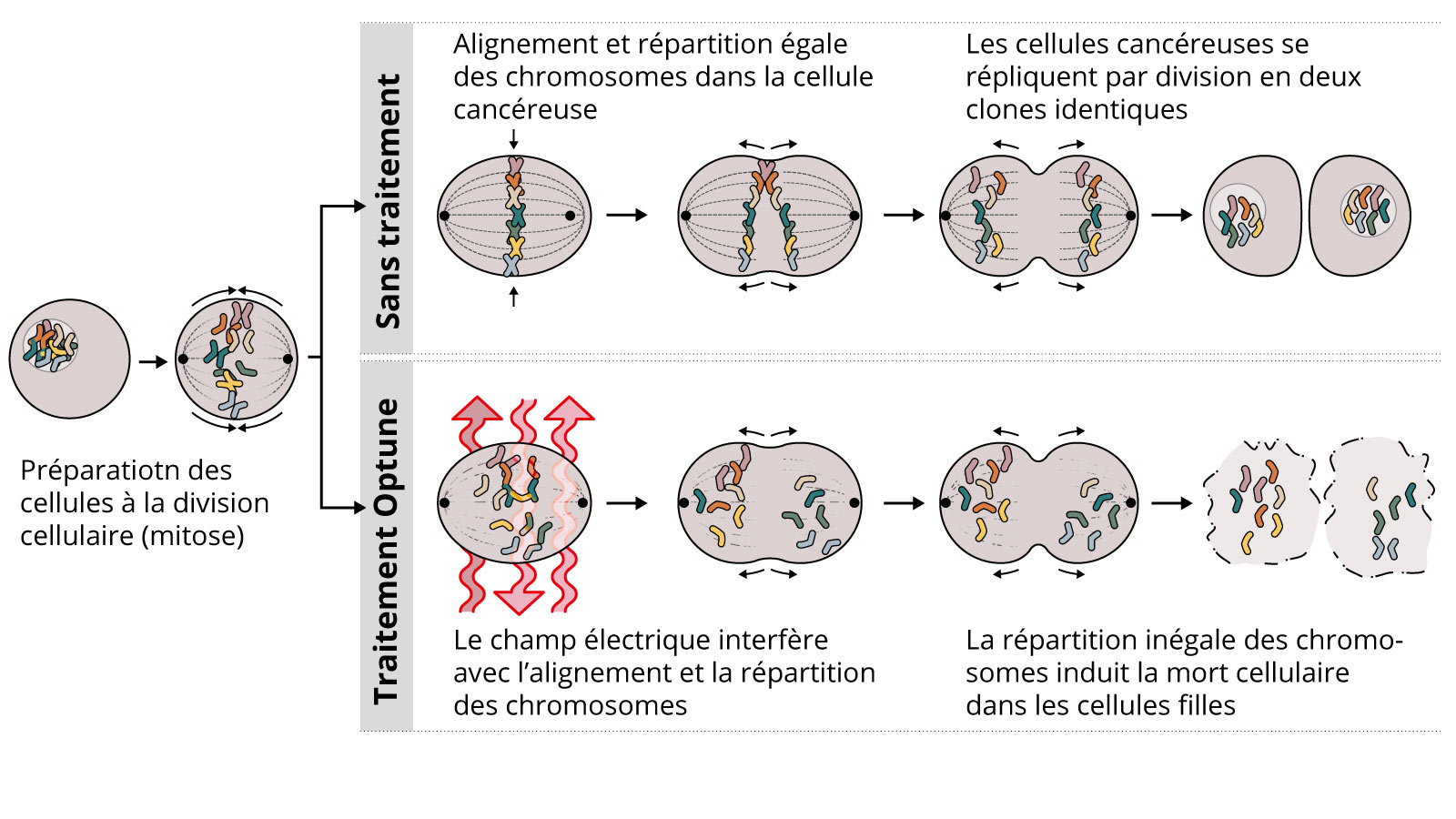
Tumor treating fields
Les tumor treating fields (TTF ou TTFields, en français champs de traitement des tumeurs) constituent une nouvelle méthode thérapeutique non invasive pour les patients atteints d’un glioblastome. À l’aide d’un dispositif médical (Optune®), des champs électriques de faible intensité sont générés via un transducteur placé sur le cuir chevelu. Ces champs visent à empêcher les cellules tumorales de se diviser et de proliférer.
Dans le cas d’un glioblastome nouvellement diagnostiqué, une étude utilisant ces champs électriques alternatifs a montré un avantage en termes de survie chez les patients ayant reçu un traitement par TTF en complément de la chimiothérapie après la radiothérapie *. L’appareil doit être porté quotidiennement aussi longtemps que possible, et le cuir chevelu doit être entièrement rasé.
Nous pensons que le traitement par TTF s’imposera comme le "gold standard" dans la prise en charge du glioblastome, au plus tard après une nouvelle étude positive ou avec une nouvelle forme d’implantation. Nous restons à votre disposition pour répondre à vos questions et faciliter la mise en contact.
Méthadone
Ces dernières années, le sujet de la méthadone dans le cadre du traitement du glioblastome a fait l'objet de nombreuses discussions. Malgré les nombreuses contributions sur les forums Internet et les réserves émises à l'égard du traitement standard, l'hypothèse selon laquelle l'administration de méthadone est bénéfique ne repose sur aucune donnée systématique, scientifiquement établie et accessible au public. À ce jour, il n'existe aucune preuve de l'efficacité de la méthadone dans le traitement des glioblastomes. De plus, la méthadone n'est pas sans effets secondaires.
Que se passe-t-il si la tumeur se développe à nouveau ?
Malheureusement, la plupart des patients atteints d’un glioblastome développent une récidive, même après une chirurgie réussie et un traitement de suivi optimal. La cause principale réside d’une part dans la croissance infiltrante et diffuse de ces tumeurs. D’autre part, certaines études suggèrent que les cellules souches tumorales jouent un rôle clé. Elles pourraient être impliquées dès l’origine du développement tumoral, se montrer résistantes aux thérapies classiques et ainsi favoriser la récidive. Idéalement, un traitement devrait également être efficace contre ces cellules souches tumorales. Malheureusement, ce n’est pas encore le cas à ce jour.
Le traitement d'une récidive dépend de différents facteurs :
- l'état neurologique du patient
- la dynamique temporelle
- les marqueurs tumoraux moléculaires
- thérapies déjà effectuées
À l'Inselspital, nous avons une approche agressive basée sur l'observation du modèle de croissance. Plus les tumeurs grossissent, plus elles créent leur propre environnement, dans lequel elles peuvent mieux se développer. C'est pourquoi l'étroite surveillance par IRM et le traitement immédiat des plus petites récidives sont l'un des principes les plus importants du protocole OPTIMISST. Nous sommes convaincus qu'une période d'attente de plusieurs semaines réduit le temps de survie, car pendant ce temps, la tumeur envoie des cellules « rechargées » dans l'environnement, qui échappent à la résection chirurgicale.
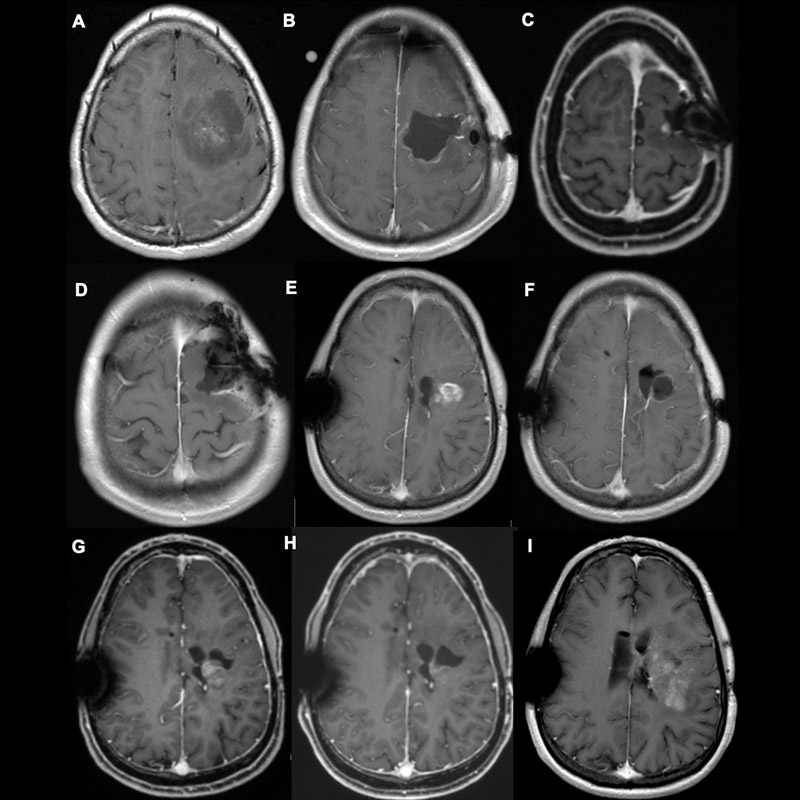
Opération en cas de récidive
En principe, en cas de récidive, il faut toujours envisager une nouvelle résection chirurgicale de la tumeur récidivante. Cependant, les opérations de récidive sont associées à un taux de complications plus élevé. Dans ce cas, la survie n'est favorable que si les fonctions qui assurent au patient une bonne qualité de vie sont préservées.
C'est pourquoi nous avons lancé l'étude ReSurge à l'Inselspital, qui est actuellement menée en Europe. Nous voulons ainsi déterminer quels patients bénéficient d'une opération de récidive et lesquels n'en bénéficient pas.
Radiothérapie et/ou chimiothérapie en cas de récidive
En plus de l'opération, il est souvent possible de procéder à une radiothérapie et/ou une chimiothérapie. L'étude DIRECTOR a montré que les patients présentant une hyperméthylation du promoteur MGMT et une récidive pendant la pause thérapeutique pouvaient à nouveau bénéficier d'un traitement par Temodal *.
Il n'existe pas encore de chimiothérapie standardisée de deuxième ligne. Celle-ci est décidée dans le cadre de notre tumor board interdisciplinaire à l'Inselspital. Les facteurs importants dans la prise de décision sont les différentes propriétés moléculaires de la tumeur et une analyse génétique détaillée des mutations motrices de la tumeur. Lors de la discussion avec des experts renommés, qui sont connectés au tumor board par conférence téléphonique, il est parfois possible d'identifier et d'utiliser des médicaments qui ont été efficaces pour d'autres types de tumeurs présentant les mêmes mutations.
Quels sont les pronostics pour un glioblastome ?
Le pronostic de la maladie dépend de nombreux facteurs. De grandes études ont montré que différents facteurs ont une influence sur la durée de survie des patients.
Facteurs influençant le temps de survie
Facteurs non influençables
- Jeune âge
- Bon état général et bonne condition physique
- Aucune défaillance des fonctions neurologiques partielles avant l'opération
- Dans le tissu tumoral : hyperméthylation du promoteur MGMT de la tumeur
- Dans le tissu tumoral : mutation IDH
Facteurs influençables
- Opération dans un délai court, c'est-à-dire ablation de la tumeur le plus tôt possible
- Administration minimale ou nulle de stéroïdes (dexaméthasone) avant et après l'opération
- Aucune perte de fonctions neurologiques partielles après l'opération, en particulier aucune paralysie ou paralysie partielle résultant d'une complication de l'opération
- Ablation complète de la tumeur à l'IRM T1 avec produit de contraste (CRET selon RANO)
- Ablation complète du signal positif FLAIR à l'IRM ou du signal hyperintense T2 à l'IRM
- Aucune complication pendant et après l'opération
- Administration minimale ou nulle de stéroïdes (dexaméthasone) pendant la radiothérapie
- Influences multifactorielles (autres facteurs de la liste de contrôle OPTIMISST)
Il est important de noter que seule une estimation approximative de l'évolution dans le temps peut être faite pour chaque patient, mais qu'aucune prédiction exacte ne peut être faite. Tous les chiffres mentionnés sont basés sur la «valeur moyenne» d'un grand nombre de patients et ne permettent pas de tirer des conclusions pour chaque patient.
Survie à long terme avec un glioblastome sous la thérapie actuelle
Les patients ayant survécu longtemps sont définis comme ceux qui ont survécu plus de 5 ans après le diagnostic. Dans une étude à grande échelle basée sur le traitement standard actuel, cela concernait environ 10 % des patients *. Ce taux varie toutefois en fonction des caractéristiques du patient et de la tumeur. Alors qu'il est de 17 % chez les patients de moins de 50 ans, il n'est plus que de 6,4 % chez les patients de plus de 50 ans. Il a été démontré qu'un jeune âge, un bon état général, la présence d'une mutation IDH, une hyperméthylation du promoteur MGMT ainsi qu'une résection complète par neurochirurgie sont associés à une survie à long terme *, *, *.
Bien que de nombreux survivants à long terme présentent des déficits cognitifs, une bonne qualité de vie peut être atteinte dans la plupart des cas *, *. Il est important de savoir que des récidives surviennent également chez les survivants à long terme, c'est pourquoi on ne peut pas parler de guérison *.
Pourquoi vous devriez vous faire soigner à l'Inselspital
À l'Inselspital, une stratégie de traitement individuelle est définie pour chaque patient en fonction de ses besoins personnels.
Cela se fait dans le centre certifié de traitement des tumeurs cérébrales, où une équipe interdisciplinaire discute et définit toutes les options thérapeutiques individuellement pour chaque patient. En tant que centre interdisciplinaire de traitement des tumeurs cérébrales, nous sommes certifiés selon les critères des normes ISO (par l'institut de certification international ClarCert) et de la Société Allemande du Cancer (par l'institut de certification indépendant OnkoZert). Toutes les disciplines impliquées dans le Tumorboard doivent répondre à des normes de qualité élevées.
Notre tumor board (comité de cancérologie), qui se réunit chaque semaine, travaille de manière interdisciplinaire et se compose de spécialistes en neurochirurgie, neurologie, neuro-oncologie, neuroradiologie, médecine nucléaire, radio-oncologie et pathologie.
Un concept de traitement complémentaire, notre protocole OPTIMISST, a été développé et mis en œuvre à l'Inselspital.
-
McGirt MJ, Mukherjee D, Chaichana KL, Than KD, Weingart JD, Quinones-Hinojosa A. Association of surgically acquired motor and language deficits on overall survival after resection of glioblastoma multiforme. Neurosurgery. 2009;65:463-470.
-
Pitter KL, Tamagno I, Alikhanyan K et al. Corticosteroids compromise survival in glioblastoma. Brain. 2016;139:1458-1471.
-
Ostrom QT, Gittleman H, Xu J et al. CBTRUS Statistical Report: Primary Brain and Other Central Nervous System Tumors Diagnosed in the United States in 2009-2013. Neuro Oncol. 2016;18:v1-v75.
-
Ostrom QT, Gittleman H, de Blank PM et al. American brain tumor association adolescent and young adult primary brain and central nervous system tumors diagnosed in the United States in 2008-2012. Neuro-oncology. 2016;18:i1-i50.
-
Lahkola A, Auvinen A, Raitanen J et al. Mobile phone use and risk of glioma in 5 North European countries. International journal of cancer. 2007;120:1769-1775.
-
Ostrom QT, Bauchet L, Davis FG et al. The epidemiology of glioma in adults: a “state of the science” review. Neuro Oncol. 2014;16:896-913.
-
Capper D, Jones DTW, Sill M et al. DNA methylation-based classification of central nervous system tumours. Nature. 2018;555:469-474.
-
Soffietti R, Baumert BG, Bello L et al. Guidelines on management of low-grade gliomas: report of an EFNS-EANO Task Force. Eur J Neurol. 2010;17:1124-1133.
-
Inskip PD, Tarone RE, Hatch EE et al. Cellular-telephone use and brain tumors. N Engl J Med. 2001;344:79-86.
-
Pedersen CL, Romner B. Current treatment of low grade astrocytoma: a review. Clin Neurol Neurosurg. 2013;115:1-8.
-
Claus EB, Black PM. Survival rates and patterns of care for patients diagnosed with supratentorial low-grade gliomas: data from the SEER program, 1973-2001. Cancer. 2006;106:1358-1363.
-
Wen PY, Kesari S. Malignant gliomas in adults. N Engl J Med. 2008;359:492-507.
-
Mintz A, Perry J, Spithoff K, Chambers A, Laperriere N. Management of single brain metastasis: a practice guideline. Curr Oncol. 2007;14:131-143.
-
Patchell RA, Tibbs PA, Walsh JW et al. A randomized trial of surgery in the treatment of single metastases to the brain. N Engl J Med. 1990;322:494-500.
-
Jakola AS, Skjulsvik AJ, Myrmel KS et al. Surgical resection versus watchful waiting in low-grade gliomas. Ann Oncol. 2017;28:1942-1948.
-
Sanai N, Polley MY, McDermott MW, Parsa AT, Berger MS. An extent of resection threshold for newly diagnosed glioblastomas. J Neurosurg. 2011;115:3-8.
-
Sanai N, Berger MS. Extent of resection influences outcomes for patients with gliomas. Rev Neurol (Paris). 2011;167:648-654.
-
Cancer GARN. Comprehensive genomic characterization defines human glioblastoma genes and core pathways. Nature. 2008;455:1061-1068.
-
Lacroix M, Abi-Said D, Fourney DR et al. A multivariate analysis of 416 patients with glioblastoma multiforme: prognosis, extent of resection, and survival. J Neurosurg. 2001;95:190-198.
-
Salvati M, Pichierri A, Piccirilli M et al. Extent of tumor removal and molecular markers in cerebral glioblastoma: a combined prognostic factors study in a surgical series of 105 patients. Journal of neurosurgery. 2012;117:204-211.
-
Capelle L, Fontaine D, Mandonnet E et al. Spontaneous and therapeutic prognostic factors in adult hemispheric World Health Organization Grade II gliomas: a series of 1097 cases. Journal of neurosurgery. 2013;118:1157-1168.
-
McGirt MJ, Chaichana KL, Attenello FJ et al. Extent of surgical resection is independently associated with survival in patients with hemispheric infiltrating low-grade gliomas. Neurosurgery. 2008;63:700-7; author reply 707.
-
Bloch O, Han SJ, Cha S et al. Impact of extent of resection for recurrent glioblastoma on overall survival: clinical article. J Neurosurg. 2012;117:1032-1038.
-
Chaichana KL, Cabrera-Aldana EE, Jusue-Torres I et al. When gross total resection of a glioblastoma is possible, how much resection should be achieved. World Neurosurg. 2014;82:e257-65.
-
Keles GE, Lamborn KR, Berger MS. Low-grade hemispheric gliomas in adults: a critical review of extent of resection as a factor influencing outcome. J Neurosurg. 2001;95:735-745.
-
Oppenlander ME, Wolf AB, Snyder LA et al. An extent of resection threshold for recurrent glioblastoma and its risk for neurological morbidity. J Neurosurg. 2014;120:846-853.
-
Schucht P, Murek M, Jilch A et al. Early re-do surgery for glioblastoma is a feasible and safe strategy to achieve complete resection of enhancing tumor. PLoS One. 2013;8:e79846.
-
Schucht P, Knittel S, Slotboom J et al. 5-ALA complete resections go beyond MR contrast enhancement: shift corrected volumetric analysis of the extent of resection in surgery for glioblastoma. Acta Neurochir (Wien). 2014;156:305-12; discussion 312.
-
Gill BJ, Pisapia DJ, Malone HR et al. MRI-localized biopsies reveal subtype-specific differences in molecular and cellular composition at the margins of glioblastoma. Proc Natl Acad Sci U S A. 2014;111:12550-12555.
-
Jain R, Poisson LM, Gutman D et al. Outcome prediction in patients with glioblastoma by using imaging, clinical, and genomic biomarkers: focus on the nonenhancing component of the tumor. Radiology. 2014;272:484-493.
-
Yordanova YN, Moritz-Gasser S, Duffau H. Awake surgery for WHO Grade II gliomas within “noneloquent” areas in the left dominant hemisphere: toward a “supratotal” resection. Journal of neurosurgery. 2011
-
Gil-Robles S, Duffau H. Surgical management of World Health Organization Grade II gliomas in eloquent areas: the necessity of preserving a margin around functional structures. Neurosurg Focus. 2010;28:E8.
-
Duffau H. Is supratotal resection of glioblastoma in noneloquent areas possible. World Neurosurg. 2014;82:e101-3.
-
Ius T, Angelini E, Thiebaut de Schotten M, Mandonnet E, Duffau H. Evidence for potentials and limitations of brain plasticity using an atlas of functional resectability of WHO grade II gliomas: towards a “minimal common brain”. Neuroimage. 2011;56:992-1000.
-
Duffau H, Taillandier L. New concepts in the management of diffuse low-grade glioma: Proposal of a multistage and individualized therapeutic approach. Neuro Oncol. 2015;17:332-342.
-
De Witt Hamer PC, Robles SG, Zwinderman AH, Duffau H, Berger MS. Impact of intraoperative stimulation brain mapping on glioma surgery outcome: a meta-analysis. J Clin Oncol. 2012;30:2559-2565.
-
Duffau H, Capelle L, Denvil D, et al. Usefulness of intraoperative electrical subcortical mapping during surgery for low-grade gliomas located within eloquent brain regions: functional results in a consecutive series of 103 patients. J Neurosurg 2003;98:764-78.
-
Duffau H, Peggy Gatignol ST, Mandonnet E, Capelle L, Taillandier L. Intraoperative subcortical stimulation mapping of language pathways in a consecutive series of 115 patients with Grade II glioma in the left dominant hemisphere. J Neurosurg 2008;109:
-
Keles GE, Lundin DA, Lamborn KR, Chang EF, Ojemann G, Berger MS. Intraoperative subcortical stimulation mapping for hemispherical perirolandic gliomas located within or adjacent to the descending motor pathways: evaluation of morbidity and assessment of functional outcome in 294 patients. J Neurosurg. 2004;100:369-375.
-
Raabe A, Beck J, Schucht P, Seidel K. Continuous dynamic mapping of the corticospinal tract during surgery of motor eloquent brain tumors: evaluation of a new method. J Neurosurg. 2014;120:1015-1024.
-
Chacko AG, Thomas SG, Babu KS et al. Awake craniotomy and electrophysiological mapping for eloquent area tumours. Clin Neurol Neurosurg. 2013;115:329-334.
-
Spena G, Garbossa D, Panciani PP, Griva F, Fontanella MM. Purely subcortical tumors in eloquent areas: awake surgery and cortical and subcortical electrical stimulation (CSES) ensure safe and effective surgery. Clin Neurol Neurosurg. 2013;115:1595-1601.
-
Stummer W, Pichlmeier U, Meinel T et al. Fluorescence-guided surgery with 5-aminolevulinic acid for resection of malignant glioma: a randomised controlled multicentre phase III trial. Lancet Oncol. 2006;7:392-401.
-
Stummer W, Stocker S, Wagner S et al. Intraoperative detection of malignant gliomas by 5-aminolevulinic acid-induced porphyrin fluorescence. Neurosurgery. 1998;42:518-25; discussion 525.
-
Pogue BW, Gibbs-Strauss S, Valdés PA, Samkoe K, Roberts DW, Paulsen KD. Review of Neurosurgical Fluorescence Imaging Methodologies. IEEE J Sel Top Quantum Electron. 2010;16:493-505.
-
Hebeda KM, Saarnak AE, Olivo M, Sterenborg HJ, Wolbers JG. 5-Aminolevulinic acid induced endogenous porphyrin fluorescence in 9L and C6 brain tumours and in the normal rat brain. Acta Neurochir (Wien). 1998;140:503-12; discussion 512.
-
Schucht P, Beck J, Abu-Isa J et al. Gross total resection rates in contemporary glioblastoma surgery: results of an institutional protocol combining 5-aminolevulinic acid intraoperative fluorescence imaging and brain mapping. Neurosurgery. 2012;71:927-35; discussion 935.
-
Louvel G, Metellus P, Noel G, et al. Delaying standard combined chemoradiotherapy after surgical resection does not impact survival in newly diagnosed glioblastoma patients. Radiother Oncol 2016;118:9-15.
-
Loureiro LV, Victor ES, Callegaro-Filho D et al. Minimizing the uncertainties regarding the effects of delaying radiotherapy for Glioblastoma: A systematic review and meta-analysis. Radiother Oncol. 2016;118:1-8.
-
Stupp R, Mason WP, van den Bent MJ et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med. 2005;352:987-996.
-
Stupp R, Hegi ME, Mason WP, et al. Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase III study: 5-year analysis of the EORTC-NCIC trial. Lancet Oncol 2009;10:459-66.
-
Chinot OL, Wick W, Mason W et al. Bevacizumab plus radiotherapy-temozolomide for newly diagnosed glioblastoma. N Engl J Med. 2014;370:709-722.
-
Schäfer N, Proescholdt M, Steinbach JP et al. Quality of life in the GLARIUS trial randomizing bevacizumab/irinotecan versus temozolomide in newly diagnosed, MGMT-nonmethylated glioblastoma. Neuro Oncol. 2018;20:975-985.
-
Blumenthal DT, Gorlia T, Gilbert MR et al. Is more better? The impact of extended adjuvant temozolomide in newly diagnosed glioblastoma: a secondary analysis of EORTC and NRG Oncology/RTOG. Neuro Oncol. 2017;19:1119-1126.
-
Gilbert MR, Wang M, Aldape KD et al. Dose-dense temozolomide for newly diagnosed glioblastoma: a randomized phase III clinical trial. J Clin Oncol. 2013;31:4085-4091.
-
Herrlinger U, Tzaridis T, Mack F et al. Lomustine-temozolomide combination therapy versus standard temozolomide therapy in patients with newly diagnosed glioblastoma with methylated MGMT promoter (CeTeG/NOA-09): a randomised, open-label, phase 3 trial. Lancet. 2019;393:678-688.
-
Wick W, Platten M, Meisner C et al. Temozolomide chemotherapy alone versus radiotherapy alone for malignant astrocytoma in the elderly: the NOA-08 randomised, phase 3 trial. Lancet Oncol. 2012;13:707-715.
-
Perry JR, Laperriere N, O’Callaghan CJ et al. Short-Course Radiation plus Temozolomide in Elderly Patients with Glioblastoma. N Engl J Med. 2017;376:1027-1037.
-
Weller M, Butowski N, Tran DD et al. Rindopepimut with temozolomide for patients with newly diagnosed, EGFRvIII-expressing glioblastoma (ACT IV): a randomised, double-blind, international phase 3 trial. Lancet Oncol. 2017;18:1373-1385.
-
Desjardins A, Gromeier M, Herndon JE et al. Recurrent Glioblastoma Treated with Recombinant Poliovirus. N Engl J Med. 2018;379:150-161.
-
Lang FF, Conrad C, Gomez-Manzano C et al. Phase I Study of DNX-2401 (Delta-24-RGD) Oncolytic Adenovirus: Replication and Immunotherapeutic Effects in Recurrent Malignant Glioma. J Clin Oncol. 2018;36:1419-1427.
-
Mitchell LA, Lopez Espinoza F, Mendoza D et al. Toca 511 gene transfer and treatment with the prodrug, 5-fluorocytosine, promotes durable antitumor immunity in a mouse glioma model. Neuro Oncol. 2017;19:930-939.
-
Reulen HJ, Poepperl G, Goetz C et al. Long-term outcome of patients with WHO Grade III and IV gliomas treated by fractionated intracavitary radioimmunotherapy. J Neurosurg. 2015;123:760-770.
-
Stupp R, Taillibert S, Kanner AA et al. Maintenance Therapy With Tumor-Treating Fields Plus Temozolomide vs Temozolomide Alone for Glioblastoma: A Randomized Clinical Trial. JAMA. 2015;314:2535-2543.
-
Weller M, Tabatabai G, Kästner B et al. MGMT Promoter Methylation Is a Strong Prognostic Biomarker for Benefit from Dose-Intensified Temozolomide Rechallenge in Progressive Glioblastoma: The DIRECTOR Trial. Clin Cancer Res. 2015;21:2057-2064.
-
Gately L, McLachlan SA, Philip J, Ruben J, Dowling A. Long-term survivors of glioblastoma: a closer look. J Neurooncol. 2018;136:155-162.
-
Krex D, Klink B, Hartmann C et al. Long-term survival with glioblastoma multiforme. Brain. 2007;130:2596-2606.
-
Reifenberger G, Weber RG, Riehmer V et al. Molecular characterization of long-term survivors of glioblastoma using genome- and transcriptome-wide profiling. Int J Cancer. 2014;135:1822-1831.
-
Archibald YM, Lunn D, Ruttan LA et al. Cognitive functioning in long-term survivors of high-grade glioma. J Neurosurg. 1994;80:247-253.
-
Steinbach JP, Blaicher HP, Herrlinger U et al. Surviving glioblastoma for more than 5 years: the patient’s perspective. Neurology. 2006;66:239-242.
-
Bähr O, Herrlinger U, Weller M, Steinbach JP. Very late relapses in glioblastoma long-term survivors. J Neurol. 2009;256:1756-1758.