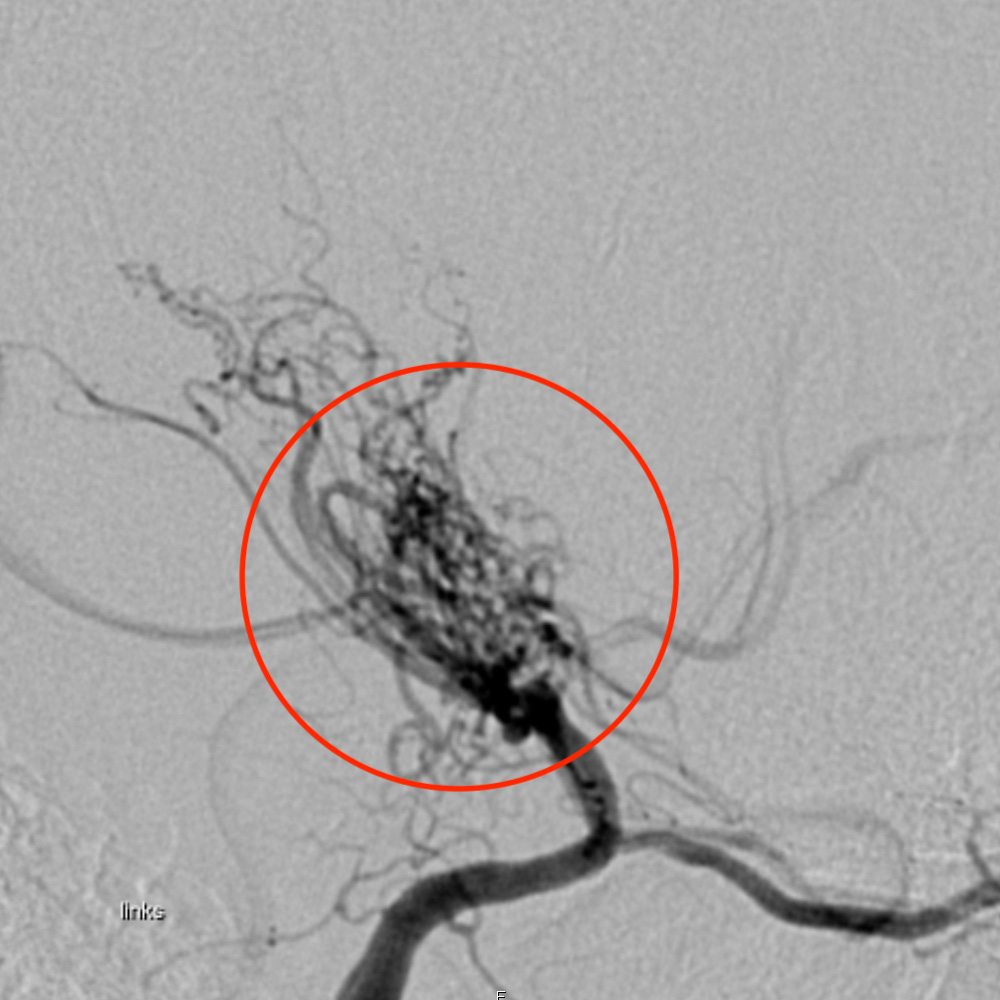
Die Moyamoya-Erkrankung ist eine seltene Krankheit der Hirngefässe, bei der es zu einer langsam fortschreitenden Verengung oder einem Verschluss der Halsschlagader und ihrer Hauptabgänge kommt. In der Folge bilden sich Umgehungskreisläufe aus kleinen Blutgefässen, die in der Angiografie wie eine Nebelwolke aussehen – daher auch der Name der Erkrankung, der sich von japanisch «moyamoya» für Nebel ableitet. Betroffene sind einem erheblichen Schlaganfallrisiko mit potenziellen neurologischen Defiziten ausgesetzt. Die neurochirurgische Behandlung stellt weiterhin die einzige effektive Therapie dar.
Hintergründe und Ursachen
Die Moyamoya-Erkrankung ist eine seltene, nicht-entzündliche und nicht-atherosklerotische Erkrankung der Hirngefässe. Ihre Ursache ist noch ungeklärt. Im Verlauf der Erkrankung verdicken sich zunehmend die Gefässinnenwände der beidseitigen Hirnarterien, hauptsächlich beim terminalen intrakraniellen Teil der Arteria carotis interna (ICA), der Arteria cerebri media (MCA) und der Arteria cerebri anterior (ACA). In der Folge kommt es zur Entwicklung von Kollateralgefässen, die einen Umgehungskreislauf bilden. * Diese kleinen, abnormen und netzartigen Kollateralgefässe sind verantwortlich für das charakteristische Erscheinungsbild der Erkrankung in der zerebralen digitalen Substraktionsangiografie (DSA). Das wolkenartige Aussehen dieser kompensatorischen Gefässe gibt der Krankheit ihren Namen (von japanisch «moyamoya» = neblig).
Am häufigsten tritt die Erkrankung beidseits auf, wobei der Schweregrad pro Seite unterschiedlich sein kann. Der Begriff Moyamoya-Erkrankung ist für diese manchmal familiär gehäuft auftretende Form bei Patienten mit beidseits betroffenen Gefässen reserviert. Bei Patienten mit einseitiger Ausprägung wird die Erkrankung Moyamoya-Syndrom genannt. Eine Erkrankung der Gegenseite kann jedoch auch beim Moyamoya-Syndrom in bis zu 40 % der Fälle auftreten. *
Wie häufig ist die Moyamoya-Erkrankung?
Die Ursache der Erkrankung ist zwar unbekannt, die hohe Inzidenz in Japan, wo eine familiäre Häufung bei etwa 10–15 % der Patienten auftritt, deutet jedoch stark auf eine genetische Ursache hin. * Die Erkrankung ist insgesamt sehr selten, betrifft am häufigsten Kinder, aber auch Erwachsene, typischerweise im Alter zwischen 30 und 50 Jahren. Die Krankheit zeigt zwei Altersgipfel und eine klare weibliche Dominanz, da Frauen fast doppelt so häufig betroffen sind wie Männer. *, *, * Der erste Altersgipfel liegt bei etwa fünf Jahren, ein weiterer Gipfel liegt in der vierten Lebensdekade. Die geschätzte Häufigkeit ausserhalb von Japan liegt bei ca. 1 zu 1 000 000 Personen. *
Verschiedene andere Krankheitsbilder sind mit dem Moyamoya-Syndrom assoziiert. Dazu gehören unter anderem *:
- Neurofibromatose Typ 1
- Tuberöse Sklerose
- Meningitis
- Systemischer Lupus Erythematodes
- Sichelzellanämie
- Fibromuskuläre Dysplasie
- Down-Syndrom
- Kongenitale Herzerkrankung
- Radiotherapie des Gehirns im Kindesalter
Warum kommt es zu Schlaganfällen?
Die Verengung der Arteria carotis interna führt zu einem niedrigeren Durchblutungsdruck im Gehirn, der durch die Bildung von Kollateralgefässen sowie eine reflektorische Gefässerweiterung zunächst kompensiert werden kann. Bei Fortschreiten der Erkrankung kommt es dann schliesslich zu einem Unterschreiten des kritischen Durchblutungsdrucks, ein Prozess, der durch die bereits ausgeschöpften Kompensationsmechanismen nicht mehr aufgefangen werden kann. Die unzureichende Blutzufuhr führt dann zu kurzen schlaganfallartigen Attacken, den sogenannten transienten ischämischen Attacken (TIAs). Diese TIAs verursachen vorübergehende neurologische Defizite, können aber auch zu ischämischen Hirninfarkten mit bleibenden Schäden führen. Durch eine Ruptur der Kollateralgefässe kann es ausserdem zu intrazerebralen Blutungen kommen.
Wie wird die Moyamoya-Erkrankung diagnostiziert?
Zur Diagnostik gehört der Nachweis von wiederkehrenden Schlaganfällen. Im Rahmen einer Magnetresonanztomografie (MRT oder MRI von engl. Magnetic Resonance Imaging) findet man die für Moyamoya typischen Gefässveränderungen: Verengungen der Arteria carotis interna und Kollateralgefässe. Diese Ergebnisse müssen dann zusätzlich per digitaler Substraktionsangiografie (DSA) bestätigt werden, bei der die Gefässe selektiv dargestellt werden können. Es muss unbedingt ausgeschlossen werden, dass die Schlaganfälle nicht auf andere Ursachen, die anders therapiert werden müssten. Ausserdem ist der Nachweis einer deutlich eingeschränkten Durchblutung des Gehirns aufgrund der Gefässverengungen wichtig. Dieser Nachweis kann über mehrere Methoden erbracht werden: Magnetresonanz-Perfusionsmessung, H2O-Positronen-Emissions-Tomografie (H2O-PET), SPECT-Untersuchung (SPECT steht für Single Photon Emission Computed Tomography). Bei der Positronen-Emissions-Tomografie (PET) handelt es sich um ein bildgebendes Diagnoseverfahren, das krankhafte Veränderungen effektiv darstellen kann. Ende 2020 wurde der weltweit schnellste PET-CT-Scanner in der Universitätsklinik für Nuklearmedizin des Inselspitals in Betrieb genommen. Dieser Scanner der allerneuesten Technologie ermöglicht eine exzellente Untersuchungsqualität bei kürzeren Untersuchungszeiten und reduzierter Strahlenbelastung für unsere Patienten.
Wie sieht die Therapie aus bei Moyamoya?
Das Fortschreiten der Krankheit kann sehr unterschiedlich verlaufen. Unabhängig davon, ob der Krankheitsprogress langsam oder schnell abläuft, schreitet die Erkrankung bei fast allen symptomatischen und auch bei asymptomatischen Patienten fort, wenn nur medikamentös therapiert wird. *, *, * Wissenschaftliche Publikationen zeigen, dass bis zu ⅔ der Patienten mit symptomatischer Moyamoya-Erkrankung ohne Operation innerhalb von 5 Jahren eine relevante Verschlechterung ihrer Symptome erleiden. *, *
Durch eine Operation wird dieses Risiko erheblich gesenkt. Bei etwa 96 % aller operierten Patienten treten bis 5 Jahre nach der Operation keine Schlaganfälle mehr auf. *, * Selbst bei Patienten, bei denen die Moyamoya-Erkrankung noch keine Beschwerden verursacht, liegt das jährliche Risiko für einen Schlaganfall (hämorrhagisch oder nicht-hämorrhagisch) bei 3,2 %. *
Operationsmethoden
Das Ziel der operativen Therapie ist die Vorbeugung von Schlaganfällen durch eine Verbesserung der Durchblutung (Revaskularisation). Es stehen zwei Methoden der Revaskularisation zur Verfügung: die direkte Revaskularisation und die indirekte Revaskularisation.
Beide Verfahren können auch kombiniert eingesetzt werden. In klinischen Studien zeigt sich grundsätzlich eine höhere Effektivität der Behandlung durch die direkte Revaskularisation. *, *, * Das Festlegen der Operationstechnik ist aber immer eine individuell an den Patienten, die Symptome und die Klinik angepasste Entscheidung.
Direkte Revaskularisation
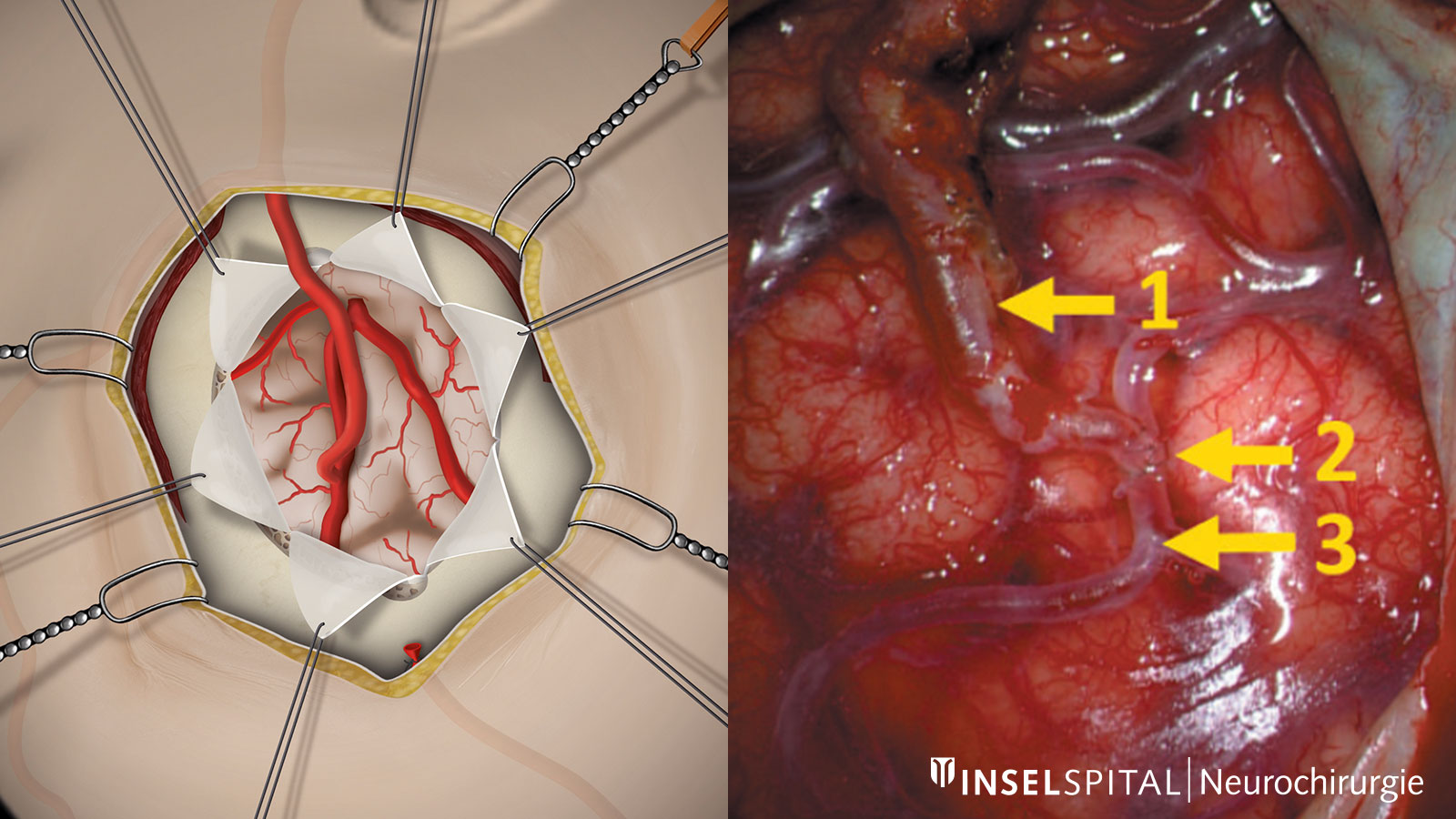
Bei der direkten Revaskularisation wird ein Umgehungskreislauf durch die direkte Verbindung einer extrakraniellen Arterie mit einer Arterie der Gehirnoberfläche geschaffen. Durch diese sogenannte Anastomose kann die Verengung der erkrankten Arteria carotis interna umgangen und ein zusätzlicher Blutfluss zum Gehirn hergestellt werden. Die am häufigsten durchgeführte Operation dieser Art ist der STA-MCA-Bypass (superficial temporal artery to middle cerebral artery bypass). Hierbei wird die Schläfenarterie (STA), welche die Kopfhaut versorgt und sich an der Seite der Schläfe häufig auch tasten lässt, über eine Schädeleröffnung nach innen verpflanzt und mit einem Ast der auf der Gehirnoberfläche verlaufenden Arteria cerebri media (MCA) verbunden. Die Gefässe sind ca. 1–2 mm dick und werden unter dem Mikroskop mit einem sehr dünnen Faden vernäht.
Indirekte Revaskularisation
Bei der indirekten Revaskularisation wird von der Arteria carotis externa versorgtes Gewebe auf die Gehirnoberfläche aufgelegt, ohne dass eine direkte Gefässverbindung genäht wird. Im Laufe der Zeit verbinden sich die Arterien aus dem Gewebe mit den Gefässen der Gehirnoberfläche und können so ebenfalls einen suffizienten Umgehungskreislauf bilden (Neoangiogenese). Zu den Geweben, die hierfür genutzt werden können, zählen vor allem die harte Hirnhaut (Encephalodurosynangiose) und der Temporalismuskel (Encephalomyosynangiose). Die unterschiedlichen Varianten der indirekten Revaskularisation kommen häufig in Kombination miteinander zur Verwendung oder auch zusätzlich zu direkten Bypässen. Generell wird die indirekte Revaskularisation vor allem bei Kindern bis zur Pubertät eingesetzt, da eine ausreichende Neoangiogenese wahrscheinlicher ist als bei Erwachsenen. *
Innovative Operationstechniken am Inselspital
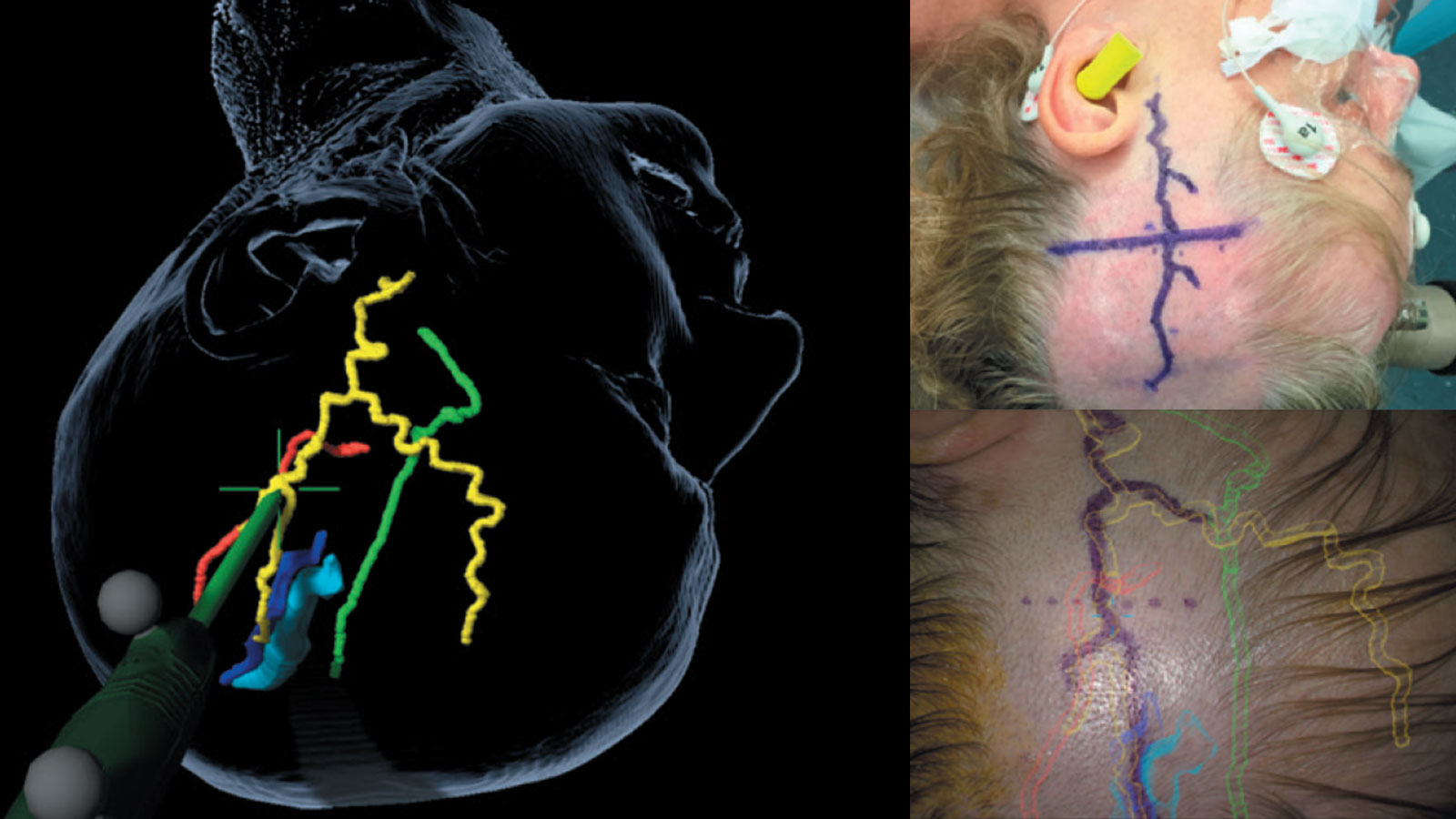
Am Inselspital kommen modernste Operationstechniken zum Einsatz:
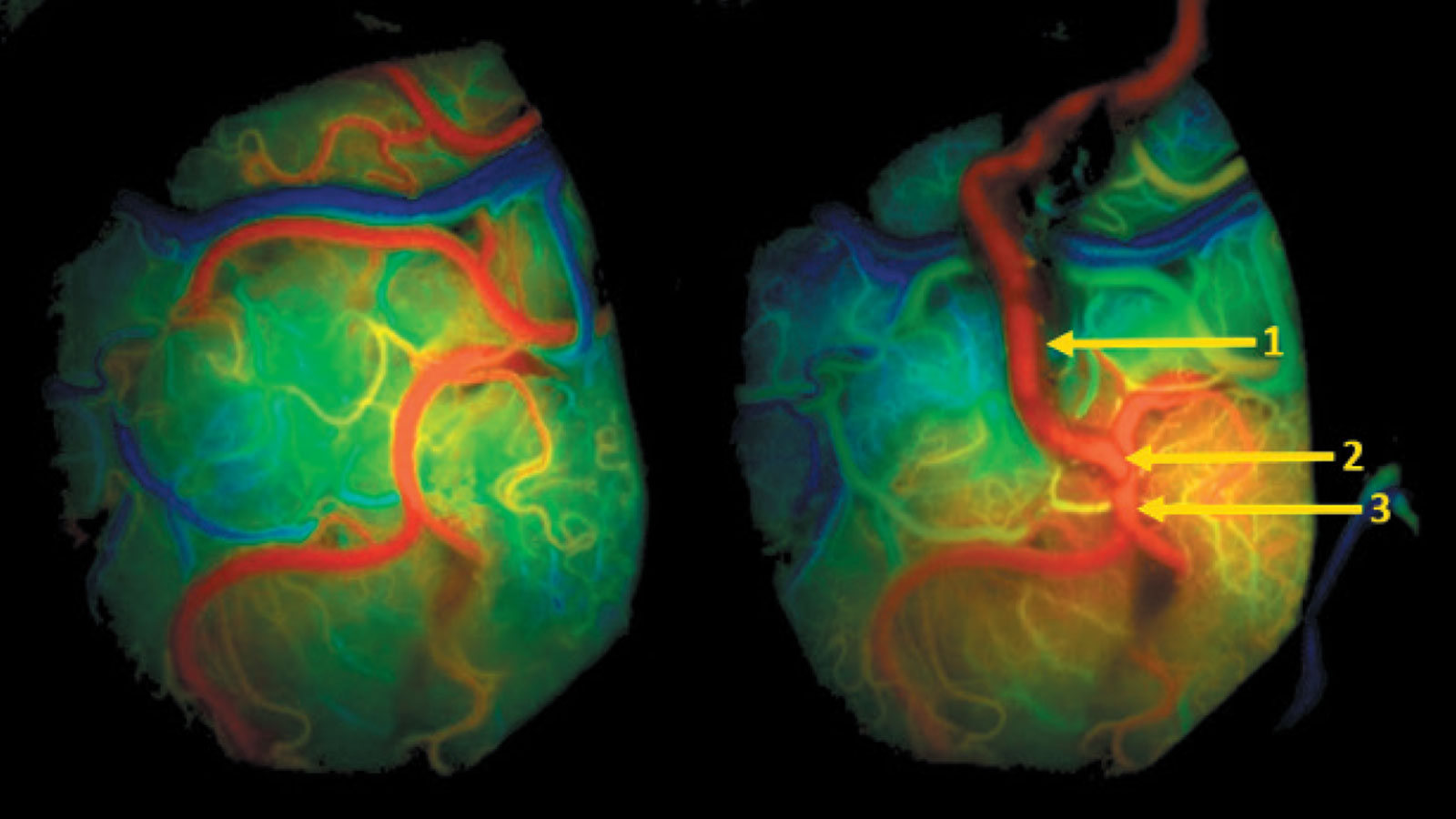
Mit Hilfe der vaskulären Navigation und Augmented Reality können während der Operation die Genauigkeit gesteigert und das Aufsuchen des Spendergefässes erleichtert werden. Sobald die Gefässanastomose abgeschlossen ist, kann die Durchgängigkeit der Gefässe noch während der Operation mit Hilfe einer Indocyaningrün-Infrarot-Angiografie (kurz ICG-Infrarot-Angiografie) in einer zusätzlichen Flussanalyse überprüft werden.
Referenzen
-
Imaizumi T, Hayashi K, Saito K, Osawa M, Fukuyama Y. Long-Term Outcomes of Pediatric Moyamoya Disease Monitored to Adulthood. Pediatric Neurology. 1998;18(4):321-325.
-
Suzuki J. Cerebrovascular "Moyamoya" Disease. Archives of Neurology. 1969;20(3):288.
-
Kuroda S, Ishikawa T, Houkin K, Nanba R, Hokari M, Iwasaki Y. Incidence and Clinical Features of Disease Progression in Adult Moyamoya Disease. Stroke. 2005;36(10):2148-2153.
-
Choi J, Seok Kim D, Kim E, Lee K. Natural history of Moyamoya disease: comparison of activity of daily living in surgery and non surgery groups. Clinical Neurology and Neurosurgery. 1997;99:S11-S18.
-
Kurokawa T, Chen Y, Tomita S, Kishikawa T, Kitamura K. Cerebrovascular Occlusive Disease with and without the Moyamoya Vascular Network in Children. Neuropediatrics. 1985;16(01):29-32.
-
Scott R, Smith J, Robertson R, Madsen J, Soriano S, Rockoff M. Long-term outcome in children with moyamoya syndrome after cranial revascularization by pial synangiosis. Journal of Neurosurgery: Pediatrics. 2004;100(2):142-149.
-
Kuroda S, Hashimoto N, Yoshimoto T, Iwasaki Y. Radiological Findings, Clinical Course, and Outcome in Asymptomatic Moyamoya Disease. Stroke. 2007;38(5):1430-1435.
-
Suzuki J, Kodama N. Moyamoya disease--a review. Stroke. 1983;14(1):104-109.
-
Scott, R. and Smith, E., 2009. Moyamoya Disease and Moyamoya Syndrome. New England Journal of Medicine, 360(12), pp.1226-1237.
-
Kamada F, Aoki Y, Narisawa A, Abe Y, Komatsuzaki S, Kikuchi A et al. A genome-wide association study identifies RNF213 as the first Moyamoya disease gene. Journal of Human Genetics. 2010;56(1):34-40.
-
Baba T, Houkin K, Kuroda S. Novel epidemiological features of moyamoya disease. Journal of Neurology, Neurosurgery & Psychiatry. 2008;79(8):900-904.
-
Wakai K, Tamakoshi A, Ikezaki K, Fukui M, Kawamura T, Aoki R et al. Epidemiological features of Moyamoya disease in Japan: findings from a nationwide survey. Clinical Neurology and Neurosurgery. 1997;99:S1-S5.
-
Uchino, K., Johnston, S., Becker, K. and Tirschwell, D., 2005. Moyamoya disease in Washington State and California. Neurology, 65(6), pp.956-958.
-
Roach ES, Golomb MR, Adams R, et al. Management of stroke in infants and children: a scientific statement from a Special Writing Group of the American Heart Association Stroke Council and the Council on Cardiovascular Disease in the Young. Stroke; a journal of cerebral circulation 2008;39:2644-91.
-
Deng X, Gao F, Zhang D, Zhang Y, Wang R, Wang S et al. Direct versus indirect bypasses for adult ischemic-type moyamoya disease: a propensity score–matched analysis. Journal of Neurosurgery. 2018;128(6):1785-1791.
-
Komotar R, Starke R, Otten M, Merkow M, Garrett M, Marshall R et al. The role of indirect extracranial-intracranial bypass in the treatment of symptomatic intracranial atheroocclusive disease. Journal of Neurosurgery. 2009;110(5):896-904.
-
Mizoi K, Kayama T, Yoshimoto T, Nagamine Y. Indirect revascularization for moyamoya disease: Is there a beneficial effect for adult patients?. Surgical Neurology. 1996;45(6):541-548.
-
Rychen J, Goldberg J, Raabe A, Bervini D. Augmented Reality in Superficial Temporal Artery to Middle Cerebral Artery Bypass Surgery: Technical Note. Operative Neurosurgery. 2019;.
-
Raabe A, Nakaji P, Beck J, Kim L, Hsu F, Kamerman J et al. Prospective evaluation of surgical microscope—integrated intraoperative near-infrared indocyanine green videoangiography during aneurysm surgery. Journal of Neurosurgery. 2005;103(6):982-989.
-
Abla A, Gandhoke G, Clark J, Oppenlander M, Velat G, Zabramski J et al. Surgical Outcomes for Moyamoya Angiopathy at Barrow Neurological Institute With Comparison of Adult Indirect Encephaloduroarteriosynangiosis Bypass, Adult Direct Superficial Temporal Artery–to–Middle Cerebral Artery Bypass, and Pediatric Bypass. Neurosurgery. 2013;73(3):430-439.
-
Finkenstaedt S, Krejci V, Raabe A, Bervini D. Moyamoya-Erkrankung: Es braucht hoch-spezialisierte Zusammenarbeit. Anästhesie Journal 4/2019