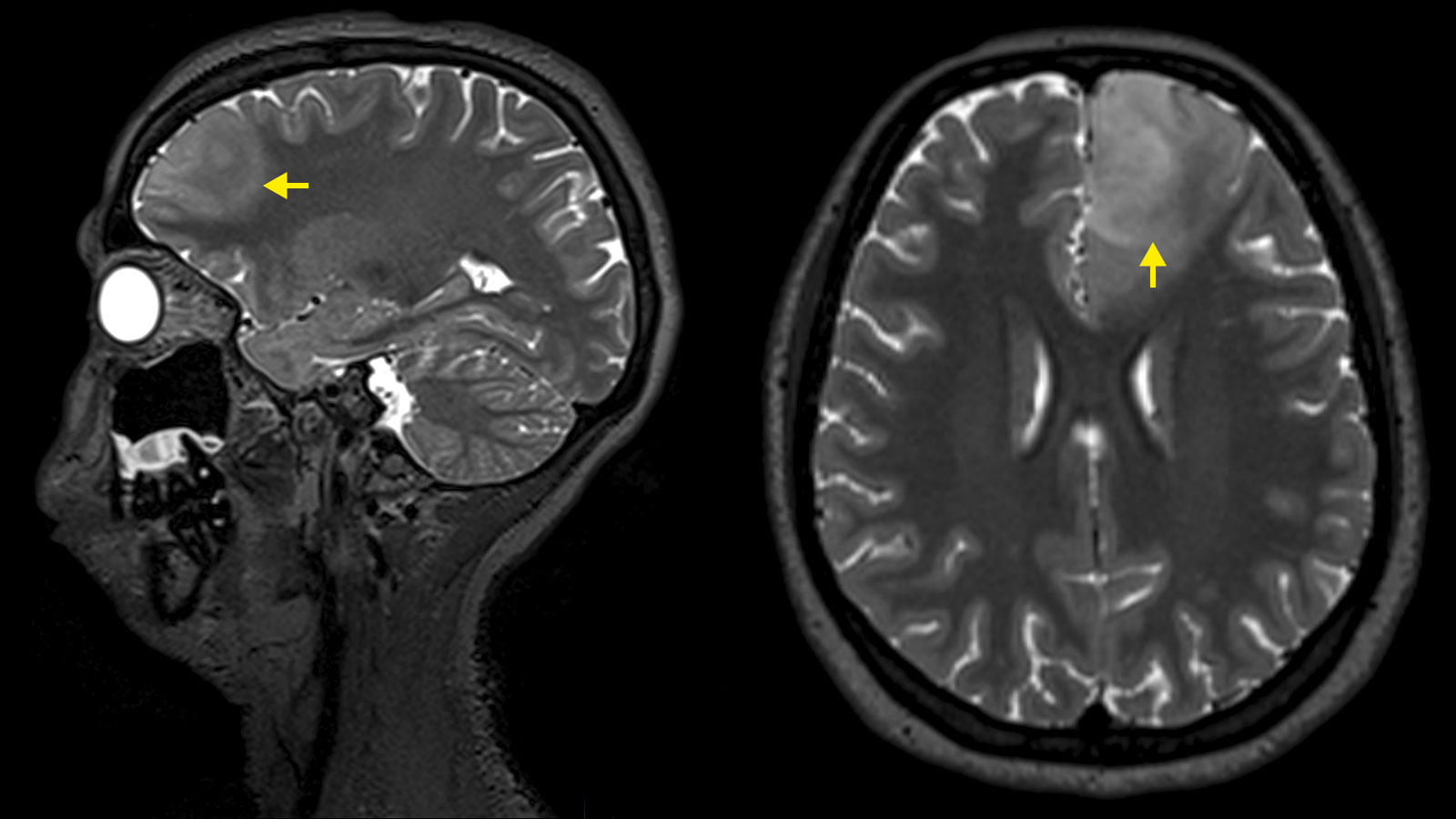
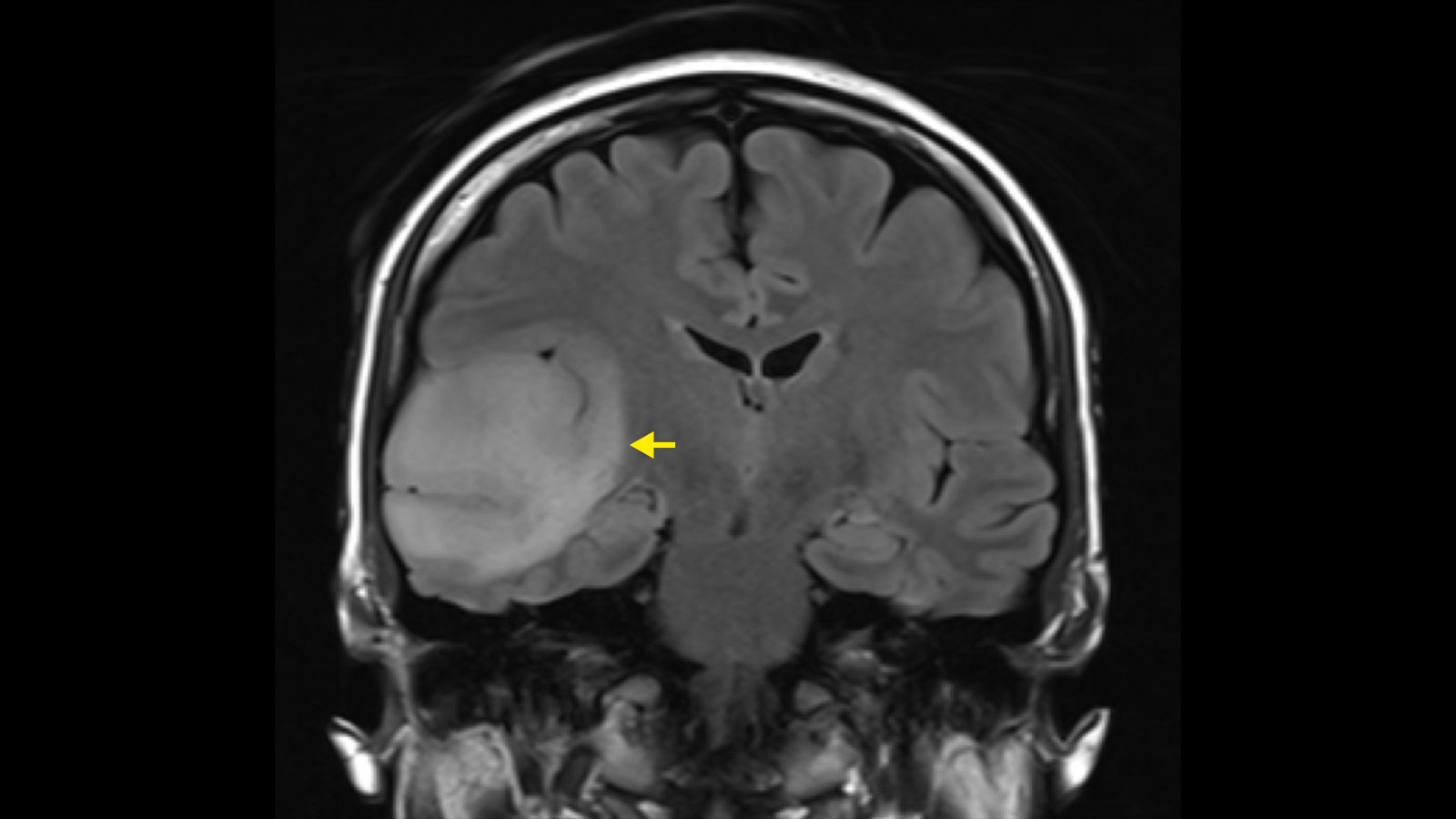
Les astrocytomes et les oligodendrogliomes sont des tumeurs cérébrales de bas grade appartenant au groupe des gliomes. Leur croissance est plutôt lente - pendant des années, voire des décennies. Il existe toutefois un risque qu'un gliome de bas grade se transforme en tumeur maligne et continue ensuite à se développer de manière agressive. Cette transformation dite maligne dépend du type de tissu de la tumeur, de ses caractéristiques moléculaires et de sa taille. Le traitement standard des astrocytomes et des oligodendrogliomes est la chirurgie, complétée si nécessaire par une chimiothérapie et une radiothérapie.
Neurochirurgie Inselspital - nos chiffres et faits
- Excellence : des neurochirurgiens hautement spécialisés et des infirmières en oncologie spécialement formées (Advanced Practice Nurses ou APN en abrégé)
- Expertise : 417 opérations de tumeurs (biopsies et résections) en 2024, dont 359 gliomes.
- Équipe interdisciplinaire : notre tumor board hebdomadaire réunit des spécialistes de 7 disciplines - neurochirurgie, neurologie, neuroradiologie, oncologie, médecine nucléaire, radio-oncologie, pathologie.
- Développé et étudié à l'Inselspital : techniques de neuromonitoring et de navigation innovantes pour la sécurité des opérations et la prévention des déficits.
- Taux de déficits parmi les plus bas au monde : le taux documenté et publié de 3 à 5 % de déficits permanents liés à l'opération pour les tumeurs à risque d'éloquence motrice est l'un des plus bas au monde !
- Taux de résection parmi les plus élevés au monde : le taux de résection complète > 90 % pour les gliomes est l'un des plus élevés au monde !
- Équipement technologique de pointe avec imagerie peropératoire, techniques de fluorescence, thermothérapie au laser et plus encore.
- Concept de traitement complémentaire : notre protocole OPTIMISST (OPTIMISST signifie Optimized Standard and Supportive Therapy).
- Certification : centre certifié pour les tumeurs cérébrales depuis 2016, garant d'une norme de qualité élevée dans le traitement oncologique.
Classification
Les astrocytomes et les oligodendrogliomes comptent parmi les gliomes de bas grade les plus fréquents et présentent typiquement une mutation IDH.
Le terme «bas grade» correspond en fait à un grade 2 selon la classification des tumeurs du système nerveux central de l'OMS. Cependant, les médecins ne peuvent pas attribuer avec certitude un gliome à un grade 2 ou à un grade 3, que ce soit sur la base de l'image IRM ou de la classification des tissus. C'est pourquoi il est également impossible de prédire de manière fiable la tendance à la croissance, à la récidive et à la dégénérescence d'une telle tumeur. Aujourd'hui, on parle de gliomes de bas grade pour les différencier des glioblastomes agressifs (grade 4) ou tumeurs IDH de type sauvage.
De nos jours, nous connaissons de nombreuses mutations de l'ADN des cellules tumorales qui sont typiques des gliomes de bas grade et qui nous donnent des indications importantes sur le comportement de la tumeur. Ces mutations servent de marqueurs génétiques.
- Marqueurs génétiques
-
Comme mentionné, l'une des caractéristiques des gliomes typiques de bas grade est la présence d'une mutation IDH.
Des mutations génétiques supplémentaires divisent ensuite ces tumeurs en astrocytomes et oligodendrogliomes.
On parle d'oligodendrogliome en présence d'une modification spécifique de deux chromosomes, à savoir une perte du bras court du chromosome 1 et du bras long du chromosome 19. Il s'agit d'une translocation non équilibrée (loss of heterozygosity ou codélétion1p/19q).
Cette codélétion 1p/19q n'existe pas dans les astrocytomes, mais on y trouve typiquement une mutation dans le gène ATRX.
- Le gène p53
-
Un autre rôle important est joué par le gène p53, dont le produit agit comme un suppresseur de tumeur et représente donc une instance de contrôle importante dans la régulation de la croissance cellulaire. Des mutations dans p53 sont détectées dans un grand nombre de gliomes de bas grade, en particulier lorsqu'une transformation en gliome de haut grade a lieu.
Dès le début de la phase de développement d'un gliome de bas grade, on observe une modification du gène MDM2, qui agit comme régulateur de p53 et agit donc sur le même «levier» génétique.
Quelle est la fréquence des gliomes de bas grade et qui est concerné?
En général, il s'agit de tumeurs rares avec un taux annuel de nouveaux diagnostics de 1 pour 100 000 habitants *.
Les astrocytomes et les oligodendrogliomes apparaissent typiquement chez de jeunes adultes dont l'âge moyen est de 35 à 45 ans * * *.
Quelle est la cause des gliomes de bas grade?
La cause exacte de l'apparition des astrocytomes et des oligodendrogliomes n'est pas claire.
Le seul facteur de risque clair connu pour le développement d'un gliome de bas grade est une irradiation antérieure de la tête.
Les facteurs héréditaires ne jouent qu'un rôle secondaire. Toutefois, ces tumeurs sont plus fréquentes chez les patients atteints de neurofibromatose de type 1 ou du syndrome de Li-Fraumeni, deux maladies héréditaires rares.
Quels sont les symptômes typiques?
Les gliomes de bas grade se développent lentement et perturbent peu les fonctions normales de la zone cérébrale affectée. Cette croissance lente permet au cerveau de s'adapter et même de déplacer des fonctions importantes de la zone tumorale vers d'autres zones saines du cerveau. Cette adaptation fonctionnelle est appelée plasticité. Les astrocytomes et les oligodendrogliomes peuvent donc atteindre une taille considérable pendant des années sans provoquer de symptômes. Il n'est pas rare que ces tumeurs soient découvertes tout à fait par hasard à l'IRM, après que l'imagerie a été demandée pour une autre raison.
Dans 80 % des cas, une crise d'épilepsie est le premier symptôme.
D'autres troubles non spécifiques comme des maux de tête, une modification du caractère, de la fatigue, des vertiges, une démarche incertaine, des nausées et des vomissements sont possibles, mais n'apparaissent généralement que lorsque la tumeur a atteint un volume important. Entre les crises d'épilepsie, la plupart des patients ne présentent aucun symptôme.
Comment les gliomes de bas grade sont-ils diagnostiqués?
Imagerie par résonance magnétique
Le diagnostic se fait en premier lieu à l'aide de l'imagerie par résonance magnétique (IRM). Sur l'image IRM, les astrocytomes et les oligodendrogliomes apparaissent comme des zones claires dans les séquences IRM pondérées en T2. Bien que les astrocytomes et les oligodendrogliomes puissent être clairement délimités à l'IRM, on trouve des nids de cellules tumorales jusqu'à au moins 2 cm autour de la tumeur visible et certaines cellules tumorales au-delà * *. C'est pourquoi les astrocytomes et les oligodendrogliomes sont des tumeurs cérébrales infiltrantes * *.
Neuroimagerie
Une différenciation supplémentaire par imagerie peut être réalisée au moyen de la «neuroimagerie avancée». Il s'agit notamment de méthodes permettant de mesurer le flux sanguin local (perfusion) ainsi que les produits métaboliques locaux (métabolites) par spectroscopie par résonance magnétique (spectroscopie RM ou SRM).
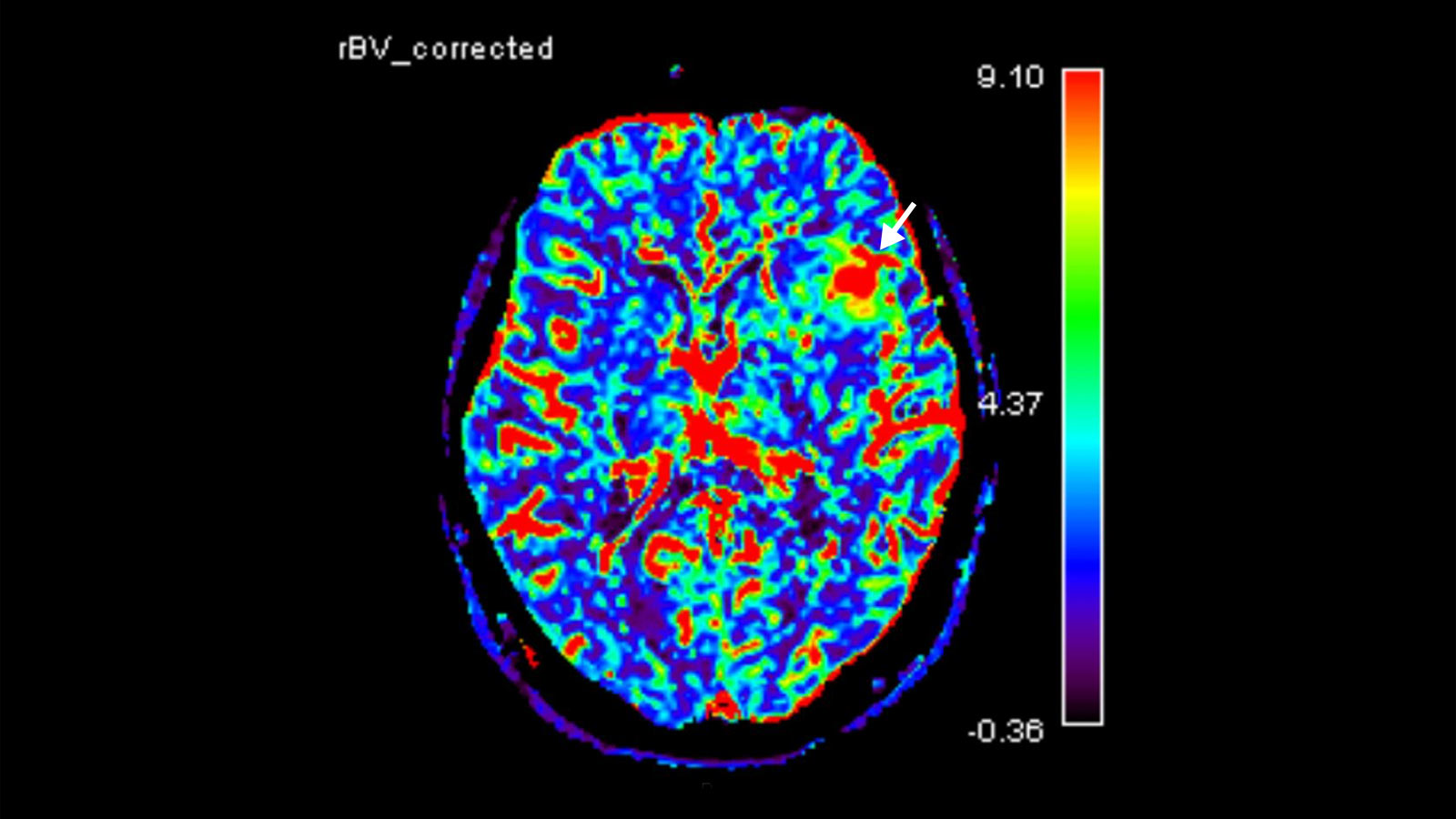
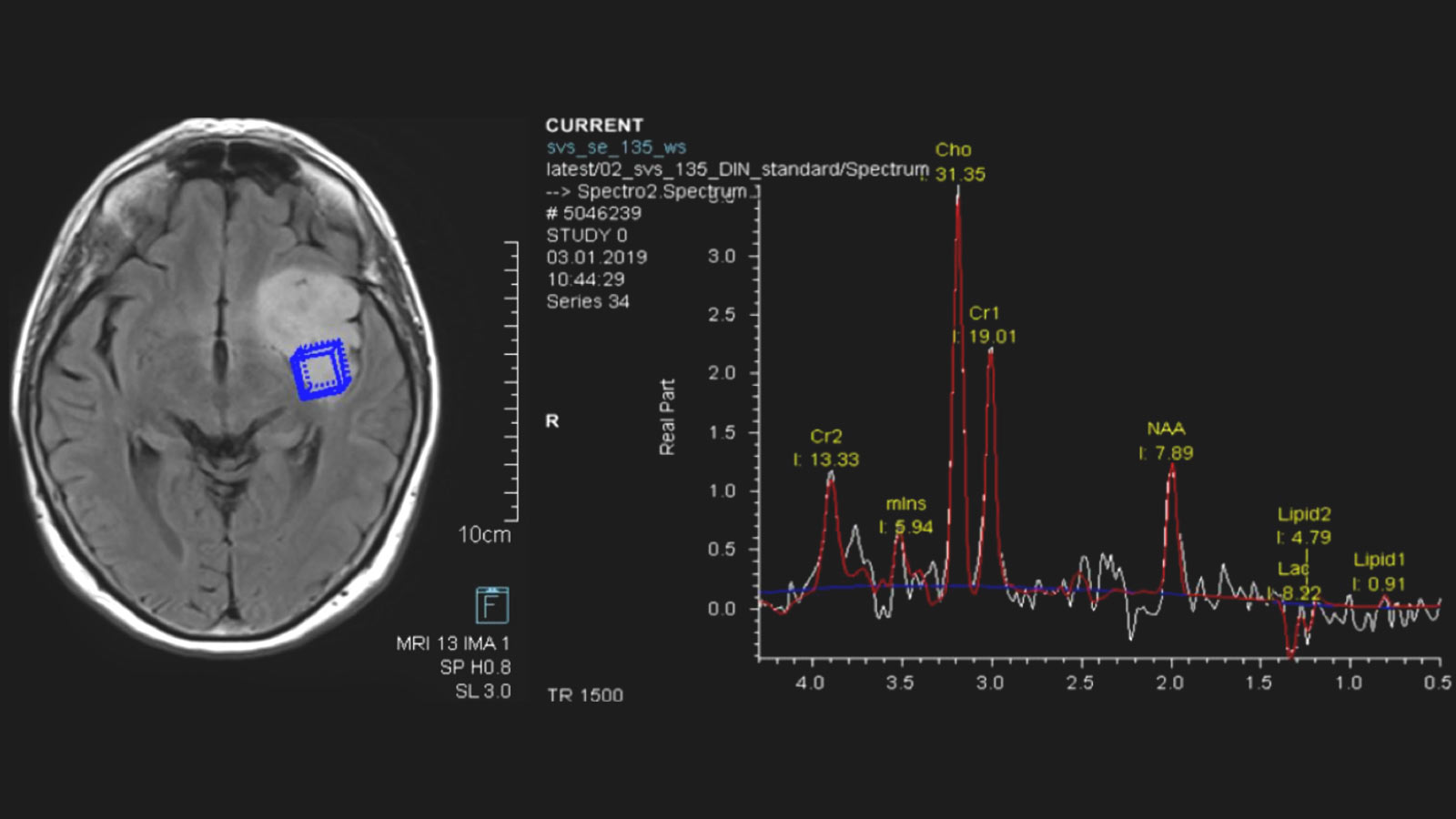
Biopsie et analyse tissulaire
Le diagnostic de suspicion après un examen IRM doit toutefois être confirmé par une analyse des tissus au moyen d'une biopsie ou après l'ablation de la tumeur.
Comment les gliomes de bas grade sont-ils traités?
Transformation maligne
Comme les gliomes de bas grade ont une croissance très lente, il ne faut pas s'attendre à une transformation importante de la tumeur en l'espace de quelques mois. C'est la raison pour laquelle l'opération était autrefois souvent retardée. Comme on le sait aujourd'hui, cette longue attente implique toutefois un risque plus élevé de transformation maligne, c'est-à-dire de dégénérescence d'un astrocytome ou d'un oligodendrogliome en une tumeur maligne.
Bien qu'ils soient parfois désignés comme tels, les gliomes de bas grade ne sont pas vraiment des tumeurs bénignes. Leur croissance est certes lente, mais constante, avec une moyenne de 0,5 à 4 mm/an * *. Les guérisons spontanées sans traitement ne se produisent pas.
La transformation maligne détermine le pronostic et l'espérance de vie chez la plupart des patients. Il n'est malheureusement pas possible de prédire le moment où elle se produira. Dans la littérature scientifique, le risque est estimé à 3-10 % par an, en fonction de l'histologie, des caractéristiques moléculaires et de la taille de la tumeur. Ainsi, le risque augmente d'environ 10 % par cm de taille de la tumeur.
Mais on sait aussi aujourd'hui qu'une ablation complète de la tumeur visible à l'IRM peut réduire considérablement le risque de dégénérescence maligne.
Quels sont les facteurs qui déterminent le succès à long terme du traitement des astrocytomes et des oligodendrogliomes?
Facteurs déterminants
- Délai avant l'opération
Plus le temps d'attente en années est long, plus le taux de dégénérescence est élevé. - Ampleur de la exérèse de la tumeur
L'objectif standard est la réduction de la tumeur. Hors, l'objectif optimal est l'exérèse complète avec marge supplémentaire (exérèse supramarginale) selon les critères de l'imagerie par résonance magnétique (IRM). L'opération est réalisée par mapping fonctionnel, c'est-à-dire sous contrôle neurophysiologique. On y décrit la plus longue période sans tumeur, la plus longue durée de survie, le plus faible taux de dégénérescence maligne et la seule possibilité de suppression à long terme de la tumeur. - Traitement
Mise en œuvre d'une chimiothérapie pour les restes de tumeurs ou les tumeurs inopérables, si nécessaire en association avec une radiothérapie.
Facteurs non influençables
- âge du patient
- taille initiale du gliome
- déficits neurologiques préexistants causés par le gliome
- profil génétique moléculaire du gliome
- type de tissu
- localisations multiples de la tumeur
Notre protocole OPTIMISST
Il existe un certain nombre de facteurs qui contribuent à la réussite du traitement d'une tumeur. Sur la base de ces facteurs, nous avons développé notre propre concept de traitement, appelé protocole OPTIMISST. OPTIMISST signifie «Optimized Standard and Supportive Therapy» et complète le traitement classique des tumeurs cérébrales. Ce protocole n'existe sous cette forme que dans notre clinique.
Es gibt eine Reihe von Faktoren, die dazu beitragen, dass eine Tumorbehandlung erfolgreicher ist. Wir haben auf Grundlage dieser Faktoren ein eigenes Behandlungskonzept entwickelt, das sogenannte OPTIMISST-Protokoll. OPTIMISST steht dabei für «Optimized Standard and Supportive Therapy» und ergänzt die klassische Therapie bei Hirntumoren. Dieses Protokoll gibt es in dieser Form nur an unserer Klinik.
La chirurgie - le traitement standard
Le traitement standard des astrocytomes et des oligodendrogliomes est l'ablation ou la résection chirurgicale. * * * * * *.
Il existe trois niveaux de radicalité pour la chirurgie :
- Une réduction de la masse tumorale (chirurgie cytoréductive).
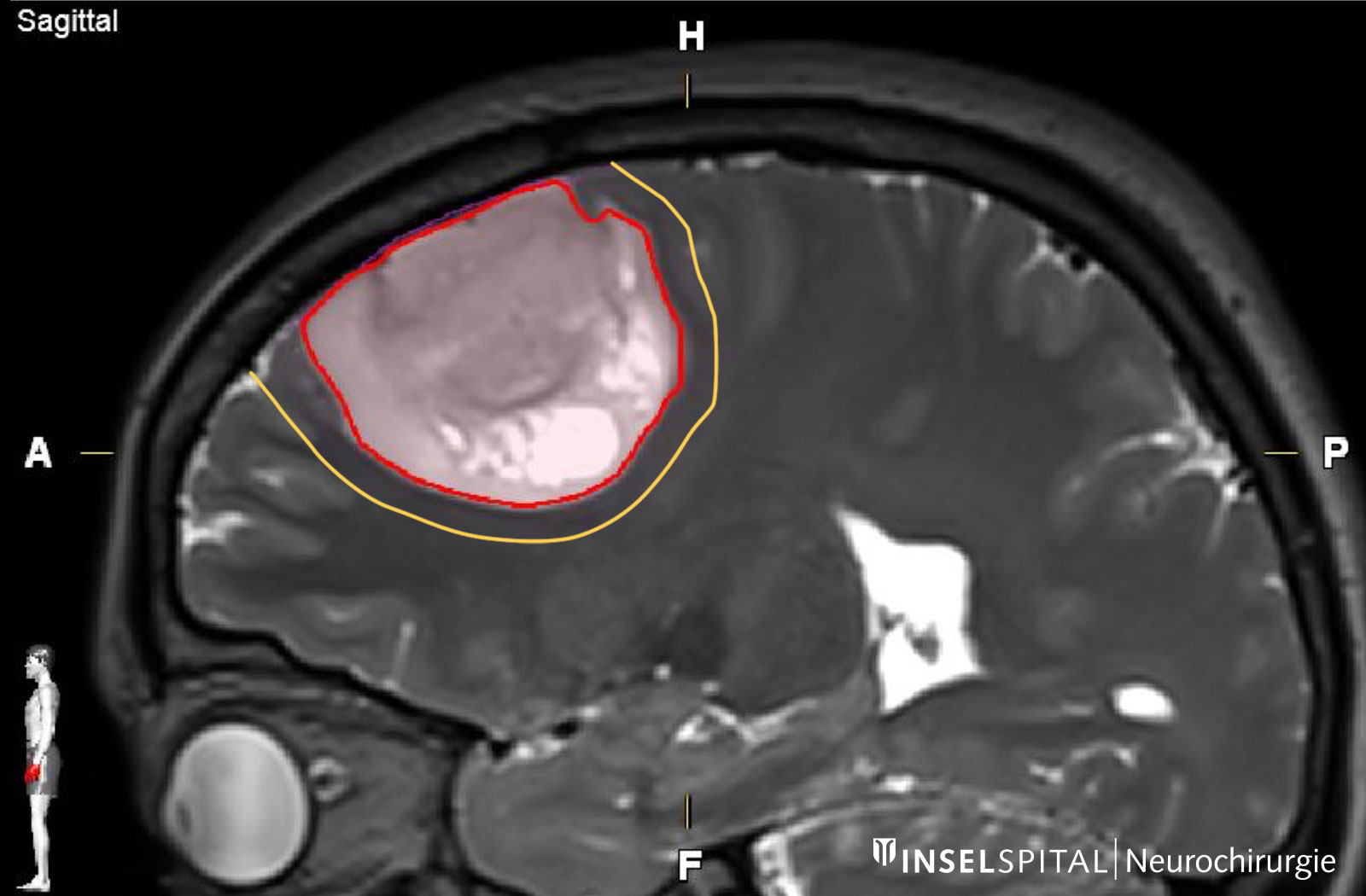
- Une exérèse complète de la tumeur visible sur l'image IRM
- L'exérèse chirurgicale complète de la tumeur visible sur l'image IRM avec une zone de sécurité (résection supramarginale)
Plus la tumeur est enlevée lors de l'opération, plus l'évolution de la maladie est favorable : La maladie progresse plus lentement, le moment de la dégénérescence maligne est retardé et le temps de survie est prolongé. * * * * * * * * * * * * * *.
L'objectif de la résection est donc d'enlever radicalement la tumeur jusqu'à la limite du tissu cérébral fonctionnel. Comme il est souvent difficile de faire la distinction entre la tumeur et le tissu cérébral, en particulier dans la zone périphérique, on utilise ici différentes technologies modernes.
Chirurgie avec marge supplémentaire: la résection supramarginale ou supratotale
Les astrocytomes et les oligodendrogliomes ont des cellules tumorales qui s'étendent au-delà de la marge visible à l'IRM. La résection supramarginale implique l'exérèse d'une marge de sécurité supplémentaire de 1 à 2 cm, ce qui a un impact positif sur la probabilité de récidive * * *.
Pendant l'opération, la tumeur est retirée avec cette marge de sécurité, à condition que le neuromonitoring ne détecte pas de zones importantes à cet endroit. Cette technique doit toujours être réalisée en même temps que le monitoring et la mapping neurophysiologiques afin d'éviter des dommages neurologiques permanents.
Sécurité des opérations
- développés à l'Inselspital: mapping dynamique continu et Low-Threshold-Mapping
- Inselspital leader dans le domaine de la sécurité des opérations grâce aux méthodes de cartographie les plus modernes
- moins de paralysie par rapport aux méthodes précédentes
- possibilité d'enlever des tumeurs de manière plus radicale, même à proximité immédiate des centres moteurs et des voies de force
Imagerie par résonance magnétique
Pour une préparation optimale, on procède d'abord à une IRM spéciale. Cela permet d'évaluer la tumeur le plus précisément possible et de planifier l'opération avec précision. Selon la localisation de la tumeur, d'autres examens peuvent être nécessaires.
Une IRM fonctionnelle (IRMf) peut apporter de précieuses informations sur la localisation de la fonction vocale et des centres moteurs.
Stimulation magnétique transcrânienne naviguée
Pour localiser précisément les centres moteurs, on procède souvent à une stimulation magnétique transcrânienne naviguée (nTMS). Il s'agit d'un examen non invasif qui est toléré sans problème par la plupart des patients et qui est proposé à l'Inselspital dans le cadre d'une étude multicentrique. Les données ainsi recueillies aident le chirurgien à planifier l'accès chirurgical et à définir la stratégie opératoire.
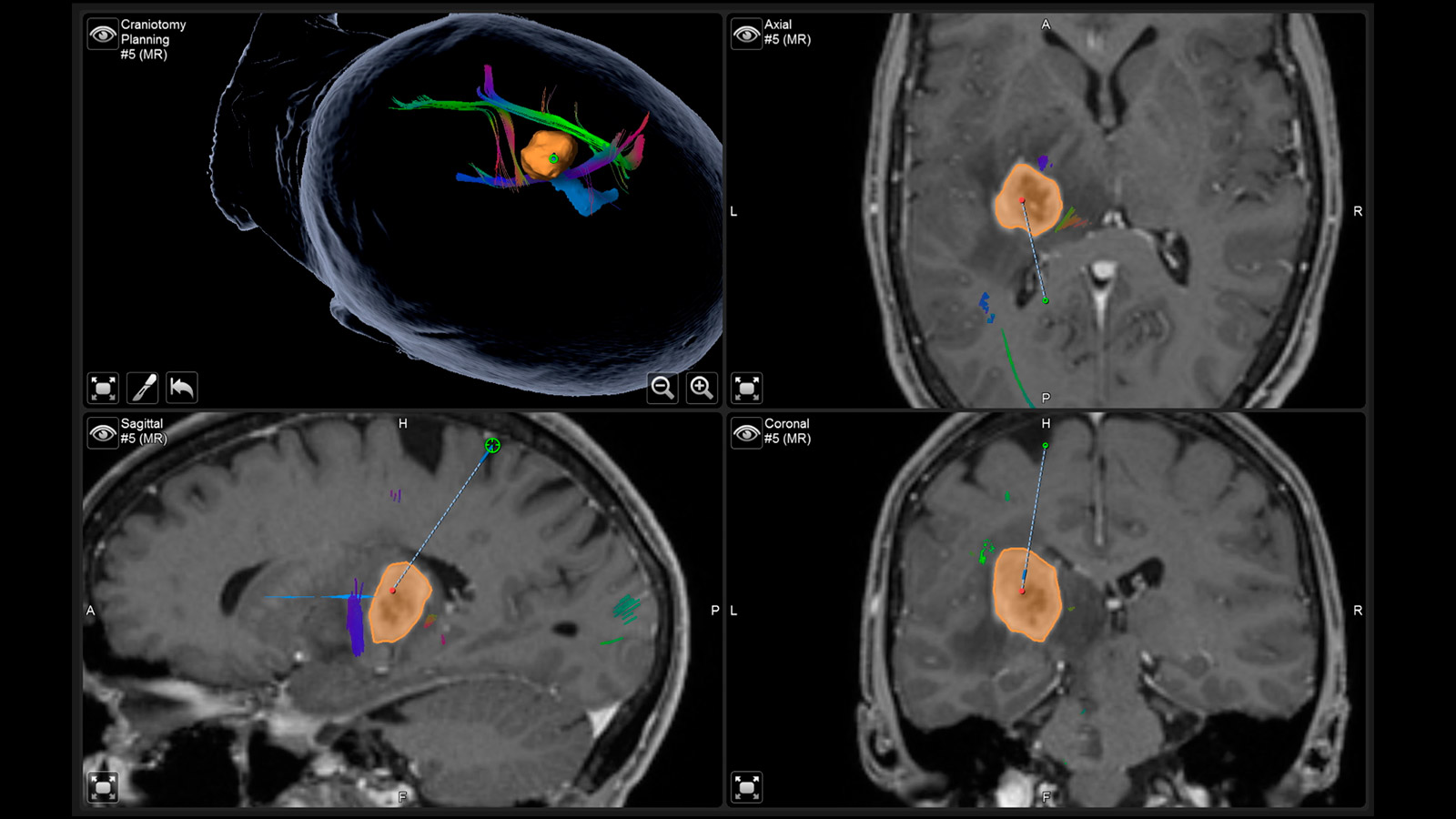
Fiber tracking: représentation des voies des fibres cérébrales
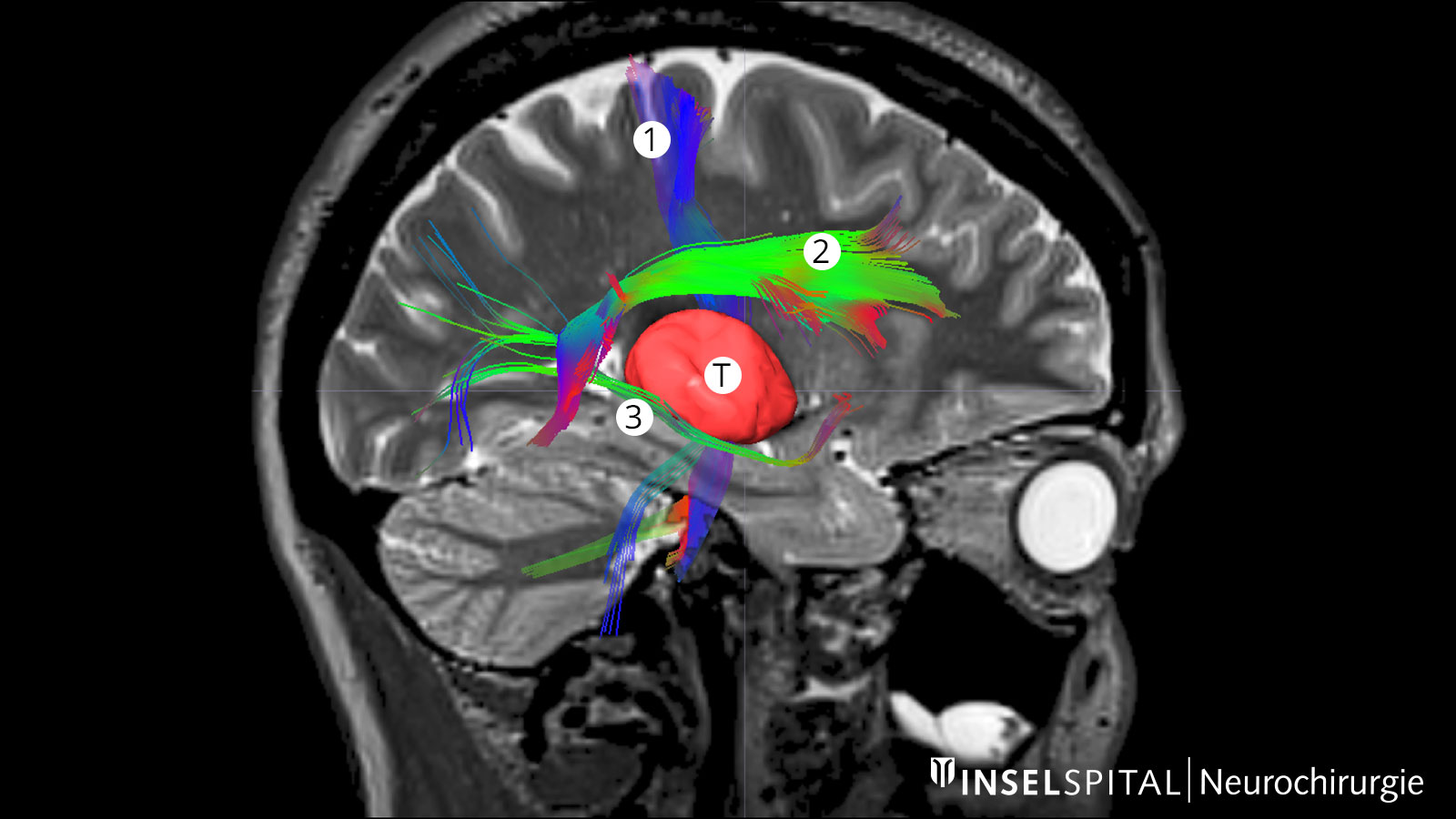
Les termes tractographie ou fiber tracking désignent des procédés permettant de visualiser les voies fibreuses dans le cerveau. La représentation de ces voies avant l'opération aide le chirurgien à trouver le chemin optimal et le plus sûr vers la tumeur en passant par toutes les voies fibreuses importantes.
Ceci est extrêmement important pour la voie pyramidale. Elle représente la liaison directe entre le centre moteur du cerveau et la moelle épinière et doit absolument être préservée lors d'une opération. D'autres voies fibreuses importantes concernent avant tout les fonctions cérébrales telles que la parole et la vision.
La neuronavigation
La neuronavigation fonctionne comme un «GPS» pendant l'opération et indique le chemin au neurochirurgien, l'IRM réalisée avant l'opération fournissant la «cartographie» individuelle.
Réalité augmentée
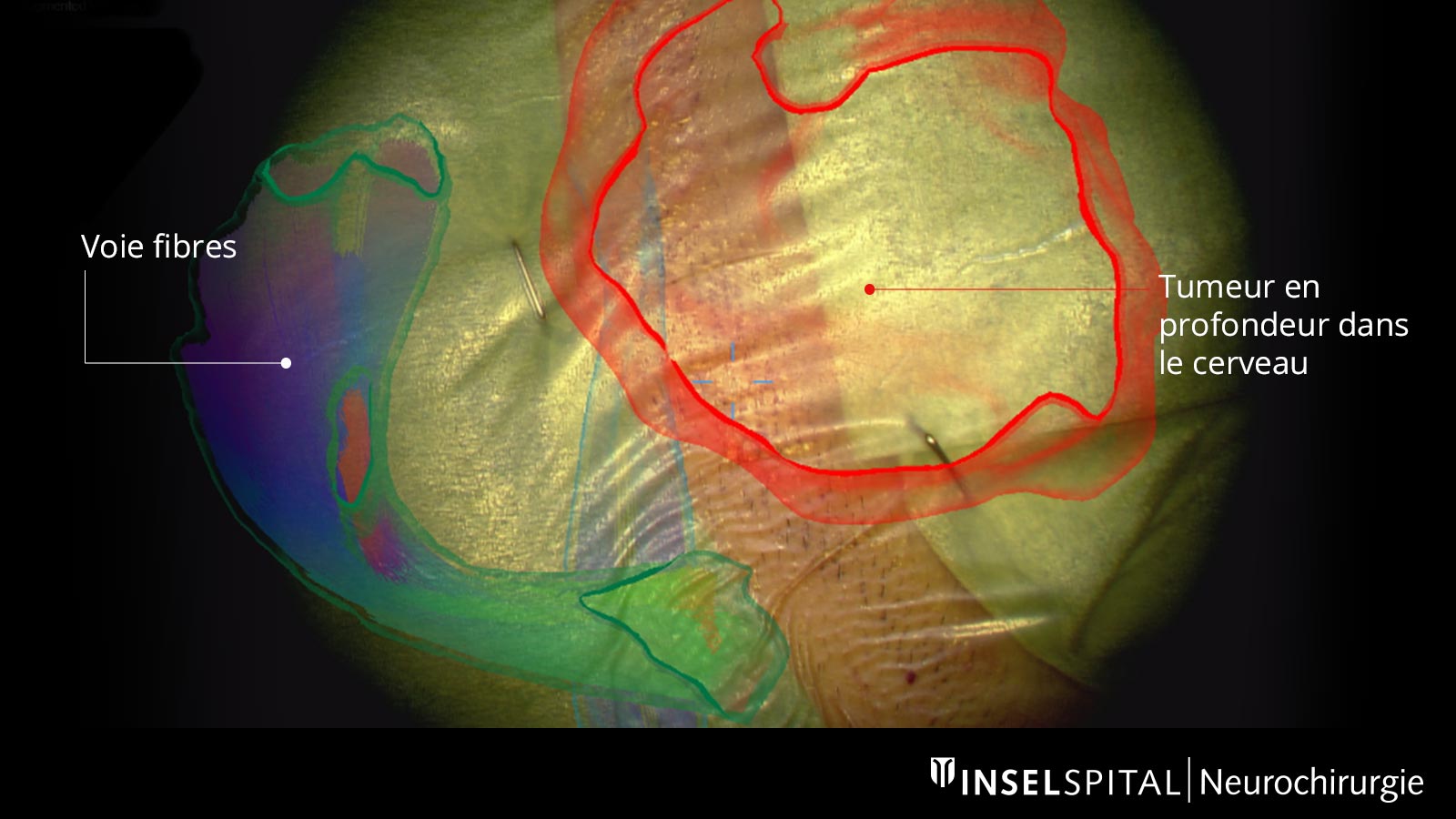
Les trajets des fibres déjà dessinés avant l'opération, tout comme la tumeur elle-même et d'autres centres importants, peuvent être affichés virtuellement dans le microscope opératoire et projetés sur la surface de la tête. Grâce à cette réalité augmentée, le chirurgien peut mieux s'orienter et planifier l'accès à la tumeur aussi petit que possible, mais aussi grand que nécessaire.
Mapping dynamique
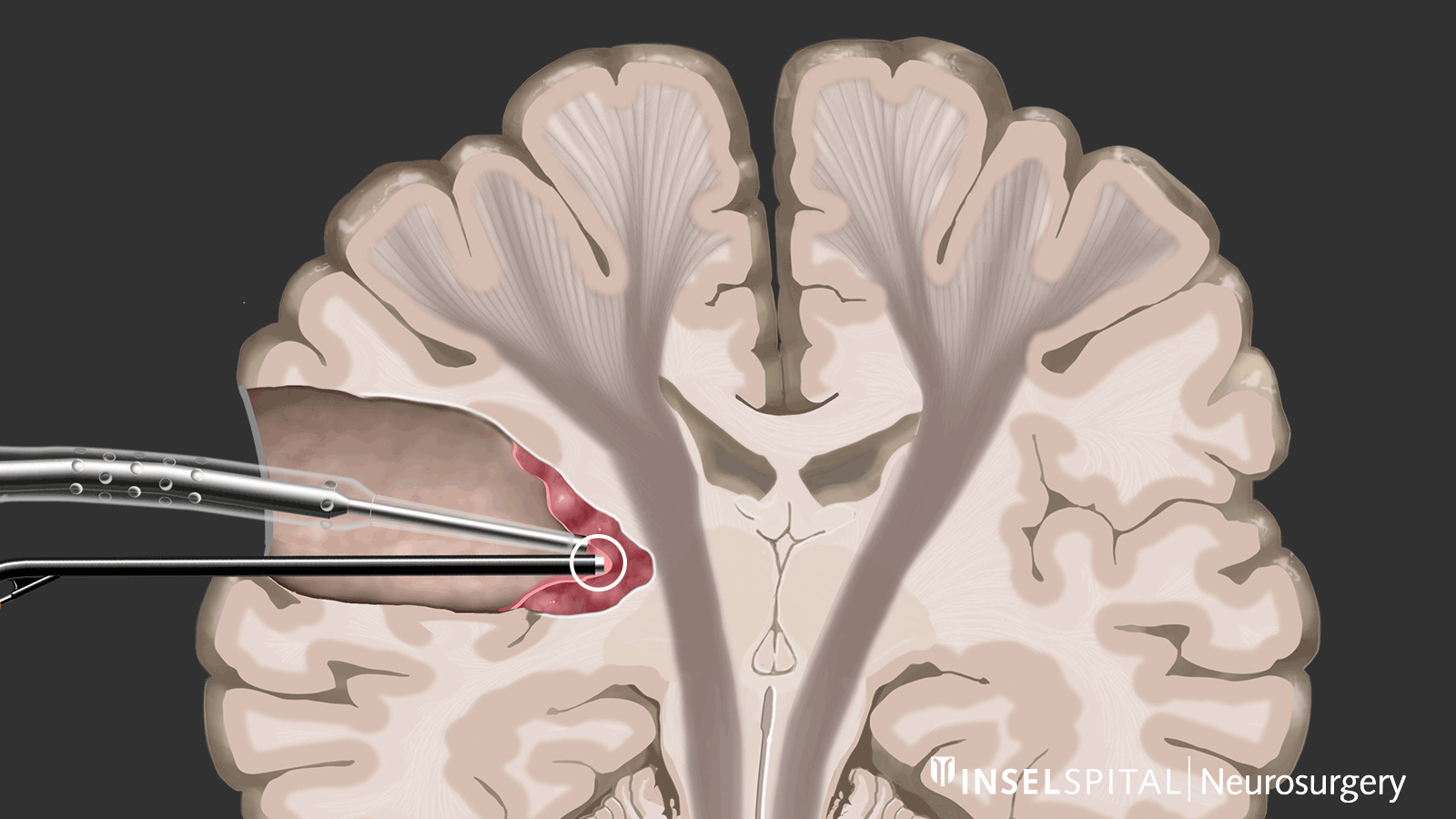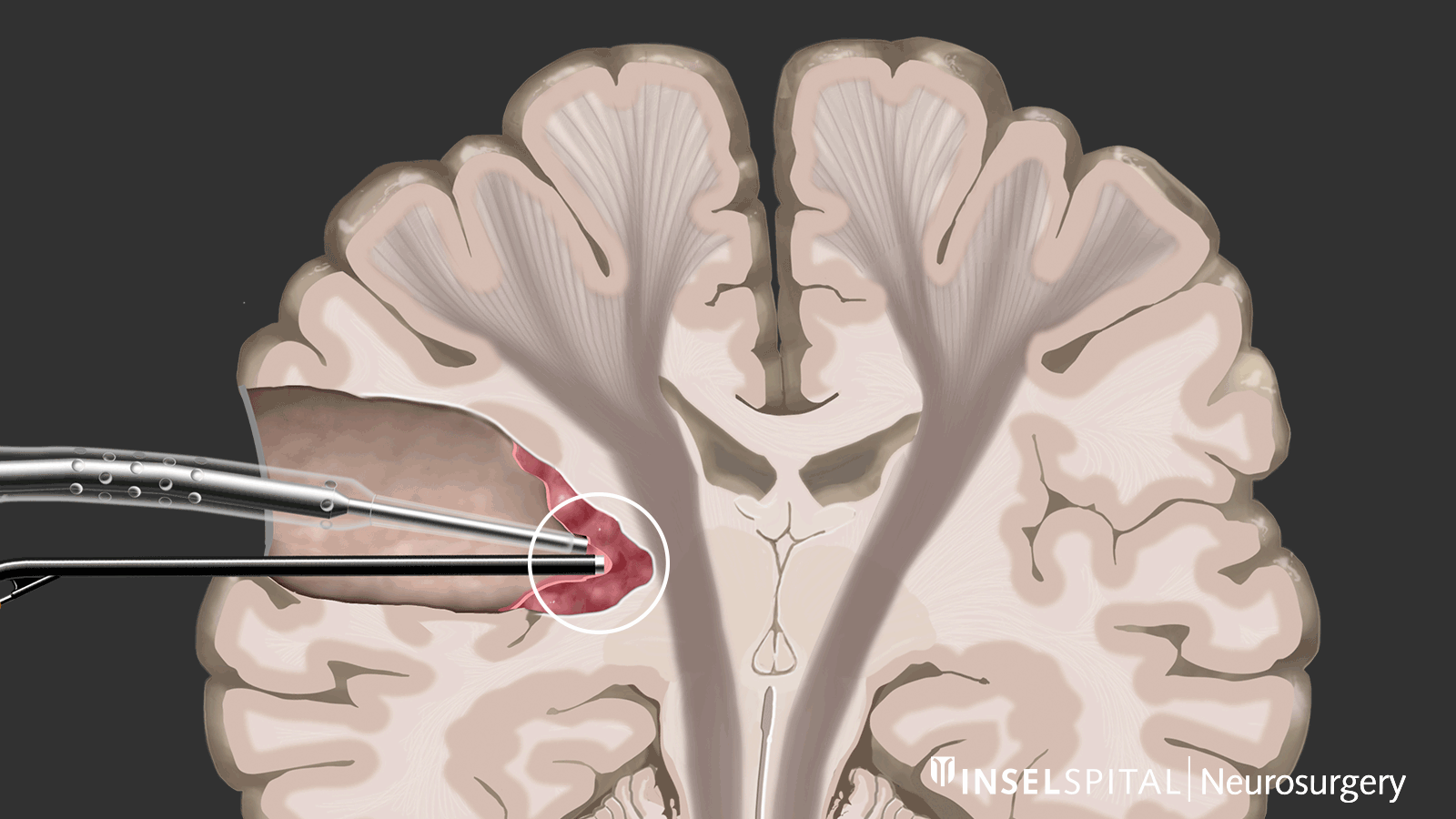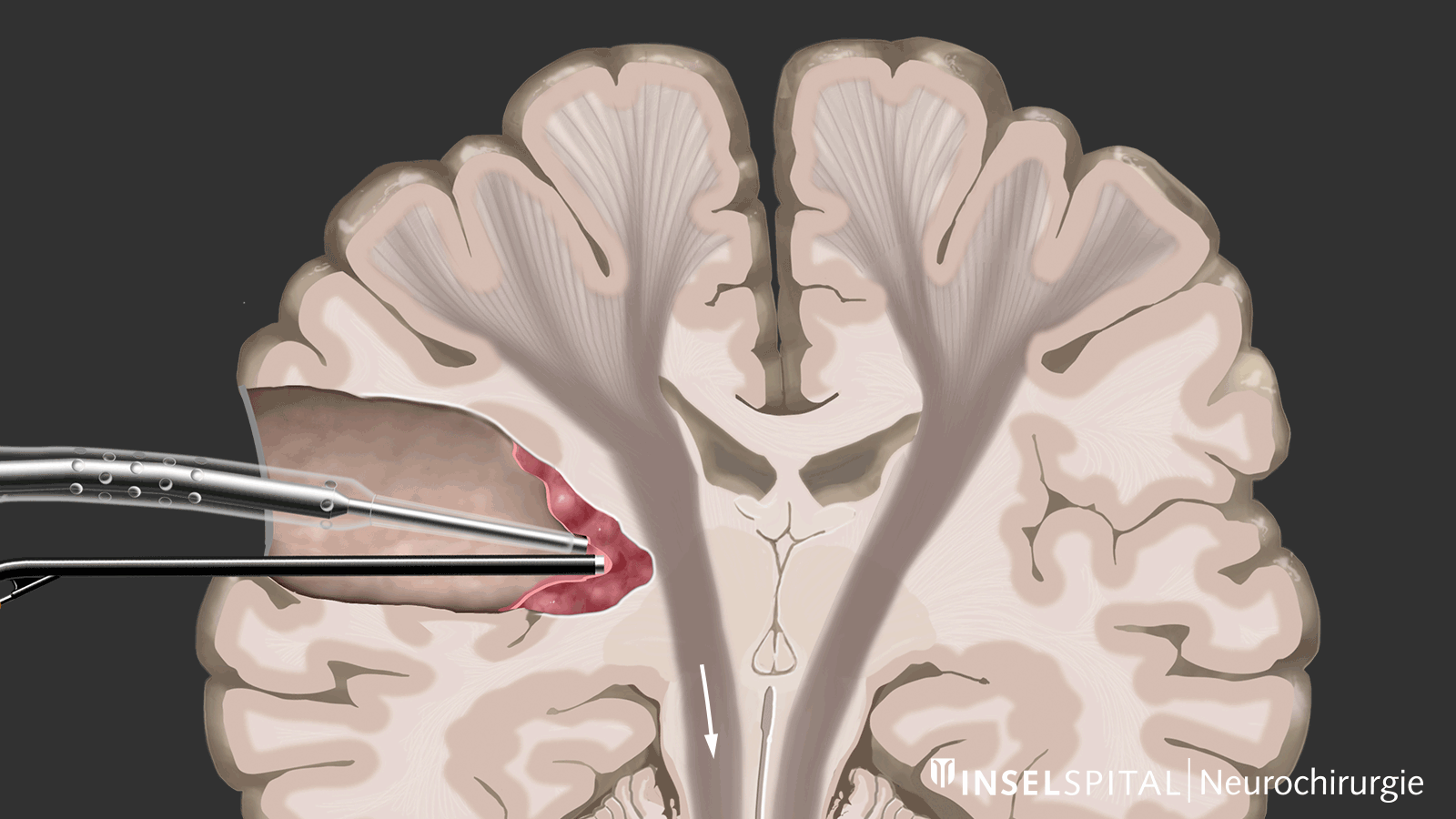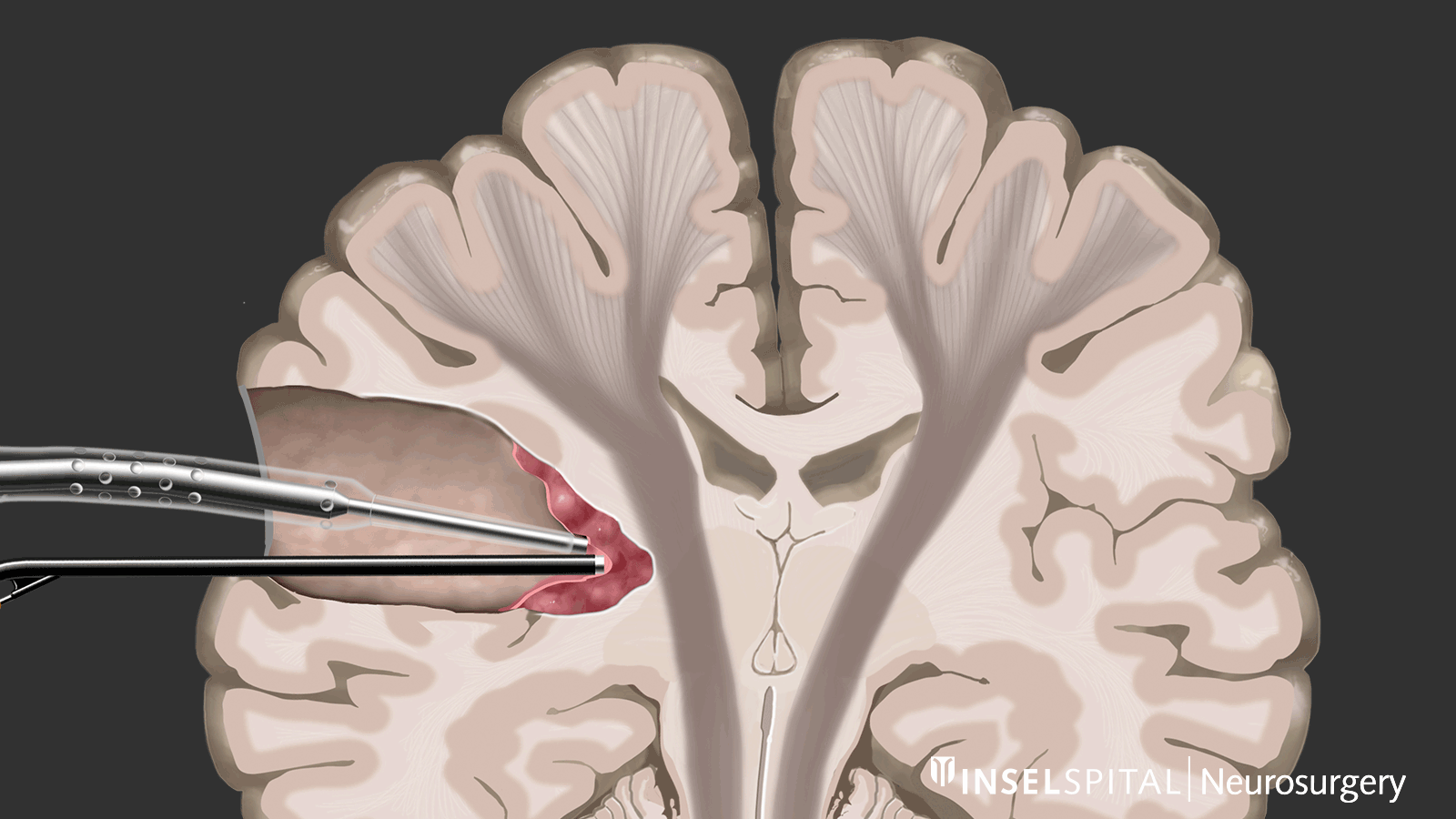
Par mapping dynamique, on entend le balayage continu du tissu cérébral à l'endroit de l'ablation de la tumeur à l'aide d'un radar composé de micro-courants. L'opération d'un gliome devrait toujours être effectuée avec une mapping fonctionnel fonctionnelle spécialisée de la parole, du mouvement, de la vision et des fonctions cérébrales supérieures lorsque la tumeur est en position critique.
Grâce à cette procédure et au monitoring peropératoire complet, le taux de complications pour de telles opérations est aujourd'hui très faible * * * * * * * *.
Chirurgie éveillée
Contrairement à la motricité, les fonctions complexes telles que le langage, la compréhension du langage, le calcul, la musique ou la lecture ne peuvent pas être surveillées chez le patient sous anesthésie. Il est donc nécessaire que le patient soit éveillé pendant une partie de l'opération et qu'il passe des tests spécifiques avec un neuropsychologue. L'emplacement d'un centre invisible peut ainsi être localisé et préservé lors de l'opération.
Thérapie thermique interstitielle au laser (LITT)
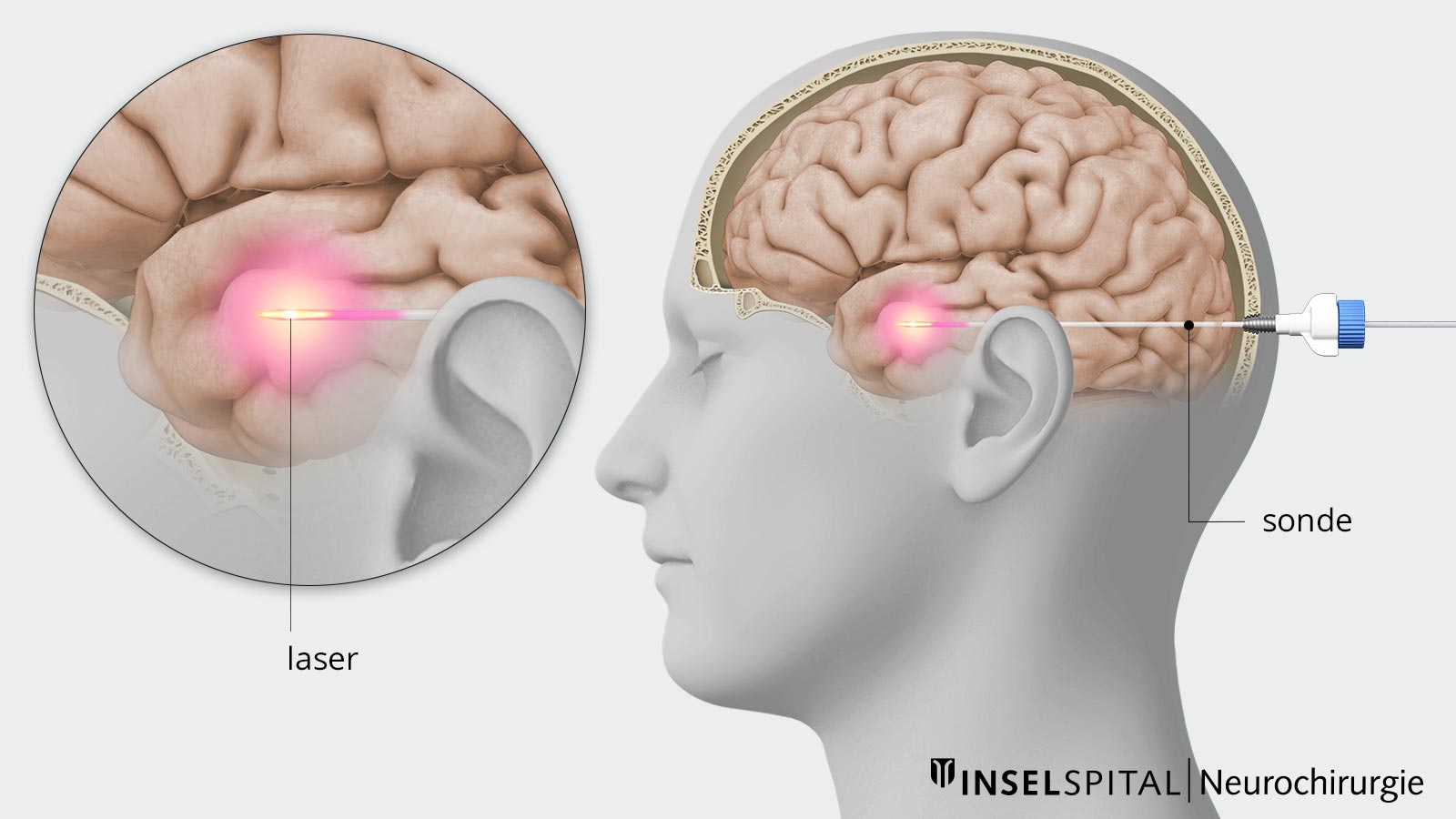
La thérapie thermique interstitielle au laser (LITT) est une procédure mini-invasive assistée par imagerie. Elle consiste à chauffer et détruire des tissus de manière ciblée à l'aide d'énergie laser. La LITT est principalement utilisée pour traiter les foyers épileptiques, les tumeurs cérébrales ou d'autres lésions profondes du cerveau.
Imagerie peropératoire
Comme il est difficile de distinguer les tissus sains des tissus tumoraux, même au microscope, différentes modalités d'imagerie sont utilisées pendant l'opération afin de vérifier directement l'étendue de la résection.
L'échographie est utilisée de manière routinière, mais elle a ses limites lorsqu'il s'agit de visualiser des tissus tumoraux résiduels.
La méthode la plus précise est le contrôle par IRM peropératoire. Pour ce faire, le patient est transféré à l'IRM pendant l'opération, après l'ablation de la tumeur. Ainsi, un résidu tumoral, s'il existe, peut être retiré pendant l'opération. L'Inselspital a construit à cet effet une salle d'opération directement reliée à un appareil IRM à haut champ.
Après l'opération
Histologie
Après l'examen histologique et moléculaire des tissus retirés, la suite de la procédure est discutée par une équipe interdisciplinaire de spécialistes composée de neurochirurgiens, de radio-oncologues et d'oncologues médicaux lors de notre tumor board hebdomadaire à l'Inselspital.
Traitement ultérieur et contrôles
Dans la plupart des cas, il est possible de renoncer à la chimiothérapie et à la radiothérapie. Des contrôles de suivi rapprochés avec IRM tous les 3 à 6 mois permettent de détecter et de traiter précocement toute récidive de la tumeur. Cette stratégie est particulièrement indiquée pour les jeunes patients de moins de 40-50 ans après l'ablation complète de la tumeur.
Dans certains cas, une chimiothérapie et une radiothérapie combinées sont utiles. Il s'agit notamment de :
- ablation incomplète de la tumeur
- âge avancé du patient
- tumeur très volumineuse
- déficiences neurologiques chez le patient
- Tumeur de grade 3 selon l'OMS
- Gliomes de type sauvage IDH
Pour les gliomes de grade II, on privilégie la chimiothérapie, car on souhaite éviter la radiothérapie en raison de l'espérance de vie relativement longue.
Test neurocognitif
L'objectif de l'opération est de permettre aux patients de reprendre rapidement une vie normale après l'opération. Une partie élémentaire du concept de traitement est ici le test neurocognitif des performances cérébrales individuelles avant et après le traitement.
Avant l'opération : une valeur de départ est établie pour différents domaines neurocognitifs tels que l'attention, la mémoire, etc. Un test spécialisé permet ici d'objectiver des déficits subtils qui échapperaient à un examen neurologique normal * * * * * * * *.
Après l'opération : un nouveau test est effectué, de sorte que les différences par rapport aux performances neurocognitives avant l'opération puissent être saisies de manière conséquente et, le cas échéant, corrigées par des mesures de neuroréhabilitation. Des mesures de rééducation ambulatoires ou stationnaires immédiatement après l'opération permettent une réinsertion optimale dans la vie professionnelle et quotidienne *.
Crises d'épilepsie
Un autre facteur important pour la qualité de vie des patients atteints de gliomes de bas grade est le contrôle des crises d'épilepsie.
Après une résection complète de la tumeur, jusqu'à deux tiers des patients présentant des crises d'épilepsie préexistantes n'en auront plus au cours de la première année après l'opération *. La probabilité d'une absence de crises est plus élevée si la tumeur a pu être enlevée le plus complètement possible et si l'épilepsie n'a pas duré plus d'un an auparavant.
Si, après un intervalle sans crise, les crises réapparaissent soudainement en plus grand nombre, cela peut être le signe d'une récidive de la tumeur.
Que faire si l'on ne peut pas opérer ?
Si une tumeur ne peut pas être opérée en raison de sa localisation dans un centre important sur le plan fonctionnel ou de son extension diffuse, il convient au moins de réaliser une biopsie pour examiner les tissus et confirmer le diagnostic.
Biopsie
Lors d'une biopsie, une fine aiguille est introduite de manière ciblée dans la tumeur par un petit trou et un échantillon de tissu est prélevé. Le risque de complication d'une biopsie est très faible, les saignements menaçants ne surviennent que dans environ 1 % des cas.
Un problème plus fréquent est cependant la mauvaise graduation des tumeurs dans jusqu'à un quart des cas *: Étant donné qu'un gliome peut être composé de manière très hétérogène de cellules de différents grades de l'OMS, la biopsie d'une partie moins maligne entraîne un diagnostic erroné de gliome de bas grade, alors qu'il s'agit en réalité d'un gliome agressif de haut grade.
Afin de réduire le taux d'erreurs de diagnostic, nous utilisons systématiquement des techniques telles que la spectroscopie RM ou la TEP-FET lors des biopsies
Dès que le diagnostic exact est établi après la biopsie, la tumeur est traitée par radiothérapie et chimiothérapie.
Dans certains cas, lorsqu'un gliome de bas grade est inopérable, une chimiothérapie peut s'avérer utile avant une opération ultérieure. La chimiothérapie peut faire régresser la tumeur au point de transformer une tumeur inopérable en une tumeur opérable *. Il s'agit toutefois d'une exception et non d'une procédure standard.
Que faire si la tumeur revient ?
La suite du traitement en cas de progression de la tumeur dépend de différents facteurs :
- l'état neurologique du patient
- la dynamique temporelle
- des marqueurs moléculaires de la tumeur
- des thérapies déjà suivies.
Le traitement de choix en cas de récidive, c'est-à-dire de croissance de la tumeur, est à nouveau l'ablation chirurgicale.
Le cerveau dispose en principe de la capacité de transférer des fonctions d'une zone cérébrale menacée par la tumeur vers une autre zone cérébrale. C'est ce que l'on appelle la plasticité. C'est pourquoi il est tout à fait possible d'enlever la tumeur, lors d'une deuxième opération, d'un endroit où des fonctions cérébrales étaient encore présentes lors de la première opération.
Une radiothérapie et/ou une chimiothérapie sont envisagées lorsqu'au moins une partie de la tumeur ne peut plus être opérée. Le choix de la chimiothérapie dépend alors du caractère génétique de la tumeur.
Chimiothérapie
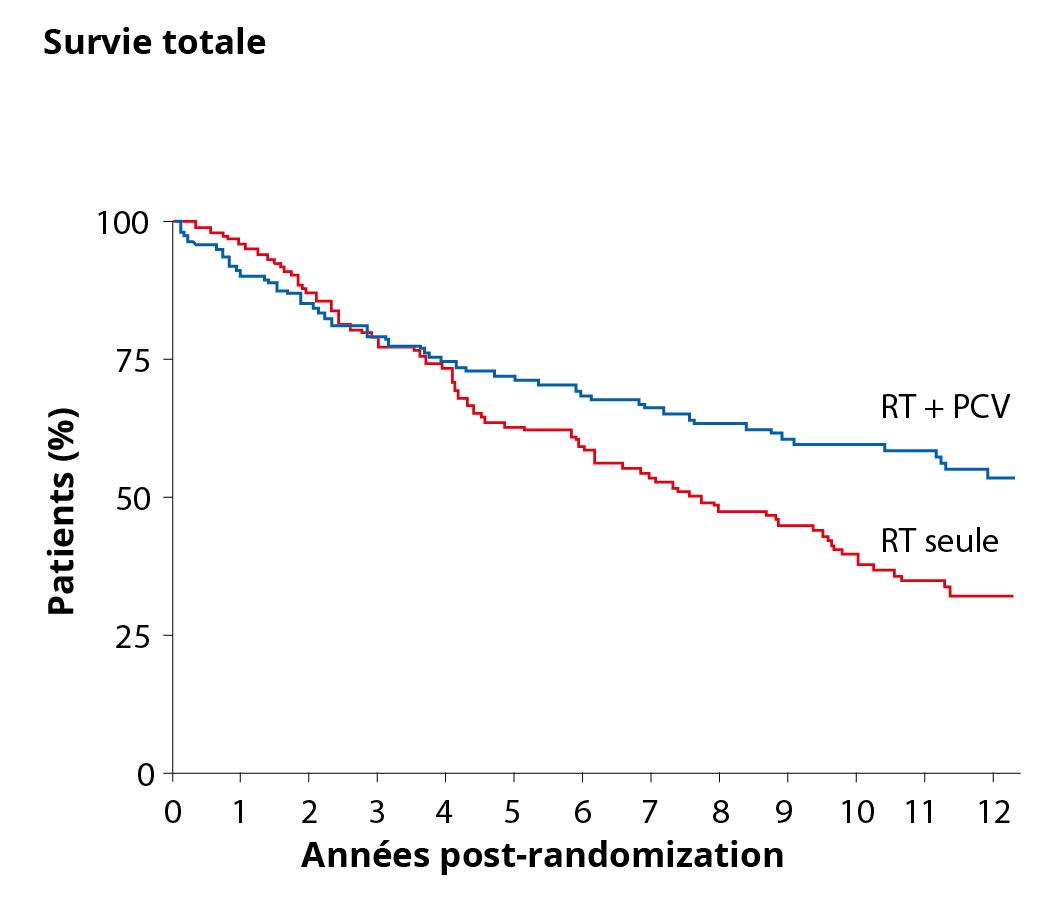
Une étude internationale a pu démontrer que les patients atteints d'un gliome de grade II de l'OMS et présentant les facteurs de risque susmentionnés bénéficient d'une chimiothérapie en plus de la radiothérapie *.
Dans le graphique de droite, deux courbes comparent la survie globale des patients atteints de tumeurs de grade II de l'OMS et présentant des facteurs de risque supplémentaires. La courbe bleue représente la survie globale des patients après un traitement combiné de radiothérapie (RT pour Radiotherapy) et de chimiothérapie (PCV) et montre une survie globale plus élevée que la courbe rouge avec des patients qui ont eu une radiothérapie comme seul traitement.
La chimiothérapie ne peut toutefois pas être administrée aussi souvent que souhaité, car les tumeurs développent souvent une résistance aux chimiothérapies. C'est pourquoi on ne l'utilise généralement qu'en cas de facteurs de risque ou de dégénérescence maligne du gliome.
- Chemotherapeutika
-
Les agents chimiothérapeutiques utilisés sont d'une part le témozolomide (nom commercial Temodal®) ou le PCV. Le PCV est une combinaison de trois substances (procarbazine, lomustine et vincristine) et est généralement utilisé pour les oligodendrogliomes avec codélétion 1p19q. Pour les astrocytomes diffus avec mutation ATRX, on utilise plus souvent le témozolomide.
Als Chemotherapeutika kommen einerseits Temozolomid (Handelsname Temodal®) oder PCV zur Anwendung. PCV steht für die Kombination von 3 Substanzen (Procarbazin, Lomustin und Vincristin) und wird in der Regel bei Oligodendrogliomen mit 1p19q-Kodeletion eingesetzt. Bei diffusen Astrozytomen mit ATRX-Mutation kommt häufiger Temozolomid zur Anwendung.
Radiothérapie
L'irradiation se fait généralement en 30 séances, à raison d'une dose de 1,8 Gy par séance, jusqu'à une dose totale de 54 Gy. Les effets secondaires les plus fréquents de la radiothérapie sont la fatigue, les nausées, les irritations cutanées et la perte de cheveux. L'irradiation présente en outre l'inconvénient que des années après le traitement, des lésions cérébrales à long terme telles qu'une leucoencéphalopathie ou une détérioration générale des fonctions cérébrales peuvent survenir.
L'étude EORTC-22845 a pu démontrer qu'une irradiation précoce n'apporte aucun avantage en termes de survie globale par rapport à une irradiation plus tardivet *. Une irradiation précoce améliore uniquement la survie sans progression (sans récidive), mais pas la survie globale.
Une irradiation complète ne peut être administrée qu'une seule fois. C'est pourquoi elle n'est généralement utilisée qu'en cas de facteurs de risque ou de dégénérescence maligne du gliome.
Médecine complémentaire
Un conseil sur les possibilités thérapeutiques de la médecine complémentaire est à votre disposition, si vous le souhaitez, à l'Institut de médecine complémentaire et intégrative de l'Inselareal. Nous pouvons volontiers vous adresser à la consultation. L'offre de l'institut comprend la médecine élargie par l'anthroposophie, la phytothérapie, les conseils nutritionnels, les art-thérapies, l'eurythmie curative ainsi qu'un conseil sur le mode de vie et le renforcement de soi.
Cas particulier: astrocytome diffus sans mutation de l'IDH (type sauvage de l'IDH)
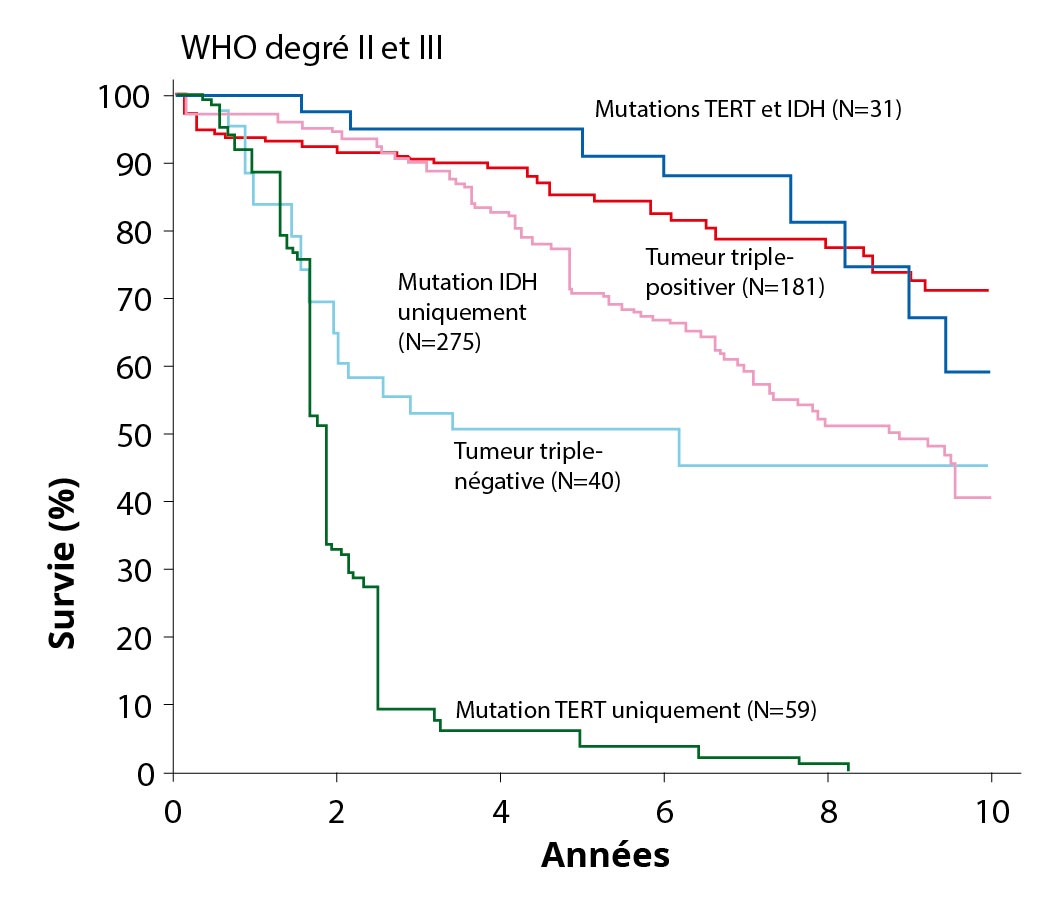
Les marqueurs génétiques des gliomes de bas grade sont extrêmement importants, car parmi eux se "cachent" des tumeurs ayant un comportement de croissance différent.
Les astrocytomes diffus de grade II de l'OMS sans mutation IDH (type sauvage IDH) constituent un tel cas particulier. Bien qu'ils soient classés comme grade II par l'OMS, ils ont un comportement biologique différent, présentent souvent une croissance plus agressive et sont associés à une survie plus courte *. C'est pourquoi, après une résection complète, ces tumeurs doivent également faire l'objet d'un traitement ultérieur par radiothérapie et chimiothérapie.
- Marqueurs génétiques IDH type sauvage
-
La signature génétique typique d'un astrocytome diffus avec mutation IDH est une altération des gènes p53 et ATRX. En revanche, les astrocytomes diffus sans mutation IDH (type sauvage IDH) présentent des modifications dans les gènes suppresseurs de tumeur de PTEN, NF1 et CDKN2A, ainsi que dans le gène du récepteur EGF et dans le gène TERT *.
Le produit du gène TERT est une enzyme qui empêche le raccourcissement progressif des extrémités chromosomiques lors d'une division cellulaire rapide. La sénescence d'une cellule est ainsi retardée.
Le récepteur de l'EGF capte les signaux de l'environnement d'une cellule, ce qui permet la croissance et la division d'une cellule. Ces deux derniers gènes sont typiquement suractifs dans un gliome de type sauvage IDH.
- Pourquoi opérer tout de suite si la tumeur ne se développe que lentement ?
-
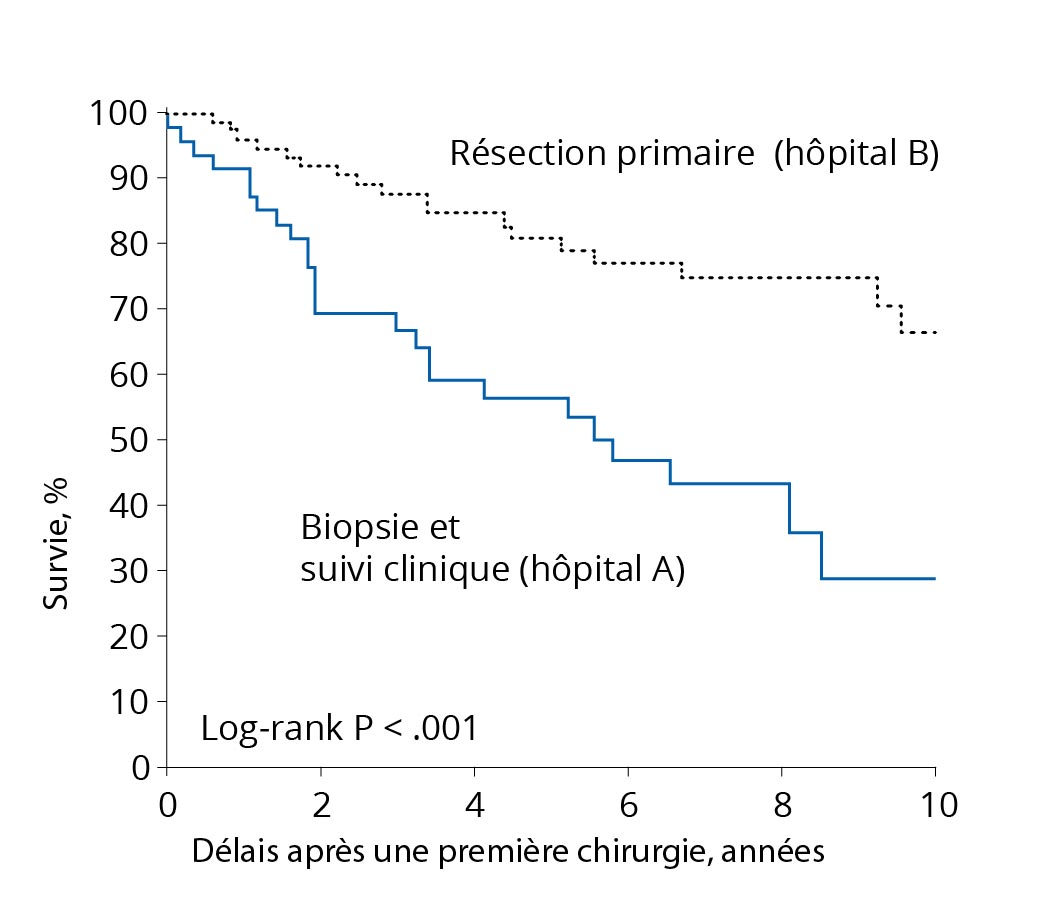
Comparaison des concepts de traitement. Un concept de traitement avec une résection précoce (courbe noire) entraîne une survie plus longue qu'un concept qui privilégie uniquement une biopsie ou une attitude attentiste (courbe bleue). Source : D'après Jakola et al. Comparison of a strategy favoring early surgical resection vs a strategy favoring watchful waiting in low-grade gliomas. JAMA 2012 ; 308(18):1881-8. Auparavant, les gliomes de bas grade étaient plutôt traités de manière attentiste et opérés tardivement. Il y avait plusieurs raisons à cela. D'une part, la plupart des patients se portaient encore très bien au moment du diagnostic. D'autre part, il était rarement possible d'enlever complètement la tumeur, car le développement technologique n'était pas encore aussi avancé qu'aujourd'hui. De plus, les méthodes modernes de surveillance des fonctions cérébrales et de prévention des déficits lors d'une opération n'étaient pas encore très développées.
La stratégie moderne consistant à opérer très tôt repose sur des connaissances scientifiques relativement récentes. Une comparaison des durées de survie de patients de deux hôpitaux universitaires avec deux concepts de traitement différents, mais suivis de manière conséquente, a montré un net avantage de survie en faveur des patients opérés à un stade précoce. Une surveillance de l'évolution pendant des années ou une biopsie suivie d'une chimiothérapie ou d'une radiothérapie sans opération ont ensuite entraîné plus souvent des dégénérescences malignes (transformations malignes) ainsi qu'une évolution plus rapide de la maladie *.
Le comportement de croissance lente de ces tumeurs permet de prendre la décision d'opérer avec soin et sans précipitation. L'opération doit être réalisée dans les mois qui suivent le diagnostic.
- Où dois-je me faire opérer?
-
Les gliomes devraient être opérés dans un centre de neuro-oncologie disposant d'un grand nombre de cas, d'une expérience avérée, d'une technique de pointe et d'une véritable coopération interdisciplinaire. Le terme «centre de compétence» n'étant pas protégé, il vaut la peine d'examiner de plus près les critères qui sont vraiment pertinents pour l'évaluation d'un hôpital :
- Comparaison des chiffres officiels de gliomes opérés basés sur les statistiques de l'hôpital ou les statistiques publiques de la Confédération.
- Nombre de publications nationales et internationales, c'est-à-dire de publications des résultats propres à l'hôpital dans des revues scientifiques sur le thème des gliomes.
- Confirmation par une certification officielle selon les critères des normes ISO (ClarCert) et de la Ligue allemande contre le cancer (OnkoZert). Toutes les disciplines impliquées dans le tumorboard - oncologie, radio-oncologie, neuroradiologie, neurologie et disciplines d'accompagnement - doivent répondre à des normes de qualité élevées et sont de véritables partenaires coopérant entre eux.
- Le traitement des gliomes en tant que priorité scientifique et clinique, visible dans nos propres études, dans le développement de techniques et de méthodes spéciales, dans notre propre base de données pour enregistrer les résultats individuels et la qualité du traitement, ainsi que dans une équipe tumorale fixe composée de soins et de médecins spécialisés.
Au sein du service de neurochirurgie de l'Inselspital, nous remplissons les exigences mentionnées pour un centre de neuro-oncologie et nous vous offrons encore plus!
- Quelles sont mes chances de guérison?
-
Les cellules tumorales des gliomes ont malheureusement tendance à se disséminer à un stade très précoce dans les environs du noyau tumoral. Le nombre de cellules qui s'éloignent ainsi de la tumeur principale dépend de la taille de la tumeur et de ses caractéristiques moléculaires. Dans le cas de petites tumeurs et de caractéristiques tumorales favorables, il est possible qu'une opération supramarginale élimine plus de 99,9 % des cellules tumorales et qu'il n'en reste que quelques-unes. Comme toutes ces cellules résiduelles ne se développent pas à nouveau, il y a des patients chez qui la tumeur ne se développe pas pendant des décennies, voire pas du tout.
C'est pourquoi on parle davantage de contrôle à long terme (en anglais long-term disease control) que de guérison pour les gliomes. Ce contrôle à long terme fait également l'objet d'études actuelles. Jusqu'à présent, les principaux facteurs d'influence sur la réapparition de la tumeur sont l'ablation complète de la tumeur par IRM-T2 ou FLAIR ainsi que les caractéristiques moléculaires favorables de la tumeur (1p19q supprimée, méthylation favorable).
- Existe-t-il des déficits après l'opération?
-
Dans plus de 50 % des astrocytomes et oligodendrogliomes, des fonctions cérébrales critiques, dites «éloquentes», se trouvent à proximité immédiate (moins de 10 mm) de la tumeur. La préservation de ces fonctions éloquentes est toujours prioritaire, car les déficits neurologiques peuvent accélérer l'évolution de la maladie et entraîner des troubles fonctionnels. Ainsi, l'objectif d'enlever la tumeur de manière supramarginale, c'est-à-dire avec une zone de sécurité, doit être subordonné à la préservation des fonctions.
Le monitoring neurophysiologique haut de gamme est un point fort de notre clinique, dans lequel nous comptons parmi les centres leaders au niveau mondial et collaborons continuellement à des développements ultérieurs. Ainsi, nous avons développé à l'Inselspital un «concept de Berne» spécial de neuromonitoring avec un mapping dynamique continu pour éviter les paralysies. Pour les tumeurs situées à proximité de la voie motrice, seuls 3 à 5 % de nos patients présentent des limitations durables. C'est l'un des chiffres les plus bas au monde pour les déficits moteurs!
Ce n'est qu'à l'aide d'un mapping spécialisé ou du mapping de fonctions que l'on peut opérer précisément jusqu'à la distance critique de sécurité de la fonction éloquente. Ainsi, dans de nombreux astrocytomes et oligodendrogliomes, une opération supramarginale est possible, alors que sans mapping, le chirurgien aurait soit terminé l'exérèse de la tumeur trop tôt, soit déjà endommagé la fonction neurologique. Grâce à cette technique nouvelle et innovante, nous parvenons à Berne à ménager ou à récupérer les fonctions dans > 90 % de toutes les opérations.
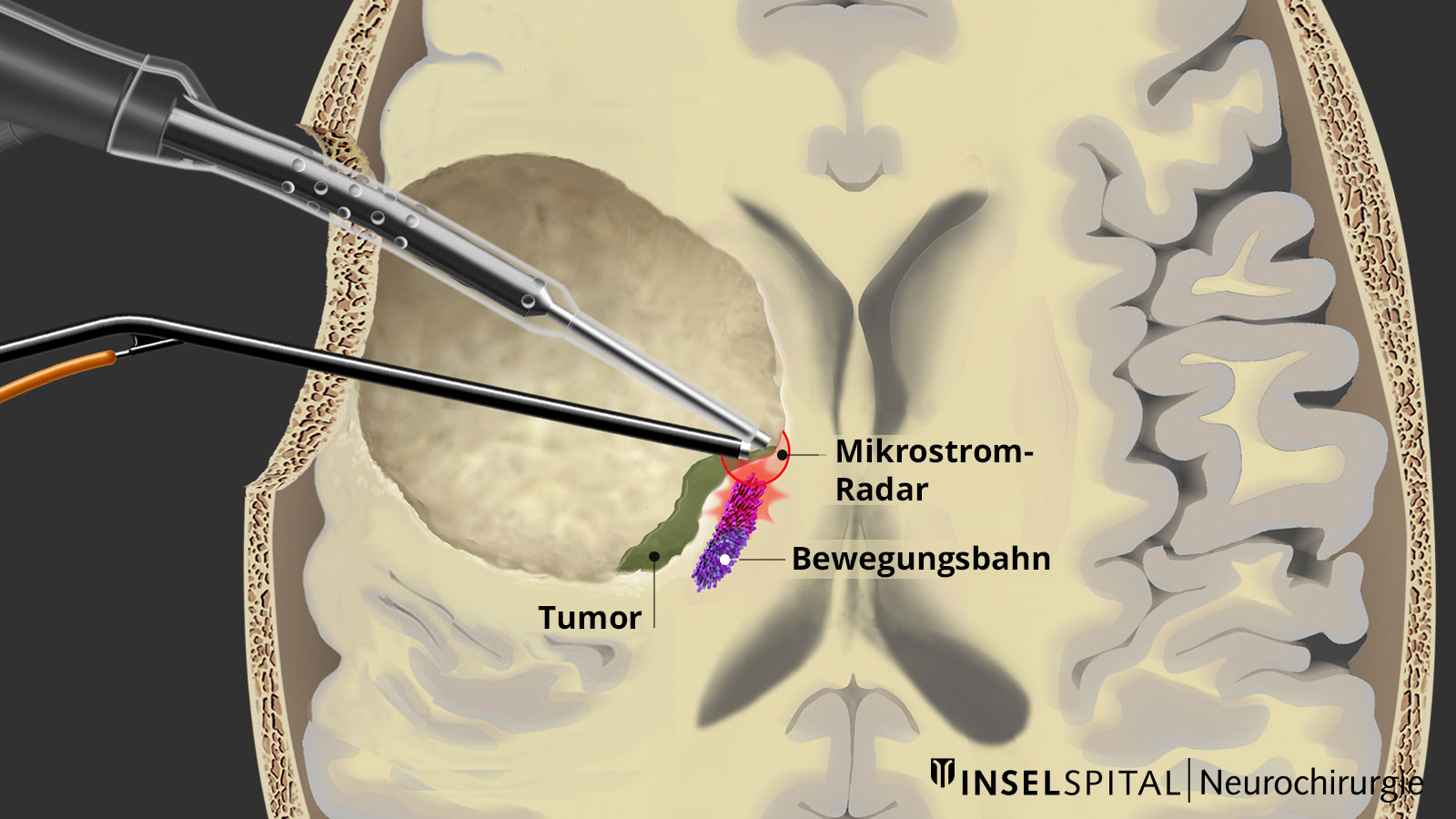
Dynamisches kontinuierliches Mapping. Ein gepulster Mikrostrom spürt während der Tumorresektion wichtige Hirnareale auf, wenn diese in der Nähe liegen. Damit werden der genaue Ort und der Abstand zu diesen Zonen präzise angezeigt und der Chirurg rechtzeitig gewarnt. Bild: Universitätsklinik für Neurochirurgie, Inselspital Bern © CC BY-NC 4.0
- Que puis-je faire en plus du traitement standard?
-
Il existe toute une série de facteurs qui contribuent à une thérapie tumorale plus efficace et constituent ainsi un complément précieux au traitement standard. Les objectifs sont les suivants
- une récupération plus rapide de nos patients
- un séjour plus court à l'hôpital
- une plus grande autonomie du patient
- une plus grande sécurité lors du traitement
- une meilleure qualité de vie
- un effet positif sur le contrôle de la tumeur
Nous avons développé à l'Inselspital un protocole de traitement qui tient compte de tous ces facteurs positifs : le protocole dit OPTIMISST. OPTIMISST signifie «OPTIMIzed Standard and Supportive Therapy».
- À quoi dois-je faire attention après l'opération?
-
Pour la plupart de nos patients, nous visons, selon le protocole OPTIMISST de Berne, à atteindre dès le lendemain de l'opération presque le même niveau d'activité qu'avant l'opération. Toutefois, en cas de tumeur importante ou de localisation éloquente de la tumeur opérée, il convient de prévoir environ 1 à 2 mois de récupération après l'opération. Dans ce cas, il convient de créer au sein de la famille et avec l'employeur des conditions optimales et sans stress pour la période postopératoire.
Les opérations particulièrement difficiles peuvent entraîner des déficits de langage, de force, de compréhension ou d'autres capacités, qui ne sont que temporaires dans 95 % des cas. C'est précisément chez les patients présentant des déficits postopératoires qu'une neuroréhabilitation intensive est essentielle pour que les fonctions perturbées se rétablissent plus rapidement.
Le diagnostic tissulaire est disponible au plus tard une semaine après l'opération et le diagnostic moléculaire au bout d'une semaine supplémentaire. A ce moment-là, une planification individuelle de la suite des opérations (observation ou poursuite du traitement ?) est effectuée au sein du Tumor Board. Pour les cas particuliers, une conférence téléphonique avec le professeur Roger Stupp de la Northwestern University de Chicago, aux États-Unis, permet de discuter de possibilités thérapeutiques ou d'études particulières.
- Combien de temps et à quelle fréquence dois-je passer un examen IRM?
-
En cas de diagnostic d'astrocytome ou d'oligodendrogliome, l'évolution de l'IRM doit généralement être suivie à vie. L'intervalle d'imagerie peut toutefois être adapté. Les intervalles standard sont les suivants :
Tous les 3 mois :
- après l'opération
- en cas de grade III de l'OMS
- en cas de résidus tumoraux visibles
- en cas de tumeurs IDH de type sauvage
- en cas de résidus tumoraux actifs au PET
Tous les 3 à 12 mois :
- selon le type de tumeur
- selon le profil moléculaire
- selon le degré de résection
- selon la période antérieure sans tumeur
- selon l'intervalle sans progression
- Que se passe-t-il si je tombe enceinte? La tumeur se développera-t-elle plus rapidement?
-
Dans un cas concret, vous devriez discuter de cette question avec votre médecin traitant. Voici brièvement quelques informations importantes à ce sujet :
- D'après les connaissances actuelles, la grossesse n'est pas un facteur de risque avéré de croissance tumorale pour un gliome. Comme toujours, il existe cependant en médecine des rapports de cas individuels contraires. L'interruption d'une grossesse face à un diagnostic de gliome n'est pas recommandée dans l'état actuel des connaissances.
- En raison du diagnostic d'un astrocytome ou d'un oligodendrogliome, la probabilité d'une croissance de la tumeur au cours des 3 à 15 prochaines années est relativement élevée. Une opération ou d'autres thérapies seront nécessaires. La patiente et sa famille doivent être conscientes de cette charge.
- Une chimiothérapie préalable peut entraîner un risque accru de mutations et de malformations. Dans ces cas, la grossesse est formellement classée comme grossesse à risque et surveillée.
- Un examen IRM de routine doit être évité si possible pendant la grossesse.
- Ma tumeur va-t-elle se développer à nouveau?
-
Selon les caractéristiques et le grade de la tumeur, il peut s'écouler des mois (type sauvage IDH, astrocytome de grade III) ou des décennies (cas le plus favorable, codélétion 1p19q, autres facteurs optimaux) avant que les cellules résiduelles ne forment à nouveau une tumeur visible. Cette progression est enregistrée dans les IRM de routine.
En cas de nouvelle croissance de la tumeur, nous recommandons à nouveau clairement une résection. La poursuite de la croissance et la probabilité d'une dégénérescence maligne à un niveau supérieur de l'OMS augmentent avec le volume de la tumeur et le temps. Souvent, la tumeur se rapproche des zones cérébrales éloquentes, un mapping fonctionnel spécialisé est donc généralement indispensable.
- Quel est mon pronostic et mon espérance de vie?
-
De nombreux patients atteints de gliomes de bas grade ont une bonne qualité de vie et travaillent dans la profession qu'ils ont apprise sans grandes restrictions dans leur vie quotidienne. L'espérance de vie varie alors fortement et dépend de nombreux facteurs.
Facteurs positifs
Un facteur important ici est avant tout l'étendue de la résection. Les patients ayant subi une résection complète ont un bien meilleur pronostic de survie et moins de dégénérescences malignes.
Grâce à de grandes études, nous savons qu'un jeune âge du patient (moins de 40-50 ans) a également une influence positive sur le pronostic.
Un autre facteur important est l'absence de déficits neurologiques. Ainsi, les patients dont le seul symptôme est une crise d'épilepsie ont un meilleur pronostic *.
Facteurs négatifs
Un volume tumoral important, > 4 cm, est un facteur négatif pour la survie *.
Marqueurs moléculaires
Les patients porteurs d'une mutation de l'IDH présentent un meilleur pronostic que ceux qui n'en sont pas porteurs.
Les patients présentant une mutation de l'IDH et une codélétion 1p/19q supplémentaire ont le meilleur pronostic parmi tous les sous-groupes connus.
Espérance de vie
Chez la moitié des patients atteints d'astrocytomes, de mutation IDH- et ATRX, elle est d'environ 7 à 10 ans, chez l'autre moitié, elle est plus courte ou plus longue.
Chez les patients atteints d'oligodendrogliomes, de mutation IDH et de codélétion 1p/19q, elle est généralement supérieure à 10-15 ans, voire à plusieurs décennies en l'absence de transformation maligne.
-
Jakola AS, Myrmel KS, Kloster R, Torp SH, Lindal S, Unsgård G, Solheim O. Comparison of a strategy favoring early surgical resection vs a strategy favoring watchful waiting in low-grade gliomas. JAMA. 2012 Nov 14;308(18):1881-8. doi: 10.1001/jama.2012.12807.
-
Smith JS, Chang EF, Lamborn KR, Chang SM, Prados MD, Cha S, Tihan T, Vandenberg S, McDermott MW, Berger MS. Role of extent of resection in the long-term outcome of low-grade hemispheric gliomas. J Clin Oncol. 2008 Mar 10;26(8):1338-45. doi: 10.1200/JCO.2007.13.9337.
-
Duffau H. Is supratotal resection of glioblastoma in noneloquent areas possible? World Neurosurg. 2014 Jul-Aug;82(1-2):e101-3. doi: 10.1016/j.wneu.2014.02.015. Epub 2014 Feb 15.
-
Yordanova YN, Moritz-Gasser S, Duffau H. Awake surgery for WHO Grade II gliomas within "noneloquent" areas in the left dominant hemisphere: toward a "supratotal" resection. Clinical article. J Neurosurg. 2011 Aug;115(2):232-9. doi: 10.3171/2011.3.JNS101333. Epub 2011 May 6.
-
Gil-Robles S, Duffau H. Surgical management of World Health Organization Grade II gliomas in eloquent areas: the necessity of preserving a margin around functional structures. Neurosurg Focus. 2010 Feb;28(2):E8. doi: 10.3171/2009.12.FOCUS09236.
-
Ostrom QT, Gittleman H, Xu J, Kromer C, Wolinsky Y, Kruchko C, Barnholtz-Sloan JS. CBTRUS Statistical Report: Primary Brain and Other Central Nervous System Tumors Diagnosed in the United States in 2009-2013. Neuro Oncol. 2016 Oct 1;18(suppl_5):v1-v75. doi: 10.1093/neuonc/now207.
-
Chang EF, Potts MB, Keles GE, Lamborn KR, Chang SM, Barbaro NM, Berger MS. Seizure characteristics and control following resection in 332 patients with low-grade gliomas. J Neurosurg. 2008 Feb;108(2):227-35. doi: 10.3171/JNS/2008/108/2/0227.
-
Sanai N, Chang S, Berger MS. Low-grade gliomas in adults. J Neurosurg. 2011 Nov;115(5):948-65. doi: 10.3171/2011.7.JNS101238.
-
Potts MB, Smith JS, Molinaro AM, Berger MS. Natural history and surgical management of incidentally discovered low-grade gliomas. J Neurosurg. 2012 Feb;116(2):365-72. doi: 10.3171/2011.9.JNS111068. Epub 2011 Oct 14.
-
Pallud J, Fontaine D, Duffau H, Mandonnet E, Sanai N, Taillandier L, Peruzzi P, Guillevin R, Bauchet L, Bernier V, Baron MH, Guyotat J, Capelle L. Natural history of incidental World Health Organization grade II gliomas. Ann Neurol. 2010 Nov;68(5):727-33. doi: 10.1002/ana.22106.
-
Kelly PJ, Daumas-Duport C, Kispert DB, Kall BA, Scheithauer BW, Illig JJ. Imaging-based stereotaxic serial biopsies in untreated intracranial glial neoplasms. J Neurosurg. 1987 Jun;66(6):865-74. doi: 10.3171/jns.1987.66.6.0865.
-
Pallud J, Varlet P, Devaux B, Geha S, Badoual M, Deroulers C, Page P, Dezamis E, Daumas-Duport C, Roux FX. Diffuse low-grade oligodendrogliomas extend beyond MRI-defined abnormalities. Neurology. 2010 May 25;74(21):1724-31. doi: 10.1212/WNL.0b013e3181e04264.
-
Bauman G, Fisher B, Watling C, Cairncross JG, Macdonald D. Adult supratentorial low-grade glioma: long-term experience at a single institution. Int J Radiat Oncol Biol Phys. 2009 Dec 1;75(5):1401-7. doi: 10.1016/j.ijrobp.2009.01.010. Epub 2009 Apr 22.
-
Claus EB, Black PM. Survival rates and patterns of care for patients diagnosed with supratentorial low-grade gliomas: data from the SEER program, 1973-2001. Cancer. 2006 Mar 15;106(6):1358-63. doi: 10.1002/cncr.21733.
-
Duffau H, Taillandier L. New concepts in the management of diffuse low-grade glioma: Proposal of a multistage and individualized therapeutic approach. Neuro Oncol. 2015 Mar;17(3):332-42. doi: 10.1093/neuonc/nou153. Epub 2014 Aug 2.
-
Pedersen CL, Romner B. Current treatment of low grade astrocytoma: a review. Clin Neurol Neurosurg. 2013 Jan;115(1):1-8. doi: 10.1016/j.clineuro.2012.07.002. Epub 2012 Jul 21.
-
Piepmeier JM. Current concepts in the evaluation and management of WHO grade II gliomas. J Neurooncol. 2009 May;92(3):253-9. doi: 10.1007/s11060-009-9870-z. Epub 2009 Apr 9.
-
Soffietti R, Baumert BG, Bello L, Von Deimling A, Duffau H, Frénay M, Grisold W, Grant R, Graus F, Hoang-Xuan K, Klein M, Melin B, Rees J, Siegal T, Smits A, Stupp R, Wick W. Guidelines on management of low-grade gliomas: report of an EFNS-EANO Task Force. Eur J Neurol. 2010 Sep;17(9):1124-1133. doi: 10.1111/j.1468-1331.2010.03151.x.
-
Weller M, van den Bent M, Tonn JC, Stupp R, Preusser M, Cohen-Jonathan-Moyal E, Henriksson R, Le Rhun E, Balana C, Chinot O, Bendszus M, Reijneveld JC, Dhermain F, French P, Marosi C, Watts C, Oberg I, Pilkington G, Baumert BG, Taphoorn MJB, Hegi M, Westphal M, Reifenberger G, Soffietti R, Wick W; European Association for Neuro-Oncology (EANO) Task Force on Gliomas. European Association for Neuro-Oncology (EANO) guideline on the diagnosis and treatment of adult astrocytic and oligodendroglial gliomas. Lancet Oncol. 2017 Jun;18(6):e315-e329. doi: 10.1016/S1470-2045(17)30194-8. Epub 2017 May 5. Erratum in: Lancet Oncol. 2017 Nov;18(11):e642.
-
Capelle L, Fontaine D, Mandonnet E, Taillandier L, Golmard JL, Bauchet L, Pallud J, Peruzzi P, Baron MH, Kujas M, Guyotat J, Guillevin R, Frenay M, Taillibert S, Colin P, Rigau V, Vandenbos F, Pinelli C, Duffau H; French Réseau d'Étude des Gliomes. Spontaneous and therapeutic prognostic factors in adult hemispheric World Health Organization Grade II gliomas: a series of 1097 cases: clinical article. J Neurosurg. 2013 Jun;118(6):1157-68. doi: 10.3171/2013.1.JNS121. Epub 2013 Mar 15.
-
Nikas DC, Bello L, Zamani AA, Black PM. Neurosurgical considerations in supratentorial low-grade gliomas: experience with 175 patients. Neurosurg Focus. 1998 Apr 15;4(4):e4. doi: 10.3171/foc.1998.4.4.7.
-
Peraud A, Ansari H, Bise K, Reulen HJ. Clinical outcome of supratentorial astrocytoma WHO grade II. Acta Neurochir (Wien). 1998;140(12):1213-22. doi: 10.1007/s007010050241.
-
Sanai N, Berger MS. Glioma extent of resection and its impact on patient outcome. Neurosurgery. 2008 Apr;62(4):753-64; discussion 264-6. doi: 10.1227/01.neu.0000318159.21731.cf.
-
van Veelen ML, Avezaat CJ, Kros JM, van Putten W, Vecht C. Supratentorial low grade astrocytoma: prognostic factors, dedifferentiation, and the issue of early versus late surgery. J Neurol Neurosurg Psychiatry. 1998 May;64(5):581-7. doi: 10.1136/jnnp.64.5.581.
-
McGirt MJ, Chaichana KL, Attenello FJ, Weingart JD, Than K, Burger PC, Olivi A, Brem H, Quinoñes-Hinojosa A. Extent of surgical resection is independently associated with survival in patients with hemispheric infiltrating low-grade gliomas. Neurosurgery. 2008 Oct;63(4):700-7; author reply 707-8. doi: 10.1227/01.NEU.0000325729.41085.73
-
Chaichana KL, Cabrera-Aldana EE, Jusue-Torres I, Wijesekera O, Olivi A, Rahman M, Quinones-Hinojosa A. When gross total resection of a glioblastoma is possible, how much resection should be achieved? World Neurosurg. 2014 Jul-Aug;82(1-2):e257-65. doi: 10.1016/j.wneu.2014.01.019. Epub 2014 Feb 6.
-
Keles GE, Lamborn KR, Berger MS. Low-grade hemispheric gliomas in adults: a critical review of extent of resection as a factor influencing outcome. J Neurosurg. 2001 Nov;95(5):735-45. doi: 10.3171/jns.2001.95.5.0735.
-
Nakamura M, Konishi N, Tsunoda S, Nakase H, Tsuzuki T, Aoki H, Sakitani H, Inui T, Sakaki T. Analysis of prognostic and survival factors related to treatment of low-grade astrocytomas in adults. Oncology. 2000 Feb;58(2):108-16. doi: 10.1159/000012087.
-
Nicolato A, Gerosa MA, Fina P, Iuzzolino P, Giorgiutti F, Bricolo A. Prognostic factors in low-grade supratentorial astrocytomas: a uni-multivariate statistical analysis in 76 surgically treated adult patients. Surg Neurol. 1995 Sep;44(3):208-21; discussion 221-3. doi: 10.1016/0090-3019(95)00184-0.
-
De Witt Hamer PC, Robles SG, Zwinderman AH, Duffau H, Berger MS. Impact of intraoperative stimulation brain mapping on glioma surgery outcome: a meta-analysis. J Clin Oncol. 2012 Jul 10;30(20):2559-65. doi: 10.1200/JCO.2011.38.4818. Epub 2012 Apr 23.
-
Duffau H, Capelle L, Denvil D, Sichez N, Gatignol P, Taillandier L, Lopes M, Mitchell MC, Roche S, Muller JC, Bitar A, Sichez JP, van Effenterre R. Usefulness of intraoperative electrical subcortical mapping during surgery for low-grade gliomas located within eloquent brain regions: functional results in a consecutive series of 103 patients. J Neurosurg. 2003 Apr;98(4):764-78. doi: 10.3171/jns.2003.98.4.0764.
-
Duffau H, Peggy Gatignol ST, Mandonnet E, Capelle L, Taillandier L. Intraoperative subcortical stimulation mapping of language pathways in a consecutive series of 115 patients with Grade II glioma in the left dominant hemisphere. J Neurosurg. 2008 Sep;109(3):461-71. doi: 10.3171/JNS/2008/109/9/0461.
-
Keles GE, Lundin DA, Lamborn KR, Chang EF, Ojemann G, Berger MS. Intraoperative subcortical stimulation mapping for hemispherical perirolandic gliomas located within or adjacent to the descending motor pathways: evaluation of morbidity and assessment of functional outcome in 294 patients. J Neurosurg. 2004 Mar;100(3):369-75. doi: 10.3171/jns.2004.100.3.0369.
-
Raabe A, Beck J, Schucht P, Seidel K. Continuous dynamic mapping of the corticospinal tract during surgery of motor eloquent brain tumors: evaluation of a new method. J Neurosurg. 2014 May;120(5):1015-24. doi: 10.3171/2014.1.JNS13909. Epub 2014 Mar 14.
-
Chacko AG, Thomas SG, Babu KS, Daniel RT, Chacko G, Prabhu K, Cherian V, Korula G. Awake craniotomy and electrophysiological mapping for eloquent area tumours. Clin Neurol Neurosurg. 2013 Mar;115(3):329-34. doi: 10.1016/j.clineuro.2012.10.022. Epub 2012 Nov 21.
-
Spena G, Garbossa D, Panciani PP, Griva F, Fontanella MM. Purely subcortical tumors in eloquent areas: awake surgery and cortical and subcortical electrical stimulation (CSES) ensure safe and effective surgery. Clin Neurol Neurosurg. 2013 Sep;115(9):1595-601. doi: 10.1016/j.clineuro.2013.02.006. Epub 2013 Mar 5.
-
Campanella F, Shallice T, Ius T, Fabbro F, Skrap M. Impact of brain tumour location on emotion and personality: a voxel-based lesion-symptom mapping study on mentalization processes. Brain. 2014 Sep;137(Pt 9):2532-45. doi: 10.1093/brain/awu183. Epub 2014 Jul 15.
-
Shields LB, Choucair AK. Management of low-grade gliomas: a review of patient-perceived quality of life and neurocognitive outcome. World Neurosurg. 2014 Jul-Aug;82(1-2):e299-309. doi: 10.1016/j.wneu.2014.02.033. Epub 2014 Feb 19.
-
Aaronson NK, Taphoorn MJ, Heimans JJ, Postma TJ, Gundy CM, Beute GN, Slotman BJ, Klein M. Compromised health-related quality of life in patients with low-grade glioma. J Clin Oncol. 2011 Nov 20;29(33):4430-5. doi: 10.1200/JCO.2011.35.5750. Epub 2011 Oct 17.
-
Carlesimo GA. Memory disorders in patients with cerebral tumors. J Neurooncol. 2012 Jun;108(2):253-6. doi: 10.1007/s11060-012-0825-4. Epub 2012 Feb 21.
-
Klein M, Heimans JJ, Aaronson NK, van der Ploeg HM, Grit J, Muller M, Postma TJ, Mooij JJ, Boerman RH, Beute GN, Ossenkoppele GJ, van Imhoff GW, Dekker AW, Jolles J, Slotman BJ, Struikmans H, Taphoorn MJ. Effect of radiotherapy and other treatment-related factors on mid-term to long-term cognitive sequelae in low-grade gliomas: a comparative study. Lancet. 2002 Nov 2;360(9343):1361-8. doi: 10.1016/s0140-6736(02)11398-5. Erratum in: Lancet. 2011 May 14;377(9778):1654.
-
Taphoorn MJ, Klein M. Cognitive deficits in adult patients with brain tumours. Lancet Neurol. 2004 Mar;3(3):159-68. doi: 10.1016/S1474-4422(04)00680-5.
-
Teixidor P, Gatignol P, Leroy M, Masuet-Aumatell C, Capelle L, Duffau H. Assessment of verbal working memory before and after surgery for low-grade glioma. J Neurooncol. 2007 Feb;81(3):305-13. doi: 10.1007/s11060-006-9233-y. Epub 2006 Aug 31.
-
Gehring K, Sitskoorn MM, Gundy CM, Sikkes SA, Klein M, Postma TJ, van den Bent MJ, Beute GN, Enting RH, Kappelle AC, Boogerd W, Veninga T, Twijnstra A, Boerman DH, Taphoorn MJ, Aaronson NK. Cognitive rehabilitation in patients with gliomas: a randomized, controlled trial. J Clin Oncol. 2009 Aug 1;27(22):3712-22. doi: 10.1200/JCO.2008.20.5765. Epub 2009 May 26.
-
Muragaki Y, Chernov M, Maruyama T, Ochiai T, Taira T, Kubo O, Nakamura R, Iseki H, Hori T, Takakura K. Low-grade glioma on stereotactic biopsy: how often is the diagnosis accurate? Minim Invasive Neurosurg. 2008 Oct;51(5):275-9. doi: 10.1055/s-0028-1082322. Epub 2008 Oct 14.
-
Blonski M, Taillandier L, Herbet G, Maldonado IL, Beauchesne P, Fabbro M, Campello C, Gozé C, Rigau V, Moritz-Gasser S, Kerr C, Rudà R, Soffietti R, Bauchet L, Duffau H. Combination of neoadjuvant chemotherapy followed by surgical resection as a new strategy for WHO grade II gliomas: a study of cognitive status and quality of life. J Neurooncol. 2012 Jan;106(2):353-66. doi: 10.1007/s11060-011-0670-x. Epub 2011 Jul 22.
-
Buckner JC, Shaw EG, Pugh SL, Chakravarti A, Gilbert MR, Barger GR, Coons S, Ricci P, Bullard D, Brown PD, Stelzer K, Brachman D, Suh JH, Schultz CJ, Bahary JP, Fisher BJ, Kim H, Murtha AD, Bell EH, Won M, Mehta MP, Curran WJ Jr. Radiation plus Procarbazine, CCNU, and Vincristine in Low-Grade Glioma. N Engl J Med. 2016 Apr 7;374(14):1344-55. doi: 10.1056/NEJMoa1500925.
-
van den Bent MJ, Afra D, de Witte O, Ben Hassel M, Schraub S, Hoang-Xuan K, Malmström PO, Collette L, Piérart M, Mirimanoff R, Karim AB; EORTC Radiotherapy and Brain Tumor Groups and the UK Medical Research Council. Long-term efficacy of early versus delayed radiotherapy for low-grade astrocytoma and oligodendroglioma in adults: the EORTC 22845 randomised trial. Lancet. 2005 Sep 17-23;366(9490):985-90. doi: 10.1016/S0140-6736(05)67070-5. Erratum in: Lancet. 2006 Jun 3;367(9525):1818.
-
Chang EF, Smith JS, Chang SM, Lamborn KR, Prados MD, Butowski N, Barbaro NM, Parsa AT, Berger MS, McDermott MM. Preoperative prognostic classification system for hemispheric low-grade gliomas in adults. J Neurosurg. 2008 Nov;109(5):817-24. doi: 10.3171/JNS/2008/109/11/0817.
-
Cancer Genome Atlas Research Network, Brat DJ, Verhaak RG, Aldape KD, Yung WK, Salama SR, Cooper LA, Rheinbay E, Miller CR, Vitucci M, Morozova O, Robertson AG, Noushmehr H, Laird PW, Cherniack AD, Akbani R, Huse JT, Ciriello G, Poisson LM, Barnholtz-Sloan JS, ... Zhang J. Comprehensive, Integrative Genomic Analysis of Diffuse Lower-Grade Gliomas. N Engl J Med. 2015 Jun 25;372(26):2481-98. doi: 10.1056/NEJMoa1402121. Epub 2015 Jun 10.
-
Eckel-Passow JE, Lachance DH, Molinaro AM, Walsh KM, Decker PA, Sicotte H, Pekmezci M, Rice T, Kosel ML, Smirnov IV, Sarkar G, Caron AA, Kollmeyer TM, Praska CE, Chada AR, Halder C, Hansen HM, McCoy LS, Bracci PM, Marshall R, Zheng S, Reis GF, Pico AR, O'Neill BP, Buckner JC, Giannini C, Huse JT, Perry A, Tihan T, Berger MS, Chang SM, Prados MD, Wiemels J, Wiencke JK, Wrensch MR, Jenkins RB. Glioma Groups Based on 1p/19q, IDH, and TERT Promoter Mutations in Tumors. N Engl J Med. 2015 Jun 25;372(26):2499-508. doi: 10.1056/NEJMoa1407279. Epub 2015 Jun 10.