Das Glioblastom ist der häufigste bösartige Hirntumor bei Erwachsenen. Es entwickelt sich aus den Gliazellen des Gehirns und tritt vor allem bei älteren Menschen auf. Die Standardtherapie besteht aus einer Kombination von Operation, Bestrahlung und Chemotherapie, bekannt als das sogenannte Stupp-Schema. Die Prognose bei einem Glioblastom ist ungünstig, daher stehen vor allem die Verbesserung der Lebensqualität und die Maximierung der Überlebenszeit der Patienten im Vordergrund.
Inselspital Neurochirurgie – unsere Zahlen und Fakten
- Exzellenz: hochspezialisierte Neurochirurginnen und Neurochirurgen sowie speziell ausgebildete Onkologiepflegekräfte (Advanced Practice Nurses oder kurz APN)
- Expertise: 417 Tumoroperationen (Biopsien und Resektionen) im Jahr 2024, davon 359 Gliome
- Interdisziplinäres Team: In unserem wöchentlichen Tumor-Board treffen sich Spezialisten aus 7 Disziplinen – Neurochirurgie, Neurologie, Neuroradiologie, Onkologie, Nuklearmedizin, Radioonkologie, Pathologie
- Entwickelt und erforscht am Inselspital: innovative Neuromonitoring- und Navigationstechniken zur Operationssicherheit und Vermeidung von Defiziten
- Defizitrate unter den niedrigsten weltweit: Die dokumentierte und publizierte Rate von 3–5 % für dauerhafte operationsbedingte Defizite bei motorisch eloquenten Risikotumoren gehört zu den niedrigsten weltweit!
- Resektionsrate unter den höchsten weltweit: Die Rate von > 90 % Komplettresektion bei Gliomen gehört zu den höchsten weltweit!
- Hochmoderne technologische Ausstattung mit intraoperativer Bildgebung, Fluoreszenztechniken, Laser-Thermotherapie und mehr.
- Ergänzendes Behandlungskonzept: unser OPTIMISST-Protokoll (OPTIMISST steht für Optimized Standard and Supportive Therapy)
- Zertifizierung: Zertifiziertes Hirntumorzentrum seit 2016, Garant für einen hohen Qualitätsmassstab in der onkologischen Behandlung
Was ist ein Glioblastom?
Glioblastome (auch Glioblastoma multiforme wegen der unterschiedlich aussehenden Tumoranteile) sind die häufigsten bösartigen Hirntumoren und machen unter den primären Hirntumoren, die im Hirn entstehen und keine Metastasen sind, einen Anteil von 55 % aus.
Glioblastome wachsen entlang der Faserbahnen im Gehirn und breiten sich so lokal, regional und überregional aus. Glioblastome verursachen in der Regel keine Metastasen ausserhalb des Nervensystems.
Ein Glioblastom wird nach der Weltgesundheitsorganisation (WHO) als WHO-Grad 4 klassifiziert, was die höchste Stufe der Bösartigkeit darstellt. Diese Klassifizierung basiert auf Merkmalen wie
- hohe Zellteilungsrate
- Nekrose (Gewebetod)
- rasches Wachstum neuer Blutgefässe (vaskuläre Proliferation)
Zusätzlich kann die molekulare Analyse spezifische genetische Veränderungen wie Mutationen im IDH1/IDH2-Gen oder die Methylierung des MGMT-Promotors aufdecken, die prognostische und therapeutische Bedeutung haben.
Seltene Varianten des Glioblastoms sind das Gliosarkom, das Riesenzell-Glioblastom und das epitheloide Glioblastom.
- Molekulare Subgruppen
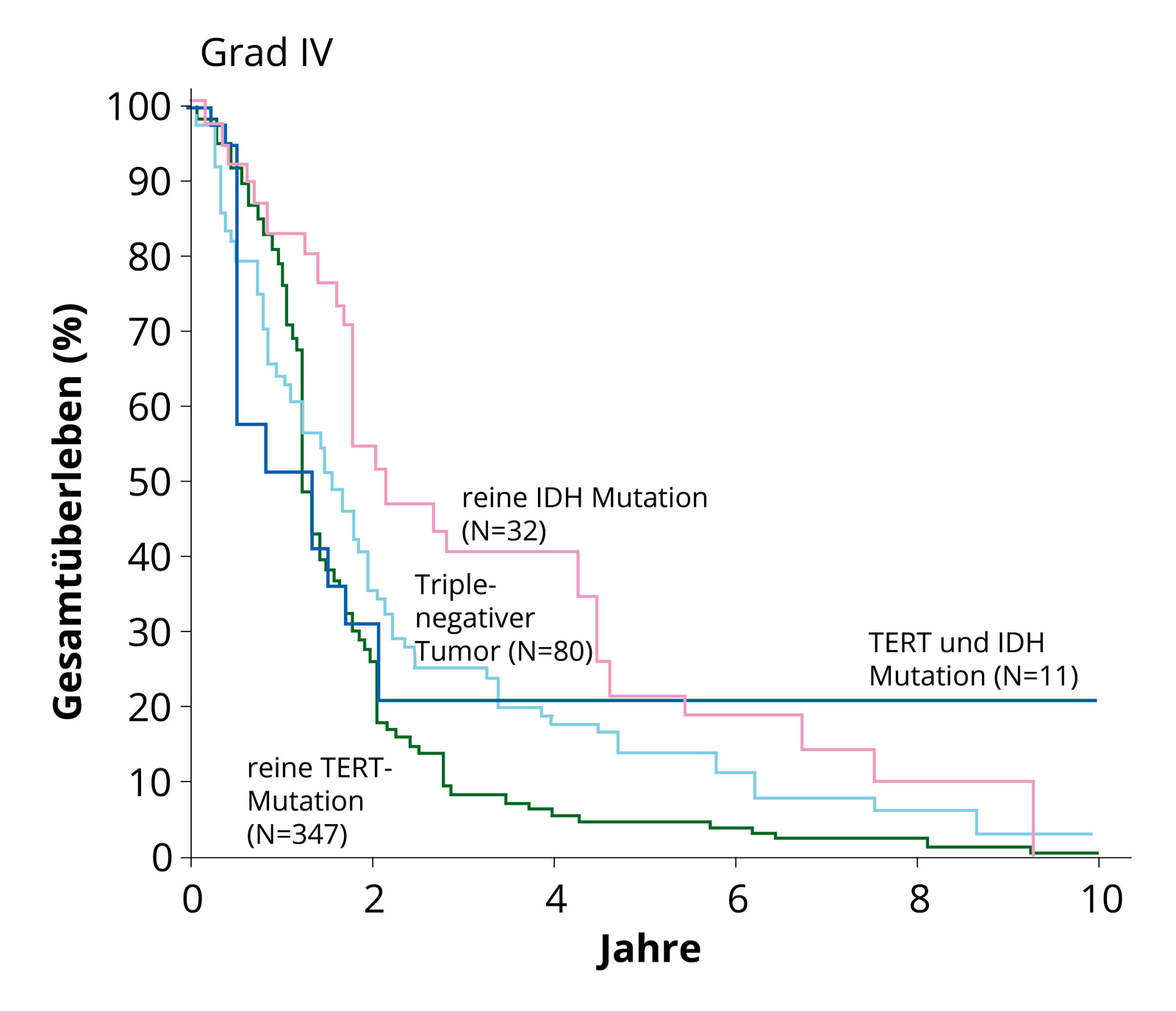
Überlebenskurven der molekularen Subgruppen. Es ist klar ersichtlich, dass Glioblastome ohne IDH-Mutation (IDH-Wildtyp) mit TERT-Mutation ein schlechteres Überleben aufweisen (grüne Linie) als Tumoren mit vorhandener IDH-Mutation. Quelle: Eckel-Passow et al, N Engl J Med 2015; 372:2499–508. Häufig findet man bei primären Glioblastomen
- Mutationen im EGF-Rezeptor
- Mutationen im PTEN-Gen
- Mutationen im TERT-Gen
Der EGF-Rezeptor (von englisch epidermal growth factor receptor) nimmt Signale aus der Umgebung einer Zelle auf, welche Wachstum und Teilung einer Zelle vermitteln, und ist bei primären Glioblastomen oft überaktiv.
Beim Produkt des PTEN-Gens handelt es sich um einen Tumorsuppressor, der eine wichtige Kontrollinstanz in der Regulation des Zellwachstums einnimmt.
Beim Produkt des TERT-Gens handelt es sich um ein Enzym, das die fortschreitende Kürzung der Chromosomenenden bei rascher Zellteilung verhindert. Dadurch wird die biologische Alterung einer Zelle, die sogenannte zelluläre Seneszenz, hinausgezögert.
Sekundäre Glioblastome zeichnen sich durch eine Mutation im Gen der IDH sowie häufig auch durch eine Mutation im p53-Gen, einem Tumorsuppressor, aus.
Gross angelegte genetische Untersuchungen wie die Analysen des Krebsgenom-Projekts (The Cancer Genome Atlas oder TCGA) lieferten weitere wichtige Erkenntnisse zum genetischen Fingerabdruck verschiedener Subtypen von Glioblastomen *.
Die verschiedenen genetischen Untergruppen der Glioblastome unterscheiden sich in ihrem Verhalten.
- Methylierung
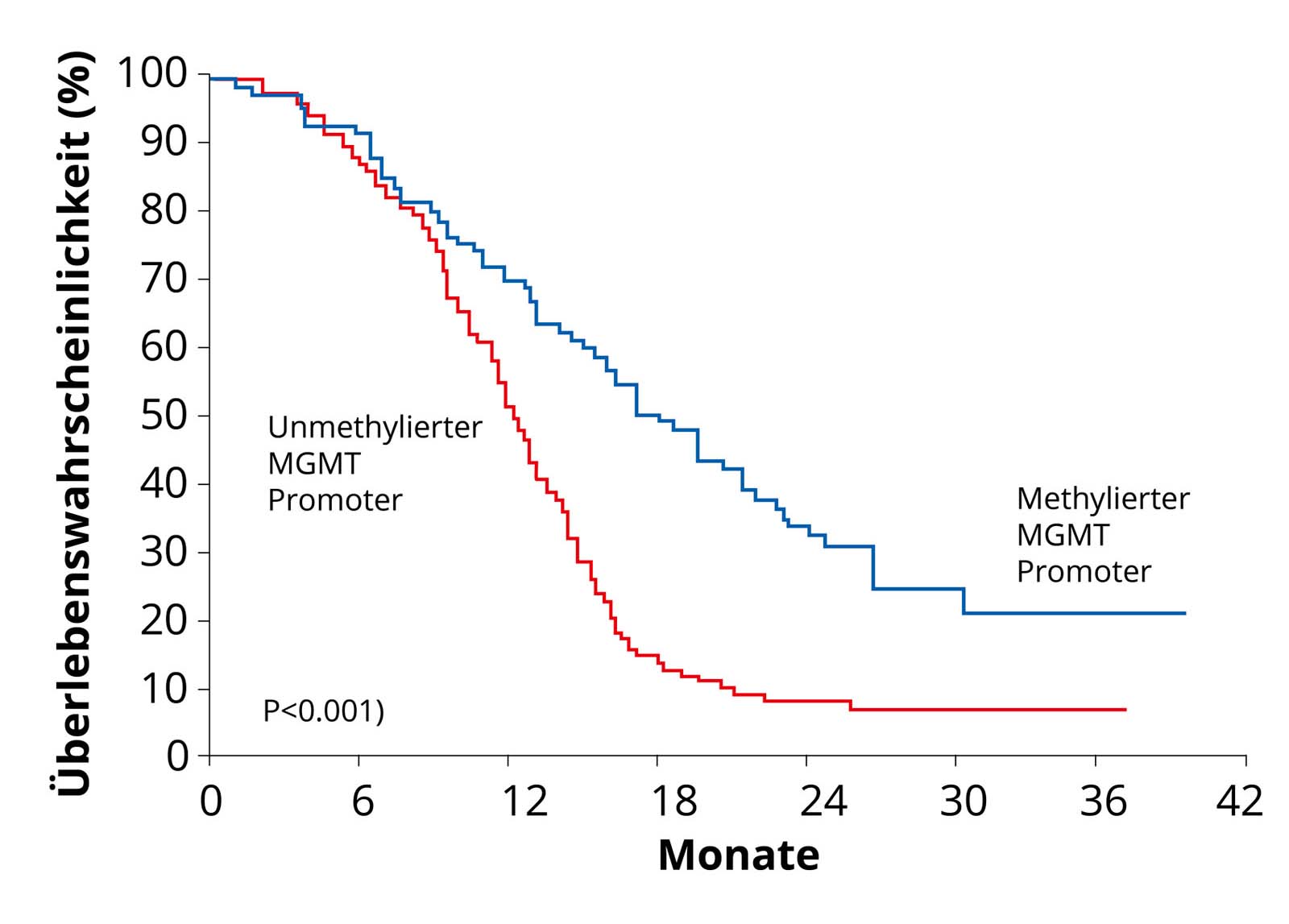
Glioblastome mit Methylierung des MGMT-Promotors. Da diese Tumoren besser auf eine Chemotherapie ansprechen, weisen diese Patienten eine bessere Überlebenskurve auf (blaue Kurve) als Patienten mit nicht-methyliertem MGMT-Promotor (rote Kurve). Quelle: Hegi et al. MGMT Gene Silencing and Benefit from Temozolomide in Glioblastoma. N Engl J Med 2005; 352: 997-1003. Eine wichtige genetische Veränderung der Glioblastomzellen aus therapeutischer Sicht ist die sogenannte DNA-Methylierung des MGMT-Promotors. Unter DNA-Methylierung versteht man die Übertragung von Methylgruppen an bestimmte Stellen der Erbsubstanz (DNA) einer Zelle. Bei der Methylierung wird also die DNA einer Glioblastomzelle verändert. Durch diese Modifikation wird die Produktion des DNA-Reparaturproteins MGMT stillgelegt. Kann ein Tumor seine DNA nicht mehr reparieren, wird er schneller von einer Chemotherapie abgetötet. Ungefähr die Hälfte aller Glioblastome weisen diese genetische Veränderung auf. Diese Glioblastompatienten sprechen besser auf eine Chemotherapie mit Temodal an – eine Methylierung ist also von Vorteil.
In Zukunft wird die methylom-basierte Tumorklassifikation an Bedeutung gewinnen *. Dabei wird die DNA des Tumors auf zusätzliche Methylgruppen hin geprüft. Diese Methylgruppen können einerseits erworben werden und geben andererseits einen Hinweis auf die zelluläre Herkunft des Tumors. Zudem verspricht diese Methode ein hohes Mass an Standardisierung. Die digitale Natur der Methylierungsdaten erlaubt zudem den einfacheren Austausch zwischen Forschungsgruppen und die bessere Zuordnung von unklaren Fällen.
Wie häufig ist ein Glioblastom und wer ist betroffen?
Das Glioblastom tritt typischerweise bei älteren Erwachsenen (50–85 Jahre) mit einem Durchschnittsalter von 64 Jahren auf *. Glioblastome können zwar bei Kindern auftreten, machen jedoch in der Altersgruppe von 0–19 Jahren lediglich 2,9 % aller Hirntumoren aus *.
Insgesamt handelt es sich um seltene Tumoren mit jährlich ca. 3–4 Neudiagnosen pro 100 000 Einwohnern *. Männer sind 1,5-mal häufiger betroffen als Frauen.
Was sind die Ursachen für ein Glioblastom?
Der einzige bestätigte Risikofaktor für die Entwicklung eines Glioblastoms ist eine vorangegangene Bestrahlung des Kopfs.
Ein Zusammenhang mit früheren Kopfverletzungen, Toxinen oder Ernährung konnte nicht eindeutig nachgewiesen werden *, *.
Erbliche Faktoren spielen nur eine untergeordnete Rolle.
Interessanterweise sollen Patienten mit allergischen Erkrankungen (Asthma, atopische Dermatitis, Nahrungsmittelallergien etc.) ein tieferes Risiko für die Entwicklung eines Glioblastoms aufweisen *.
Neue Hypothesen gehen davon aus, dass die erste Glioblastomzelle schon bis zu 7 Jahre vor der Diagnose entstehen kann. Nach dieser Annahme finden die frühen, kritischen Mutationen in der Tumorentstehung 2–7 Jahre vor der Diagnose statt. Aber erst durch das Auftreten zusätzlicher Mutationen wird dann das typische rasche Wachstum des Glioblastoms ausgelöst. Von Patienten mit vorgängig unauffälligem MRI ist bekannt, dass das in der Bildgebung sichtbare Glioblastom innerhalb von einigen Monaten rasch herangewachsen ist *, *.
Verursacht die Strahlung von Handys Hirntumoren?
Grossangelegte epidemiologische Studien an Menschen haben bisher keine Hinweise dafür gefunden, dass der Gebrauch von Mobiltelefonen zu einem erhöhten Risiko für die Entwicklung eines Hirntumors führt *, *.
Aufwändige tierexperimentelle Studien deuten auf ein erhöhtes Tumorrisiko durch Mobilfunkstrahlung bei männlichen Ratten und Mäusen, ohne aber eine Dosis-Wirkungs-Beziehung zu zeigen und ohne das Fehlen dieses Effekts bei weiblichen Tieren erklären zu können.
Beim Menschen fand die INTERPHONE-Studie ein leicht erhöhtes Risiko für die Entwicklung eines Glioms bei exzessivem Mobiltelefongebrauch *. Eine weitere, oft diskutierte Fall-Kontroll-Studie aus Schweden ermittelte ebenfalls einen Zusammenhang zwischen dem Auftreten von Gliomen und Mobiltelefongebrauch *, *. Aufgrund dieser beider Studien stuft die International Agency for Research on Cancer (IARC) der WHO elektromagnetische Radiofrequenzfelder als «möglicherweise krebserregend» ein *.
Demgegenüber konnten jedoch mehrere grossangelegte epidemiologische Studien an Menschen keinerlei Hinweise für ein erhöhtes Hirntumorrisiko finden *, *, *, *. Hierzu zählt auch die nach dem IARC-Bericht veröffentlichte Million Women Study, die prospektive Daten von knapp 800 000 Teilnehmenden sammelte und kein erhöhtes Risiko feststellen konnte *.
Verschiedene Behörden stufen daher auch unterschiedlich ein: von «unbedenklich» bis «möglicherweise leicht krebserregend nicht ausgeschlossen».
Welche Symptome verursacht ein Glioblastom?
Die Symptome hängen grundsätzlich von der Lokalisation des Tumors im Gehirn ab. Es gilt wie bei allen Hirntumoren:
- Anfälle: epileptische Aktivität bzw. Übererregbarkeit des gesunden Gewebes am Rand des Tumors.
- Ausfälle oder Funktionsstörungen: Beeinträchtigung von Sprache, Motorik, Gefühl, Sehen, Rechnen, Denken, Merkvermögen, Gleichgewicht, Orientierung, Stimmung, Verhalten, Wachheit, Antrieb, Sozialverhalten usw. durch den Druck des Tumors auf benachbarte Hirnstrukturen oder das Einwachsen in das umliegende Gewebe.
- Kopfschmerzen, Übelkeit, Erbrechen: ein fortgeschrittener Tumor führt zum Ansteigen des Drucks im Schädel.
- Unspezifische Symptome: Wächst der Tumor in funktionell stillen (nicht-eloquenten) Anteilen des Gehirns, kann dieser einige Zeit unbemerkt bleiben, bis unspezifische Beschwerden wie Wesensveränderung, Müdigkeit, Vergesslichkeit, Desorientiertheit und Verwirrung auftreten. Meist dauern die Symptome bei Diagnosestellung schon einige Wochen bis wenige Monate an.
Wie wird ein Glioblastom diagnostiziert?
Magnetresonanztomografie
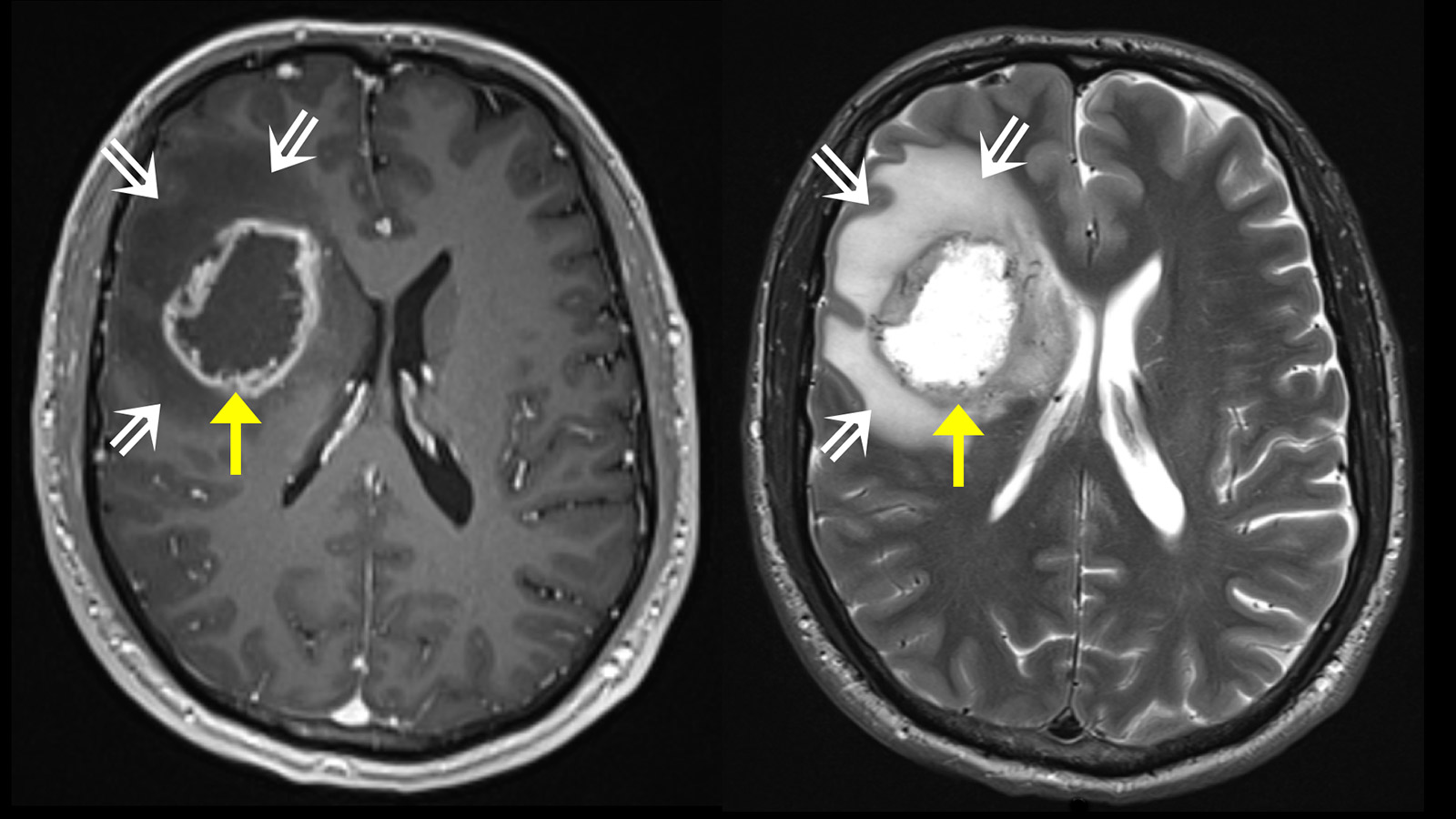
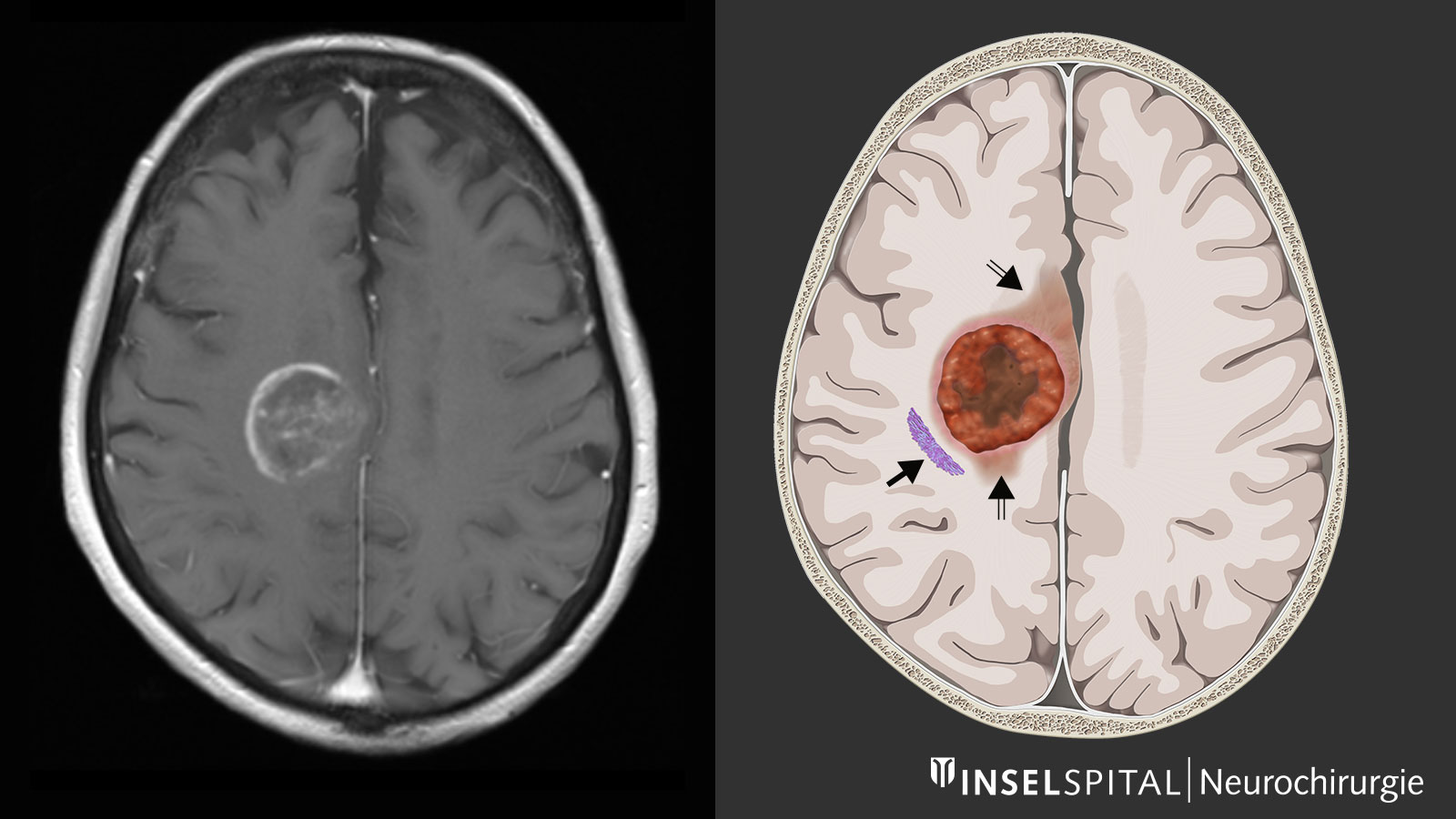
In der Regel wird zur Abklärung der Beschwerden eine Magnetresonanz-Untersuchung des Gehirns durchgeführt. In der Magnetresonanztomografie (MRT bzw. MRI von engl. Magnetic Resonance Imaging) zeigt sich der Tumor als heterogenes, kontrastmittel-aufnehmendes Areal. Typischerweise findet sich eine ringförmige, irreguläre Kontrastmittel-Aufnahme mit einem dunklen Areal im Zentrum, wo Zellen abgestorben sind (Nekrose). Teilweise findet sich eine Ausbreitung entlang der Faserbahnen, was zur Beteiligung verschiedener Hirnlappen führen kann. Um den Tumor herum findet sich in der T2-gewichteten Sequenz des MRI ein helles Areal mit variabler Ausdehnung. Es handelt sich dabei um ein Hirnödem. Im Gegensatz zu Metastasen, bei denen dieses Ödem durch eine reine Gewebereaktion zustande kommt, enthält diese Zone bei Glioblastomen auch aktive Tumorzellen.
Advanced Neuroimaging
Eine weitere bildgebende Differenzierung kann mittels «Advanced Neuroimaging» erfolgen.
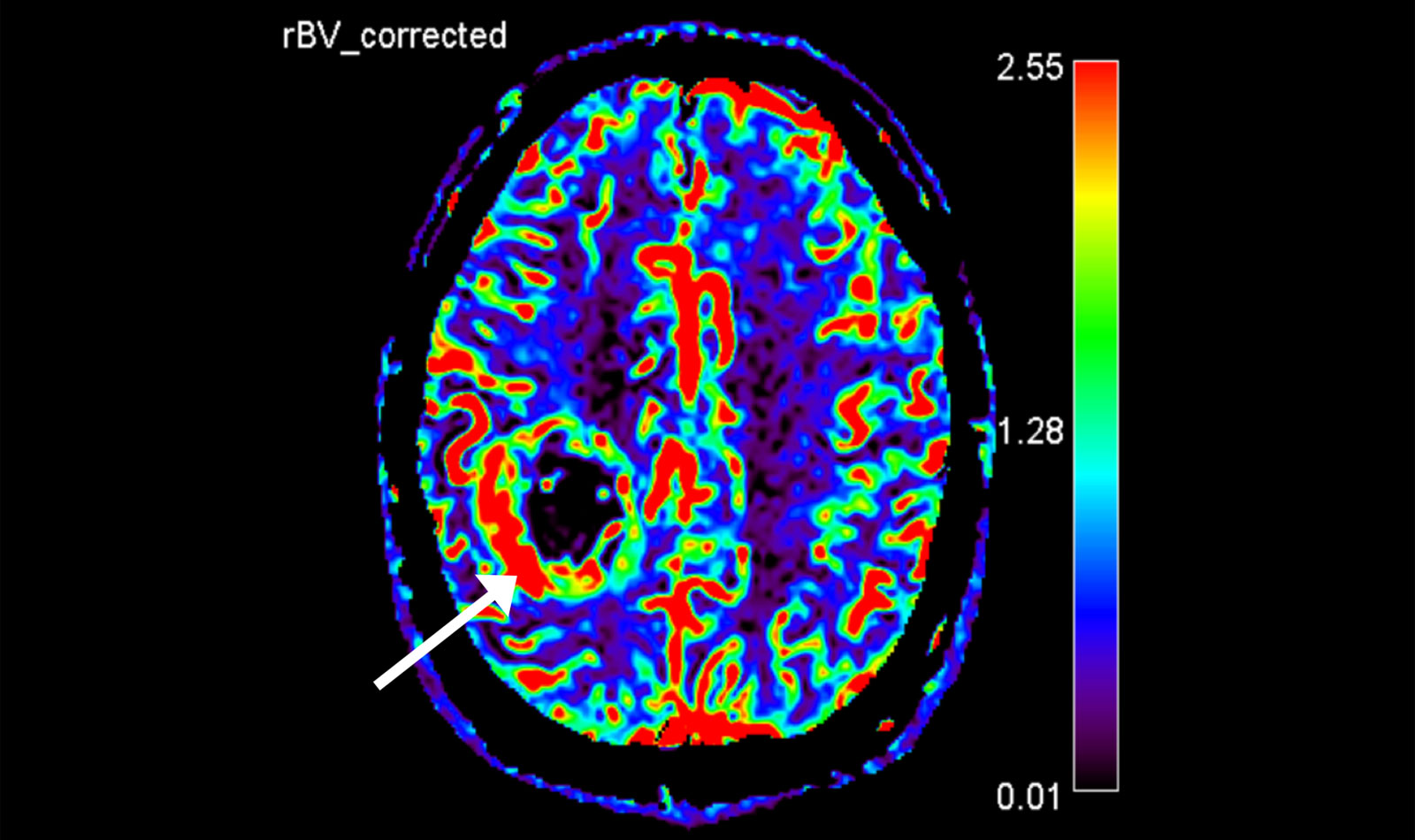
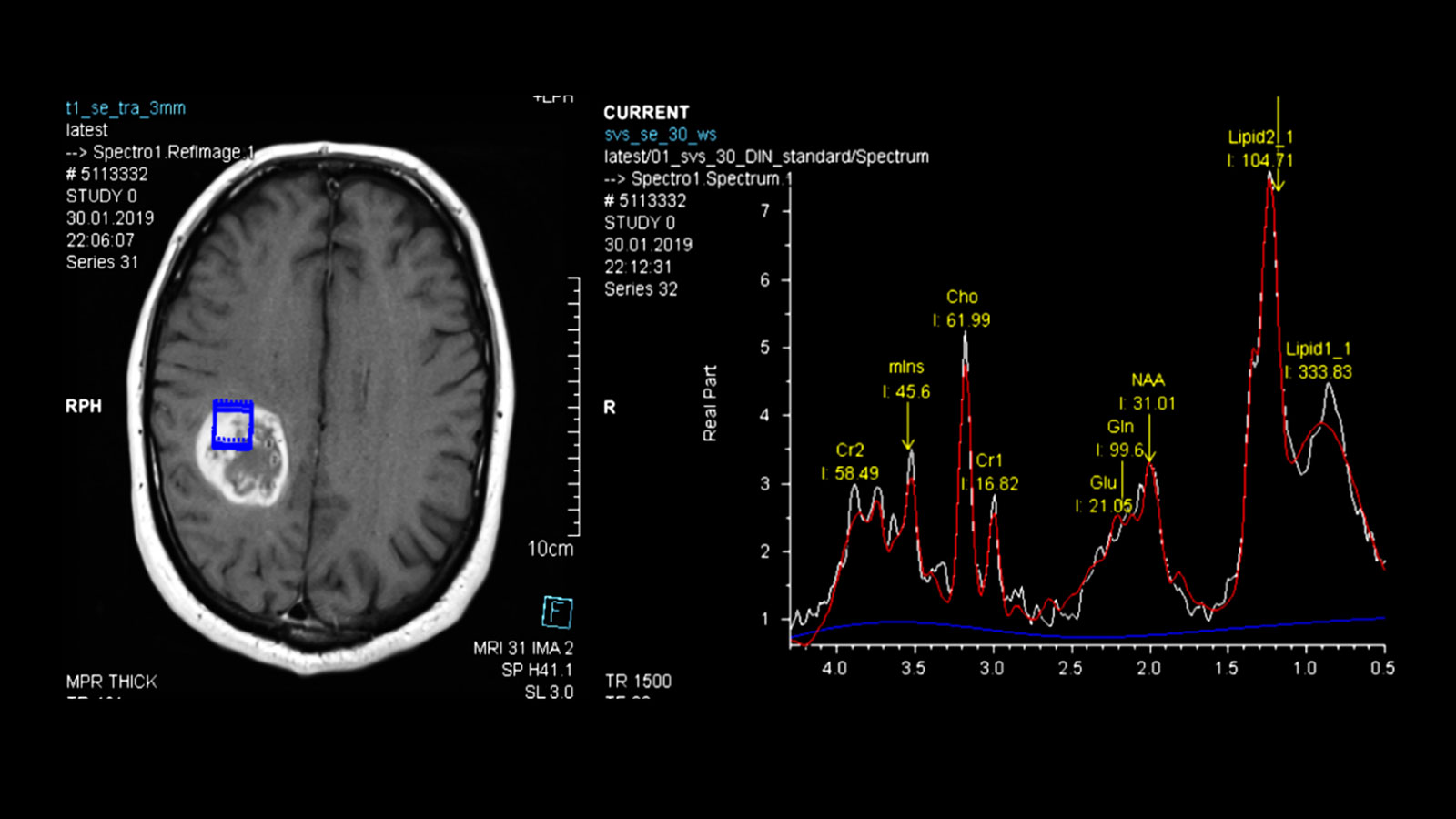
Dazu zählen unter anderem eine Methode zur Messung des lokalen Blutflusses (Perfusion), da das Blutvolumen im Bereich des Tumors erhöht ist, sowie eine Messung der lokalen Stoffwechselprodukte (Metabolite) mittels der Magnetresonanzspektroskopie (MR-Spektroskopie oder MRS), da auch bestimmte Stoffwechselprodukte in Gliomen erhöht bzw. verringert sind.
Die Ergebnisse der Messungen können insbesondere bei der Unterscheidung von Glioblastomen und anderen Tumoren wie Metastasen oder Lymphomen hilfreich sein.
Wie wird ein Glioblastom behandelt?
Operation – der erste Schritt der Therapie
Bei Glioblastomen besteht die Standardtherapie aus einer Kombination von mikrochirurgischer Resektion, Bestrahlung und Chemotherapie.
Die chirurgische Resektion ist heute fester Bestandteil des Behandlungskonzepts *, *, *, *, *, *, *. Je mehr Tumormasse entfernt werden kann, um so günstiger der weitere Krankheitsverlauf *, *, *, *, *, *, *, *, *. Deshalb ist eine komplette Tumorresektion, die durch ein MRI-Bild bestätigt wird, das Ziel der Operation. Des Weiteren lindert die Entfernung des Tumors den Effekt, den die Masse auf das umliegende Hirngewebe ausübt, und somit auch die Symptome, die der Tumor verursacht. Das entnommene Tumorgewebe kann dann anschliessend feingeweblich und molekularbiologisch untersucht werden.
Da Glioblastome das Hirngewebe jedoch diffus infiltrieren und entlang der Faserbahnen der weissen Substanz einwachsen, bleiben auch nach einer kompletten Resektion Tumorzellen zurück. Diese müssen durch eine nachfolgende Bestrahlungs- und Chemotherapie zerstört werden.
Warum ist beim Glioblastom eine radikale Operation anzustreben?
Nach der aktuellen Studienlage geht man davon aus, dass mindestens 80 % des Tumors entfernt werden müssen bzw. weniger als 5 cm3 Tumorrest zurückbleiben dürfen, damit der Patient durch die Operation einen Überlebensvorteil hat.
Ein deutlicher Überlebensvorteil lässt sich erst durch eine im MRI überprüfte komplette Entfernung des Tumors erzielen *, *.
Daher sollte das primäre Ziel der Operation die komplette Entfernung des Hirntumors sein, idealerweise inklusive der im MRI-Bild sichtbaren Infiltrationszone, und dies, ohne dauerhafte neurologische Schäden zu verursachen.
Operation mit Marge: die supramarginale Resektion
Glioblastome haben Tumorzellen, die über den im MRI sichtbaren Rand hinausgehen. Diese Infiltrationszone rund um den Tumor weist ein anderes biologisches Profil als der Tumorkern selbst auf * und hat möglicherweise einen Einfluss auf die Prognose der Therapie *. Die den Tumor umgebende Infiltrationszone nimmt kein Kontrastmittel auf und ist radiologisch schwer abzugrenzen. Eine reine Fokussierung auf den radiologisch leicht abgrenzbaren Tumoranteil ist aber aus onkologischer Sicht nicht optimal.
Mit einer ausgedehnteren Resektion bis hin an funktionelle Grenzen lässt sich eine weitere Reduktion der Tumorlast erreichen. Man bezeichnet dies als supratotale oder supramarginale Resektion *, *, *. Diese supratotalen Resektionen sind heutzutage für ausgewählte Patienten ein fester Bestandteil des Behandlungskonzepts.
Aus der Tumorchirurgie ist bekannt, dass grosse Teile von «funktionell stillen», sogenannten nicht-eloquenten Hirnarealen entfernt werden können, ohne dass dabei permanente Defizite beim Patienten auftreten *. Eine supramarginale Resektion sollte jedoch immer gleichzeitig mit neurophysiologischem Monitoring und Mapping durchgeführt werden, um bleibende neurologische Schäden zu vermeiden.
Wie rasch sollte operiert werden?
Aufgrund des schnellen Wachstums von Glioblastomen sollte die Operation zeitnah erfolgen. Je mehr Zeit vergeht, umso mehr Tumorzellen wandern in die Umgebung ab. Der Tumor dehnt sich aus und wird grösser, das Operationsrisiko nimmt zu und die mögliche Radikalität der Resektion ab. Die Operation sollte deshalb idealerweise innerhalb von 1–2 Wochen nach Diagnosestellung erfolgen.
Unser OPTIMISST-Protokoll
Es gibt eine Reihe von Faktoren, die dazu beitragen, dass eine Tumorbehandlung erfolgreicher ist. Wir haben auf Grundlage dieser Faktoren ein eigenes Behandlungskonzept entwickelt, das sogenannte OPTIMISST-Protokoll. OPTIMISST steht dabei für «Optimized Standard and Supportive Therapy» und ergänzt die klassische Therapie bei Hirntumoren. Dieses Protokoll gibt es in dieser Form nur an unserer Klinik.
Vor der Operation
Magnetresonanztomografie
Für eine optimale Vorbereitung wird zunächst ein spezielles MRI durchgeführt. So kann der Tumor möglichst genau beurteilt und die Operation präzise geplant werden. Je nach Lokalisation des Tumors sind unter Umständen weitere Untersuchungen erforderlich.
Ein funktionelles MRI (fMRI) kann wertvolle Informationen zur Lokalisation der Sprachfunktion und der Bewegungszentren beitragen.
Navigierte transkranielle Magnetstimulation
Für die genaue Lokalisation der Bewegungszentren wird oft eine navigierte transkranielle Magnetstimulation (nTMS) durchgeführt. Es handelt sich um eine nicht-invasive Untersuchung, welche von den meisten Patienten problemlos toleriert wird und die am Inselspital im Rahmen einer multizentrischen Studie angeboten wird. Die so erhobenen Daten helfen dem Chirurgen bei der Planung des operativen Zugangs und beim Festlegen der operativen Strategie.
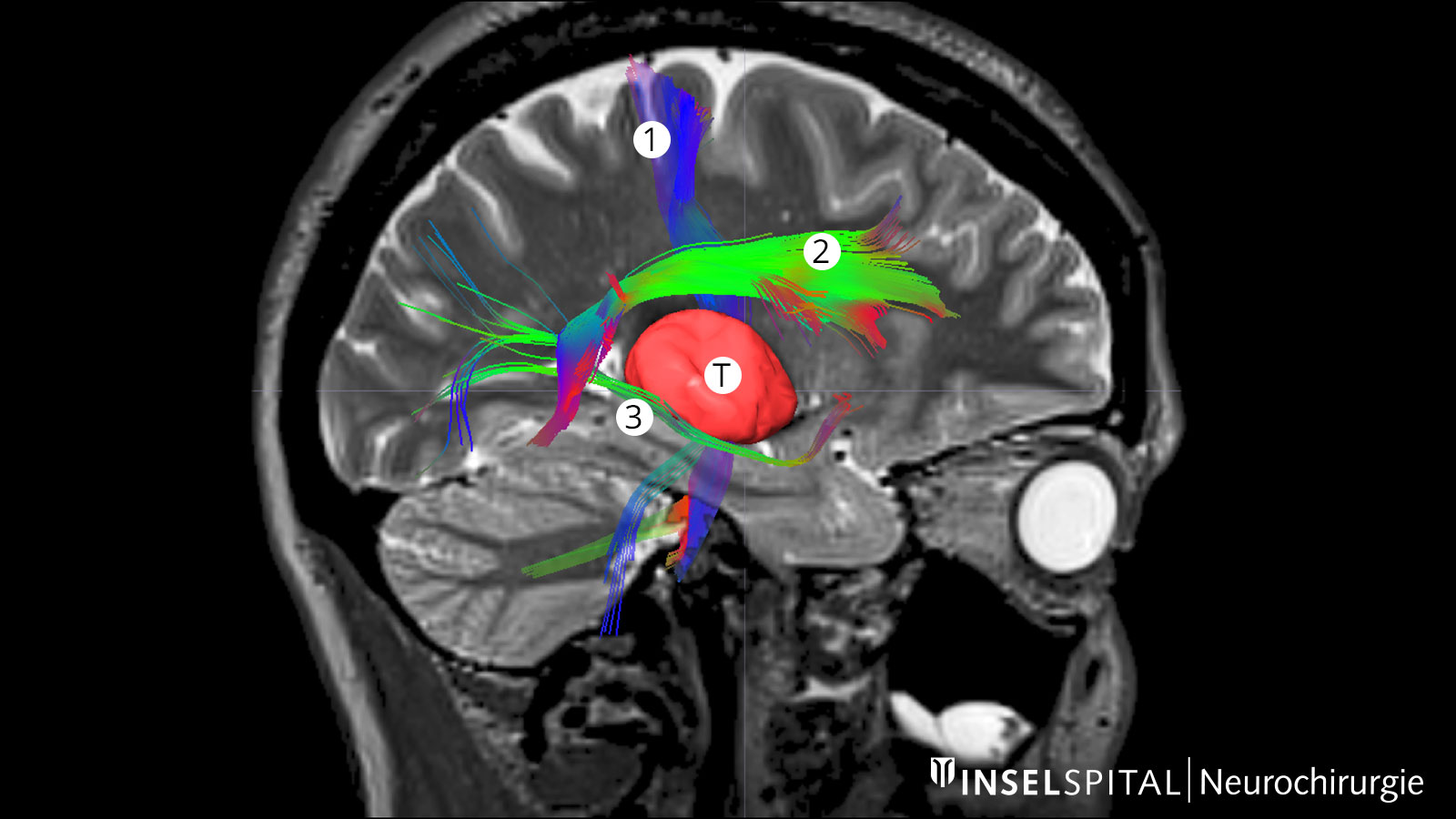
Fiber Tracking: Darstellung der Hirnfaserbahnen
Als Traktografie oder Fiber Tracking werden Verfahren bezeichnet, mit denen die Faserbahnen im Gehirn visualisiert werden können. Die Darstellung dieser Bahnen vor der Operation hilft dem Chirurgen, den optimalen und sichersten Weg zum Tumor vorbei an allen wichtigen Faserbahnen zu finden.
Äusserst wichtig ist dies für die Pyramidenbahn. Sie stellt die direkte Verbindung zwischen dem motorischen Zentrum des Gehirns und des Rückenmarks dar und muss bei einer Operation unbedingt geschont werden. Weitere wichtige Faserbahnen betreffen vor allem Hirnfunktionen wie Sprechen und Sehen.
Sollte vor der OP eine Biopsie durchgeführt werden?
Kann der Tumor gut reseziert werden, führen wir im Vorfeld keine separate Biopsie durch. Falls aufgrund der Lage des Tumors in einem funktionell wichtigen Zentrum oder aufgrund der diffusen Ausdehnung eine Resektion nicht möglich ist, sollte zumindest eine Biopsie zur Gewebeuntersuchung und Diagnosesicherung durchgeführt werden. Das Komplikationsrisiko einer Biopsie ist niedrig, bedrohliche Blutungen treten nur in ca. 1 % der Fälle auf.
Ein häufigeres Problem ist jedoch die falsche Gradierung der Tumoren in bis zu 25 % der Fälle *: Da ein Gliom häufig heterogen aus verschiedenen Zellanteilen zusammengesetzt ist, kann es passieren, dass in der Biopsie Zellen aus einem weniger bösartigen Anteil entnommen werden und fälschlicherweise ein niedriggradiges Gliom diagnostiziert wird, obwohl es sich in Wirklichkeit um ein höhergradiges, aggressives Gliom handelt.
Um die Rate an Fehldiagnosen zu mindern, planen wir Biopsien routinemässig mit Hilfe von
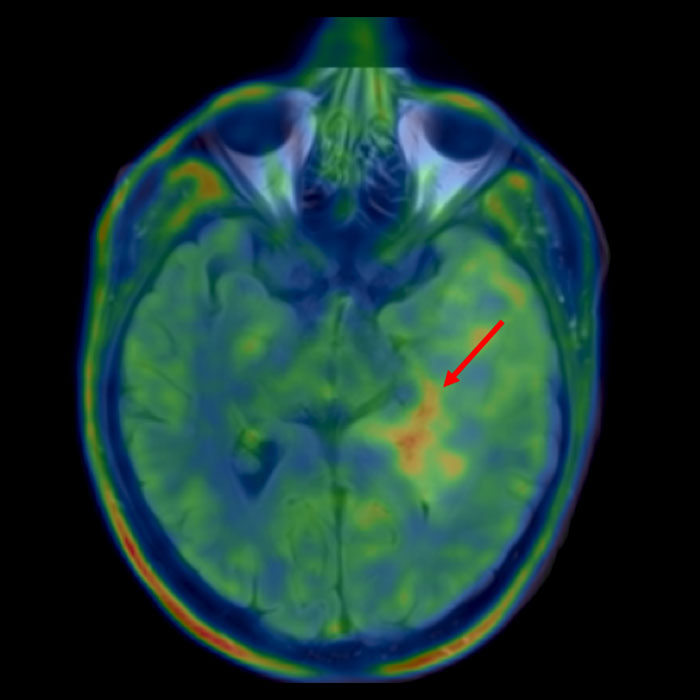
- Methoden des Advanced Neuroimaging wie die Magnetresonanzspektroskopie (MR-Spektroskopie oder MRS) oder
- nuklearmedizinischen Methoden wie FET-PET. PET (kurz für Positronen-Emissions-Tomografie) ist eine bildgebende Methode, welche durch Verabreichung eines «intelligenten» Moleküls, in der Regel wird bei uns Fluorethyltyrosin (FET) verwendet, die Hervorhebung besonders aktiver Tumoranteile erlaubt. FET ist eine markierte Aminosäure und zeigt den erhöhten Aminosäurenstoffwechsel in Tumorzellen an. Dieser kann mit einer Kamera registriert werden. Mit Hilfe dieser Methode kann durch Überlagerung der PET-Daten mit den MRI-Daten oft ein Hotspot mit besonders aktiven Tumorzellen identifiziert werden. Dieser Hotspot stellt ein gutes Ziel für eine Biopsie dar.
Während der Operation
Die Operationssicherheit wird durch verschiedene innovative Techniken gewährleistet. Dank präziser chirurgischer Verfahren und ausgedehntem intraoperativen Monitoring ist die Komplikationsrate von Tumorresektionen heutzutage sehr niedrig *, *, *, *, *, *, *, *.
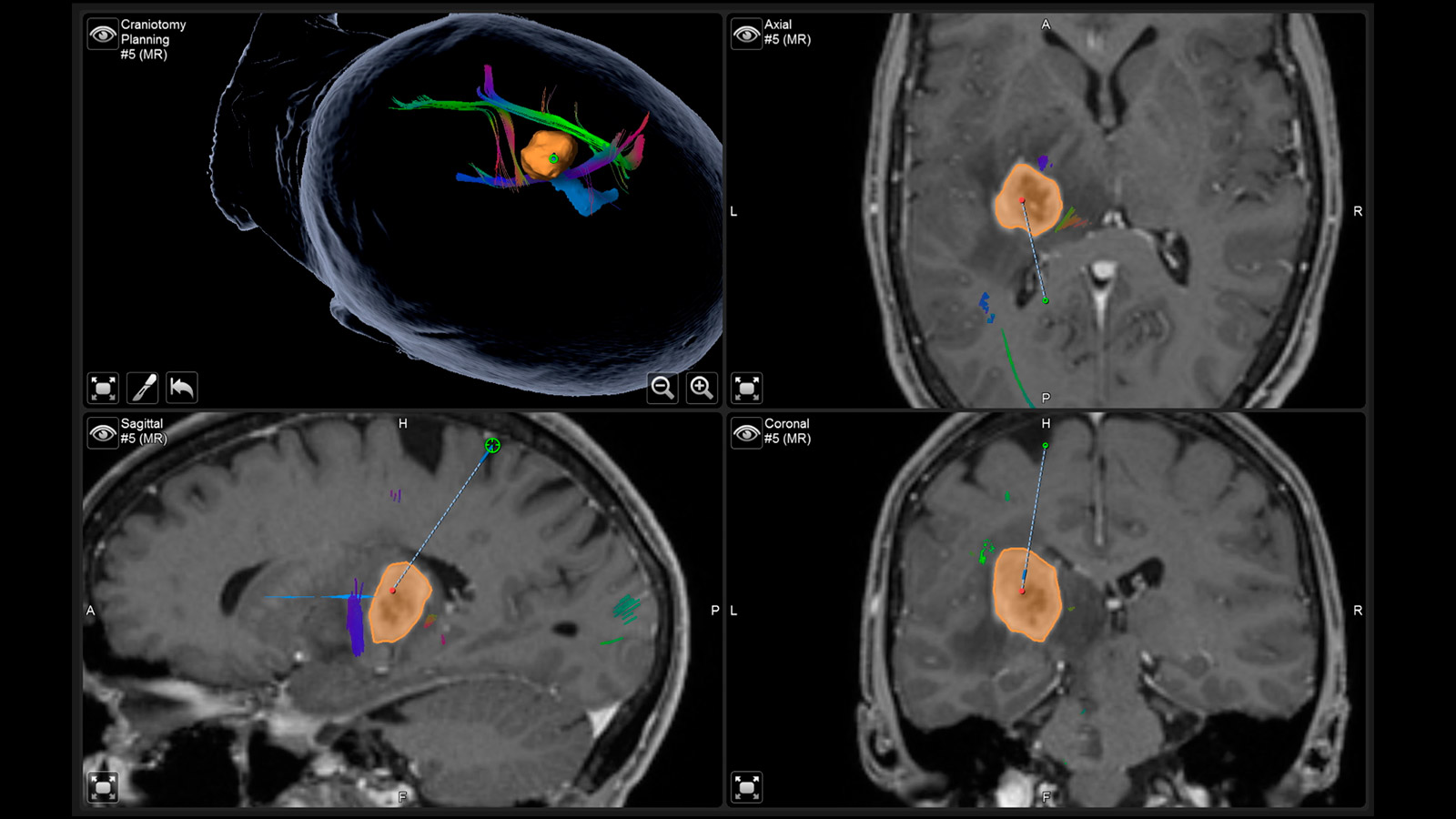
Neuronavigation
Die Neuronavigation funktioniert wie ein «GPS» während der Operation und weist dem Neurochirurgen den Weg, wobei das vor der OP durchgeführte MRI das individuelle «Kartenmaterial» liefert.
Augmented Reality
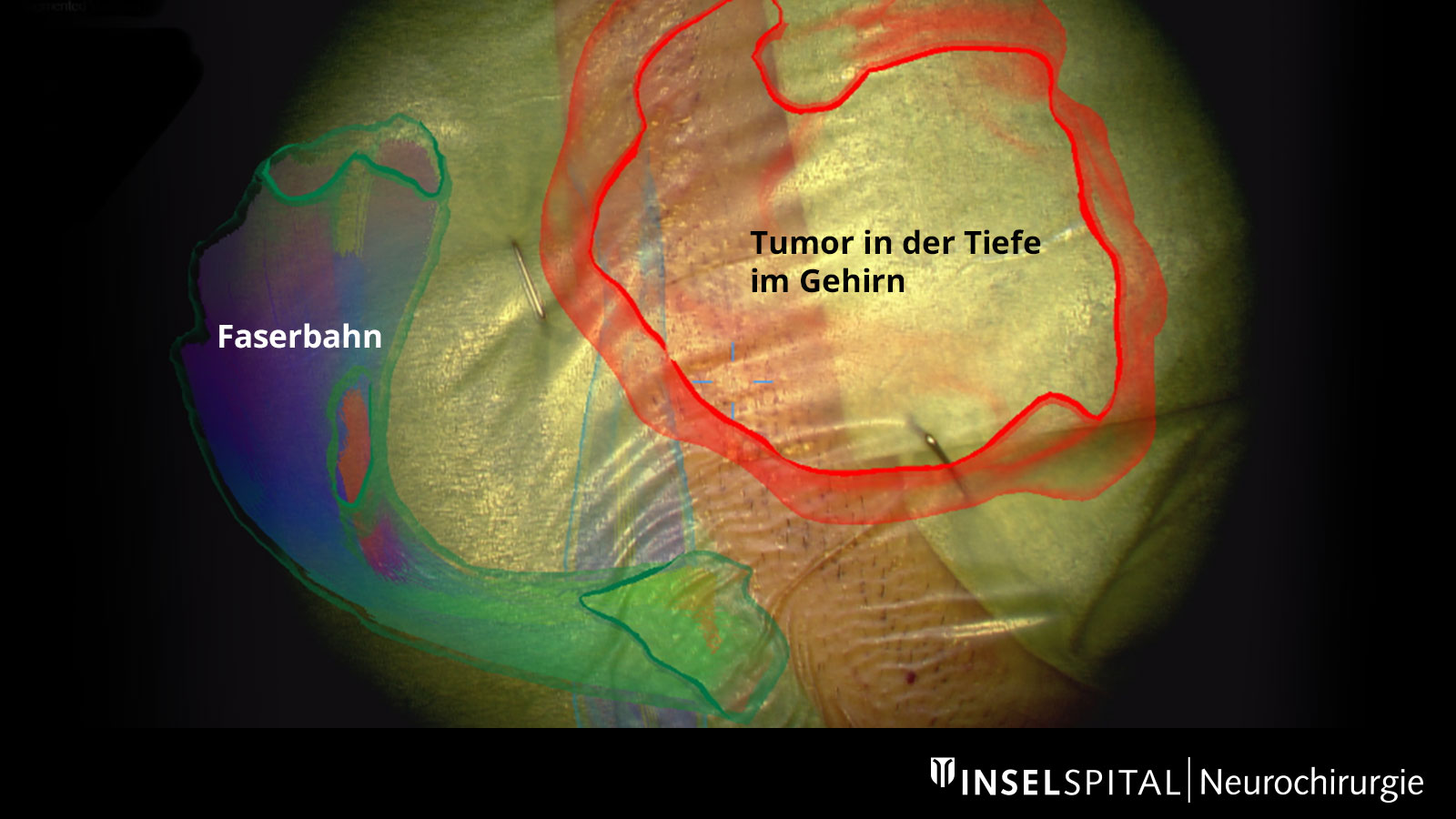
Die bereits vor der Operation eingezeichneten Faserbahnen, ebenso wie der Tumor selbst und weitere wichtige Zentren lassen sich im Operationsmikroskop virtuell einblenden und auf die Kopfoberfläche projizieren. Mit Hilfe dieser Augmented Reality kann sich der Chirurg besser orientieren und den Zugang zum Tumor so klein wie möglich, aber so gross wie nötig planen.
Intraoperatives Neuromonitoring (IOM)
Die Vorteile der radikalen Operation beim Glioblastom gelten nur, wenn dauerhafte Lähmungen, Sprachstörungen oder andere schwere Schäden vermieden werden können. Sonst nimmt die Überlebenszeit wieder ab *. Eine spezialisierte Funktionsüberwachung – das intraoperative Neuromonitoring (IOM) – soll operationsbedingte Schäden verhindern und ist in vielen Fällen das wichtigste OP-Instrument und ein Spezialgebiet unserer Klinik.
Die Art der Überwachung wird für jeden Patienten individuell unter Berücksichtigung der benachbarten Hirnfunktionen festgelegt. In der Regel reicht uns eine Distanz von ca. 3 mm Abstand zu einem wichtigen Hirnareal aus, um den Tumor ohne dauerhafte neurologische Defizite zu entfernen. Folgende Verfahren werden dabei grundsätzlich genutzt:
- Monitoring: eine elektrische Überwachungsfrequenz zum Testen der Funktionen der gesamten Hirn- und Nervenleitungsstrecke
- dynamisches Mapping: ein Radar auf der Basis von kontinuierlichen Mikroströmen zur Bestimmung des Abstands zum Hirnzentrum oder der Hirnbahn
- eine kurzzeitige Stimulation mit «Störstrom» bei Wachoperationen
Monitoring
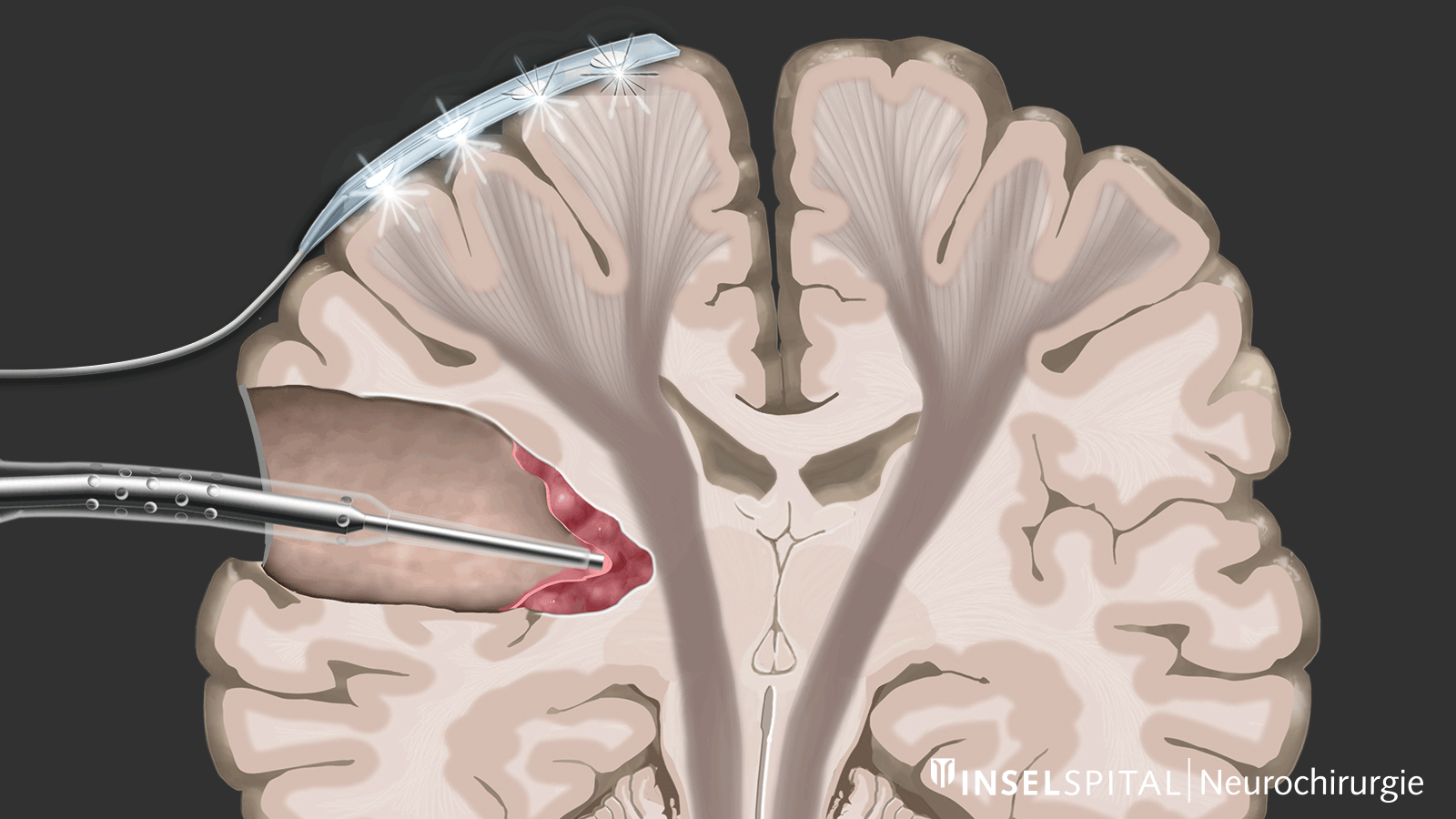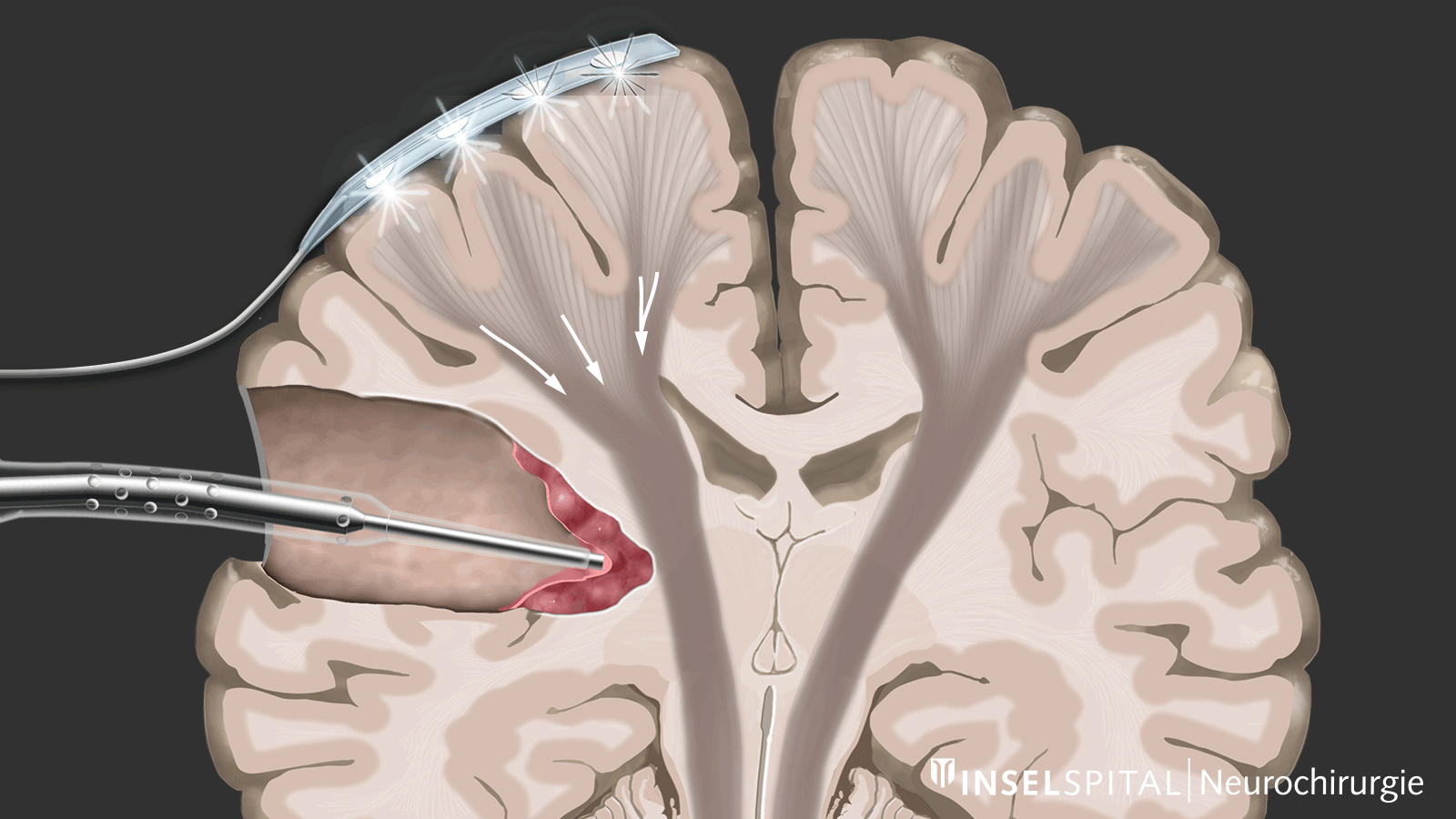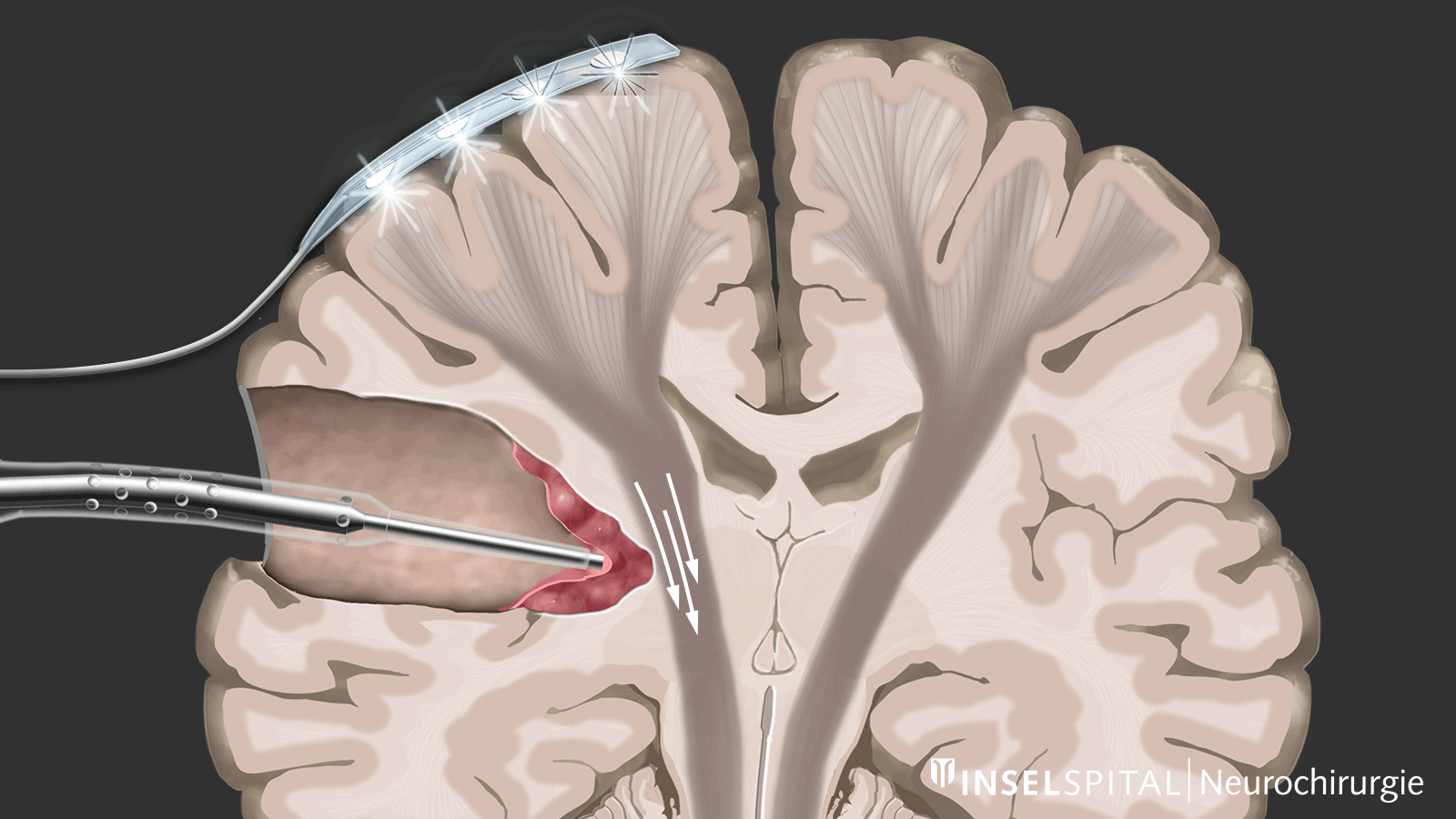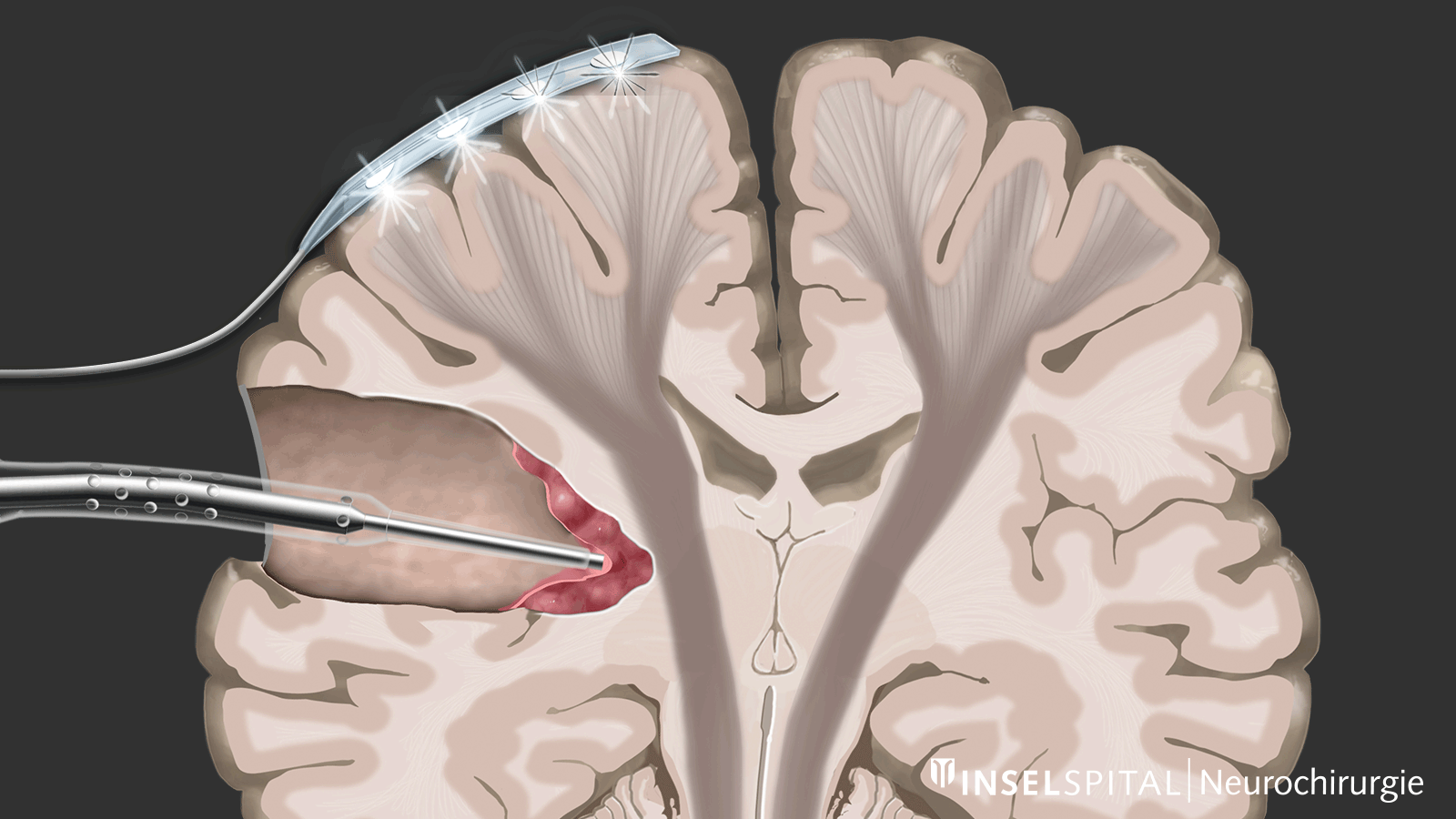
Beim Monitoring handelt es sich um eine Überwachungsmethode. Über eine Überwachungselektrode, die auf dem Bewegungszentrum platziert wird, wird kontinuierlich ein elektrischer Impuls gesetzt. Dieser löst einen einzelnen Bewegungsimpuls aus, der im Ziel-Muskel empfangen wird. Auslösen des Impulses im Gehirn und Empfangen im Zielmuskel signalisieren eine intakte und funktionierende Bewegungsbahn.
Dynamisches Mapping
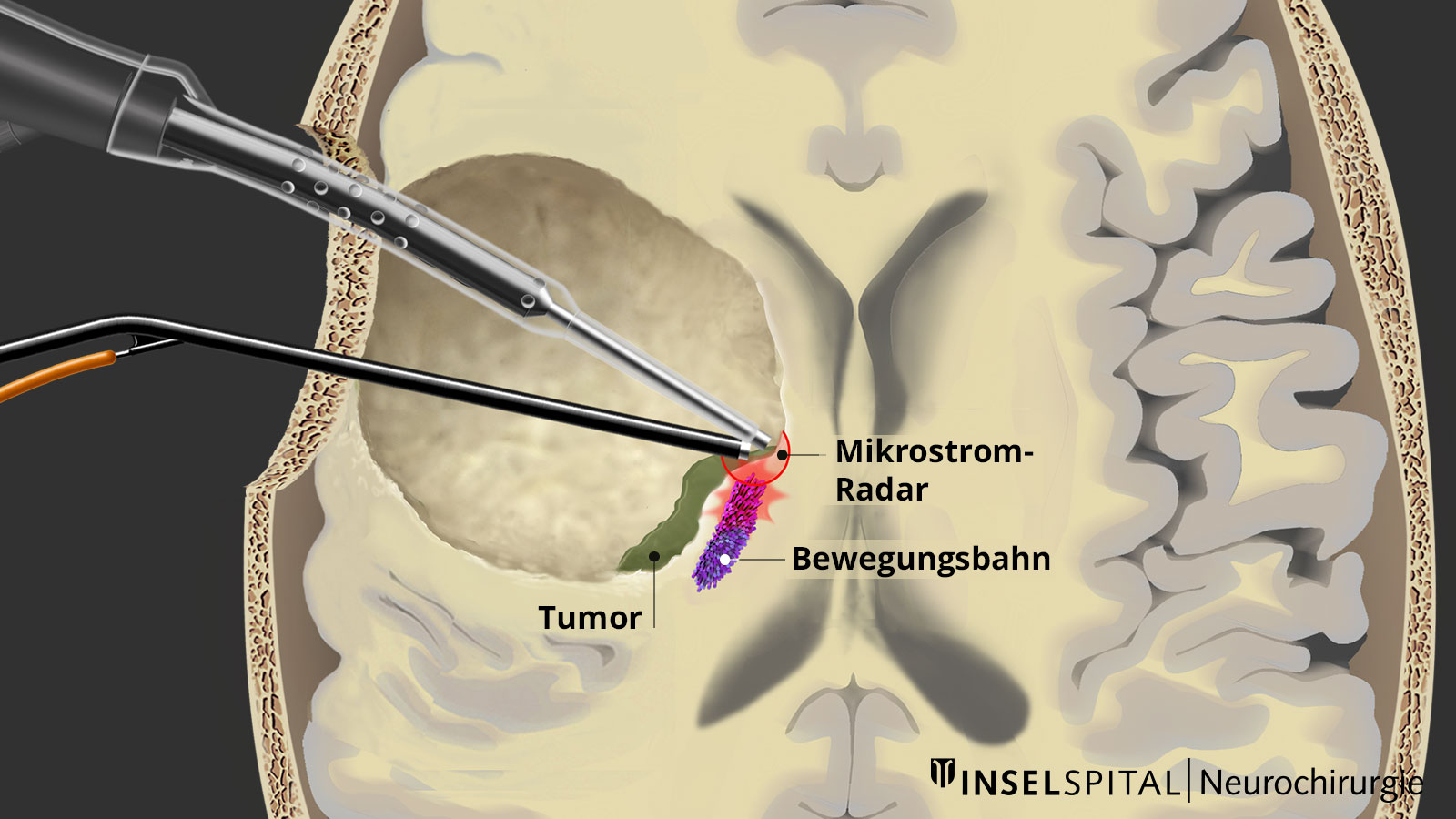
Beim Mapping handelt es sich um eine Lokalisationsmethode, bei der der zu schützende Funktionsort unbekannt ist. Wir haben am Inselspital dafür das kontinuierliche dynamische Mapping, bei der die Stimulation mit Mikroströmen in das chirurgische Sauginstrument integriert ist. Während jedes Schritts der Tumorentfernung wird der Sicherheitsabstand zur Bewegungsbahn registriert, ähnlich wie bei einem Radar. Mittlerweile wird dieses Verfahren in mehr als 50 Ländern weltweit eingesetzt.
Wachoperation
Im Gegensatz zur Motorik können komplexe Funktionen wie Sprache, Sprachverständnis, Rechnen, Musizieren oder Lesen beim Patienten in Narkose nicht überwacht werden. Befindet sich der Tumor in der Nähe dieser Zentren ist es notwendig, dass der Patient während eines Teils der Operation wach ist und gemeinsam mit einem Neuropsychologen spezielle Tests durchführt. Der Tumor wird entfernt, während eine Mikrosonde das umgebende Hirngewebe mit gepulsten Mikroströmen ungefähr 5 mm tief durchdringt und stimuliert. Wenn eine wichtige Funktion in der Nähe liegt, so trifft der Strom auf das Zentrum und der Patient macht Fehler bei seinen Aufgaben. Die Lage einer unsichtbaren Funktion kann so lokalisiert und bei der Operation geschont werden.
5-ALA-Fluoreszenz
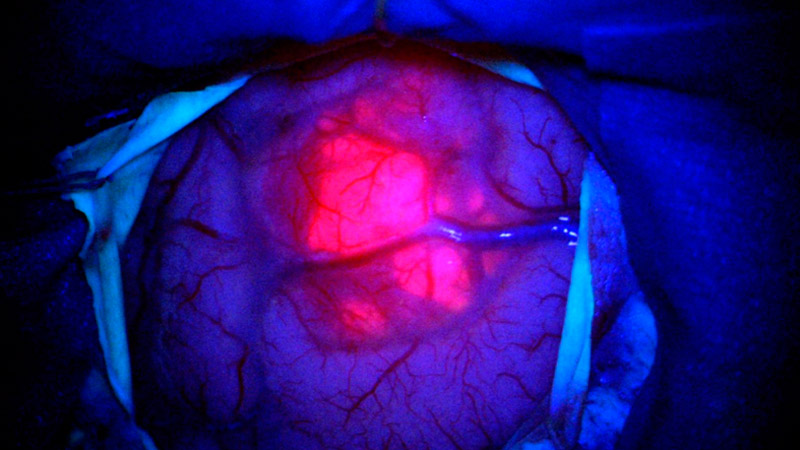
Ein wichtiger Baustein in der modernen Tumorchirurgie ist der routinemässige Einsatz von 5-ALA (Gliolan®) *. 5-ALA wird den Patienten einige Stunden vor der Operation als Flüssigkeit verabreicht. Es entsteht ein Stoffwechselprodukt, welches sich in Tumorzellen von höhergradigen Gliomen anreichert und fluoreszierende Eigenschaften aufweist *, *, *. Bei der Operation unter Blaulicht kann der Chirurg den Tumor als rötlich fluoreszierende Struktur erkennen und das kranke Gewebe gezielter entfernen *, *, *. Gesundes Hirngewebe zeigt keine Fluoreszenz.
Aus einer eigenen Studie zur fluoreszenzgestützten Resektion von Glioblastomen wissen wir, dass die Tumorränder bei Einsatz von 5-ALA während der OP um mehr als 0,5 cm über das Tumorvolumen hinausgehen, das Kontrastmittel aufnimmt und im MRI-Bild sichtbar ist *.
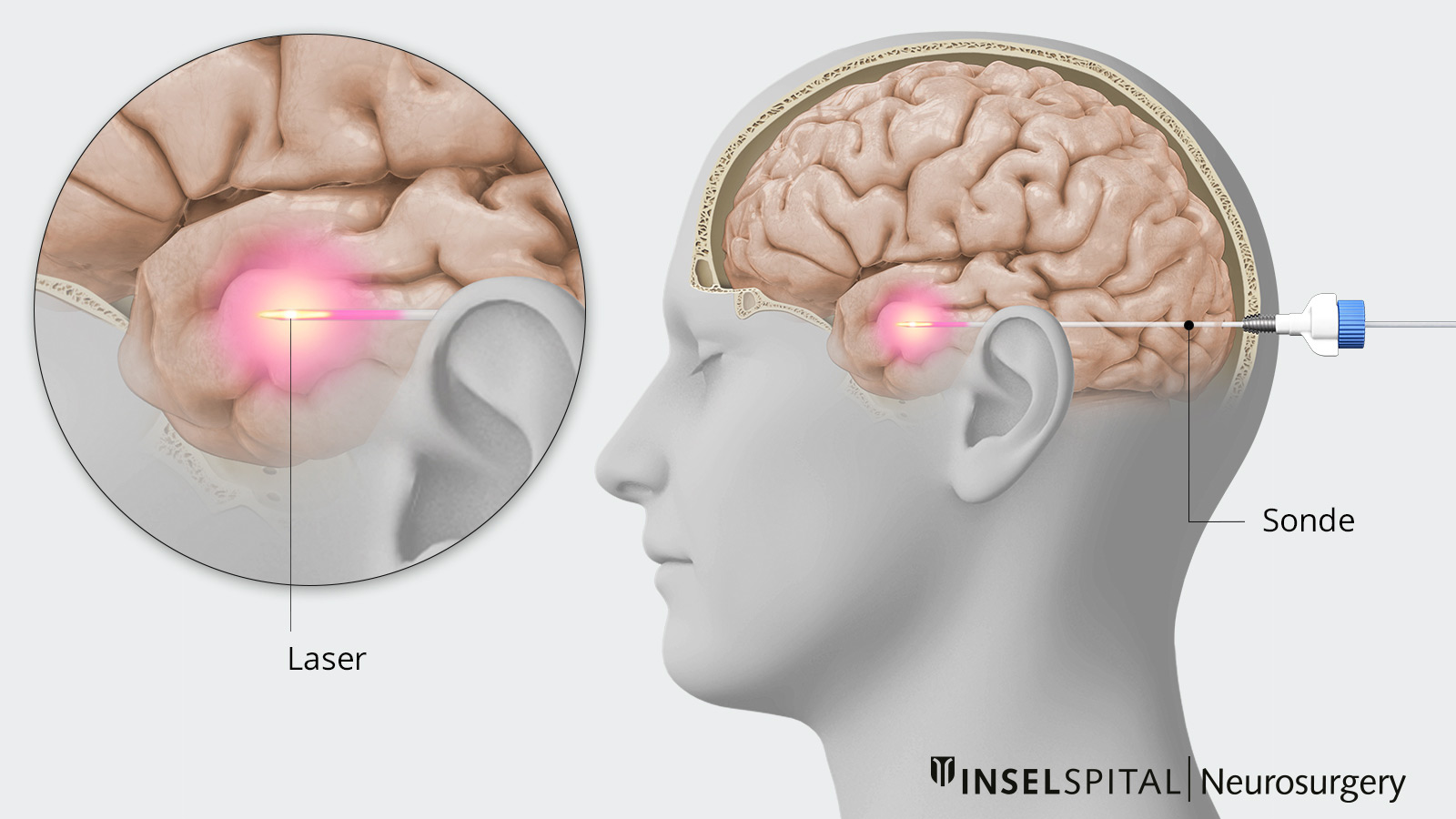
Laserinduzierte Thermotherapie (LITT)
Die laserinduzierte Thermotherapie (auch interstitielle Laserthermotherapie oder kurz LITT) ist ein minimal-invasives, bildgestütztes Verfahren. Dabei wird mithilfe von Laserenergie gezielt Gewebe erhitzt und zerstört. LITT wird vor allem zur Behandlung von Epilepsieherden, Hirntumoren oder anderen tief gelegenen Veränderungen im Gehirn eingesetzt.
Intraoperative Bildgebung
Da die Unterscheidung zwischen gesundem Gewebe und Tumorgewebe selbst unter dem Mikroskop schwierig ist, kommen verschiedene bildgebende Modalitäten noch während der Operation zum Einsatz, um direkt das Resektionsausmass zu überprüfen.
Ultraschall wird routinemässig eingesetzt, hat aber seine Grenzen bei der Darstellung von Resttumorgewebe.
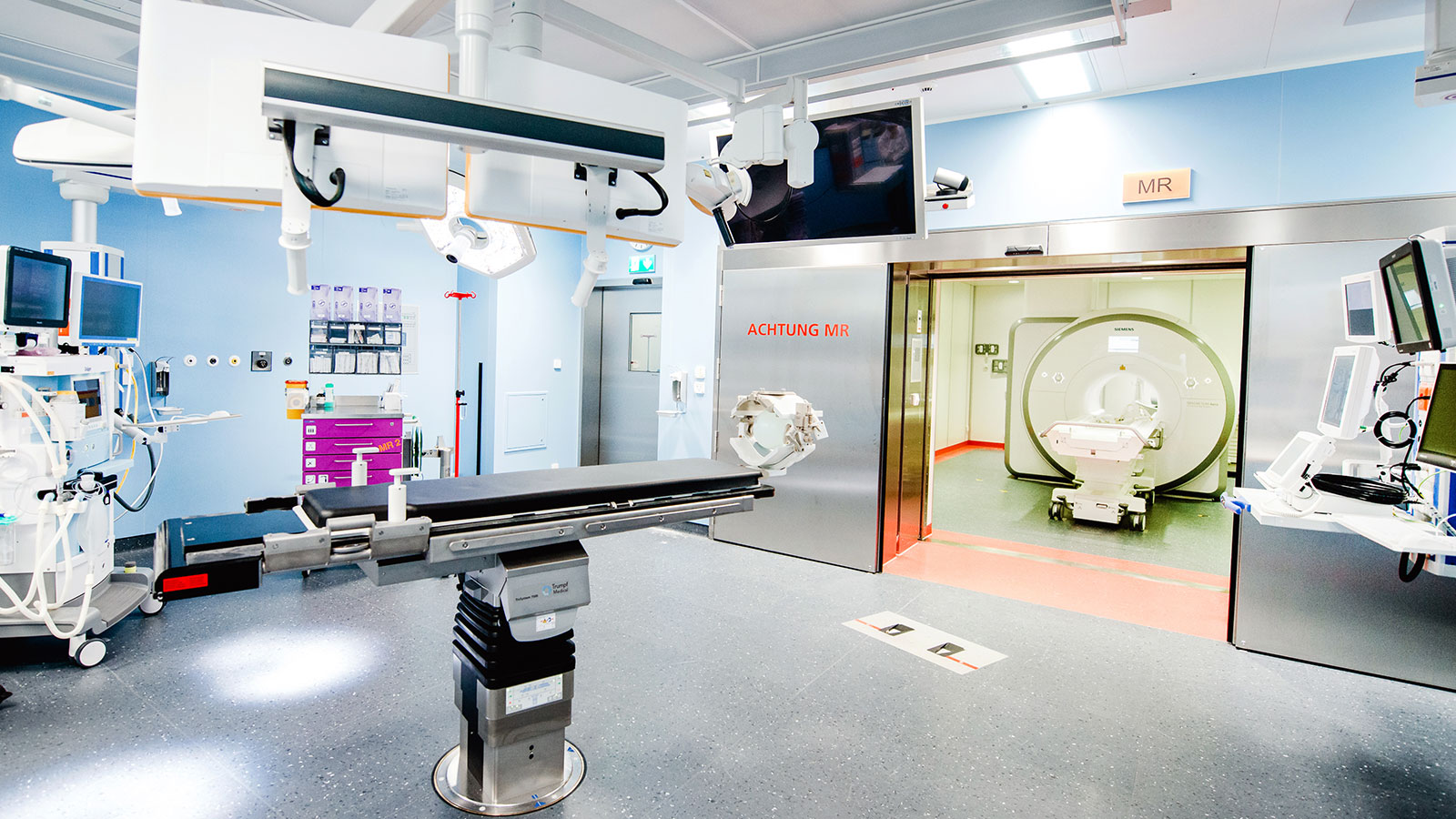
Die genaueste Methode ist die Überprüfung im intraoperativen MRI. Hierzu wird der Patient nach Entfernung des Tumors noch während der Operation ins MRI transferiert. So kann ein Tumorrest, falls vorhanden, noch in der laufenden Operation entfernt werden. Hierzu wurde am Inselspital ein Operationssaal mit direkter Anbindung an ein Hochfeld-MRI-Gerät gebaut.
Nach der Operation
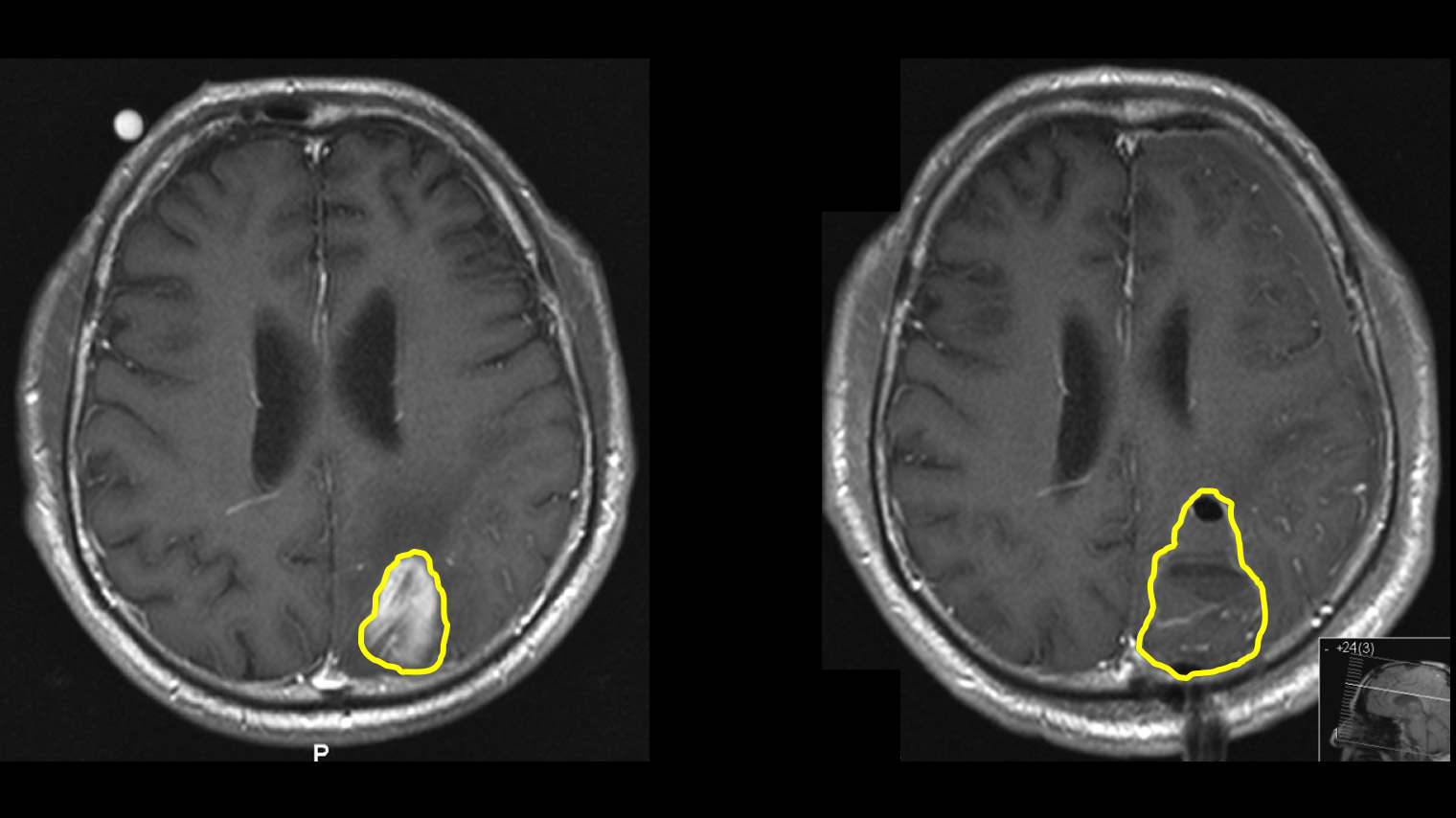
MRI-Untersuchung 24–48 Stunden nach OP
Der Verbleib von Tumorresten nach der Operation ist möglich, weil der Tumor im Randbereich oft wie normales Gehirngewebe aussieht und man in der Gehirnchirurgie nicht immer mit einem zentimeterbreiten Sicherheitsabstand um den Tumor herum operieren kann.
Wenn ein frühes Kontroll-MRI 24–48 Stunden nach dem Eingriff zeigt, dass noch ein winziger Tumorrest sichtbar ist, sollte dieser in einer zweiten Operation unmittelbar am nächsten Tag entfernt werden, vorausgesetzt dies ist aufgrund der Lage möglich. Unsere Erfahrungen zeigen, dass trotz des Einsatzes aller technischen Hilfsmittel bei 5–10 % der Patienten entfernbares Resttumorgewebe zurückbleibt und eine zweite Operation sinnvoll ist *. Wir konnten in einer Studie bei eigenen Patienten zeigen, dass die zweite Operation fast immer zur vollständigen Entfernung führt, gut toleriert wird und nur ein minimales Risiko für den Patienten bedeutet *. Der Aufenthalt im Spital verlängert sich dadurch lediglich um ca. 2 Tage.
Histologie
Nach der feingeweblichen (histologischen) Untersuchung des entfernten Gewebes wird das weitere Vorgehen von einem interdisziplinären Team von Spezialisten bestehend aus Neurochirurgen, Radioonkologen und medizinischen Onkologen besprochen. Dies geschieht im Rahmen unserer wöchentlichen interdisziplinären Tumorkonferenz, an der regelmässig auch international renommierte neuroonkologische Experten per Videokonferenz teilnehmen.
Neurologische Rehabilitation
Eine neurologische Rehabilitation ist in Fällen mit neurologischen Ausfällen sinnvoll, sollte jedoch die Anschlussbehandlung nicht verzögern. Patienten ohne neurologische Defizite benötigen in der Regel keine stationäre Rehabilitation.
Strahlen- und Chemotherapie – der nächste Schritt der Therapie
Die Standardbehandlung nach der Operation für Patienten in einem guten Allgemeinzustand besteht aus einer Kombination aus Chemotherapie und Bestrahlung. Mit der Bestrahlungs- und Chemotherapie wird in der Regel 3–4 Wochen nach Operation begonnen, damit die Wunde ausreichend Zeit hat zu heilen *, *.
Bei der Strahlentherapie wird die Bestrahlung in insgesamt 30 Sitzungen über 6 Wochen hinweg durchgeführt. In der Regel erfolgen 5 Sitzungen pro Woche mit einer Dosis von je 2 Gy bis zu einer Gesamtdosis von 60 Gy.
Die häufigsten Nebenwirkungen bei Bestrahlung sind
- Müdigkeit
- Übelkeit
- Hautreizungen
- Haarverlust
Parallel zu den Bestrahlungen wird eine tägliche Chemotherapie durchgeführt. Nach 30 Sitzungen ist die mögliche Maximaldosis der Bestrahlung erreicht. Die Chemotherapie wird dann als Erhaltungstherapie fortgesetzt. Das bedeutet, dass alle 4 Wochen ein Zyklus von 5 Tagen erfolgt – insgesamt 6 Zyklen.
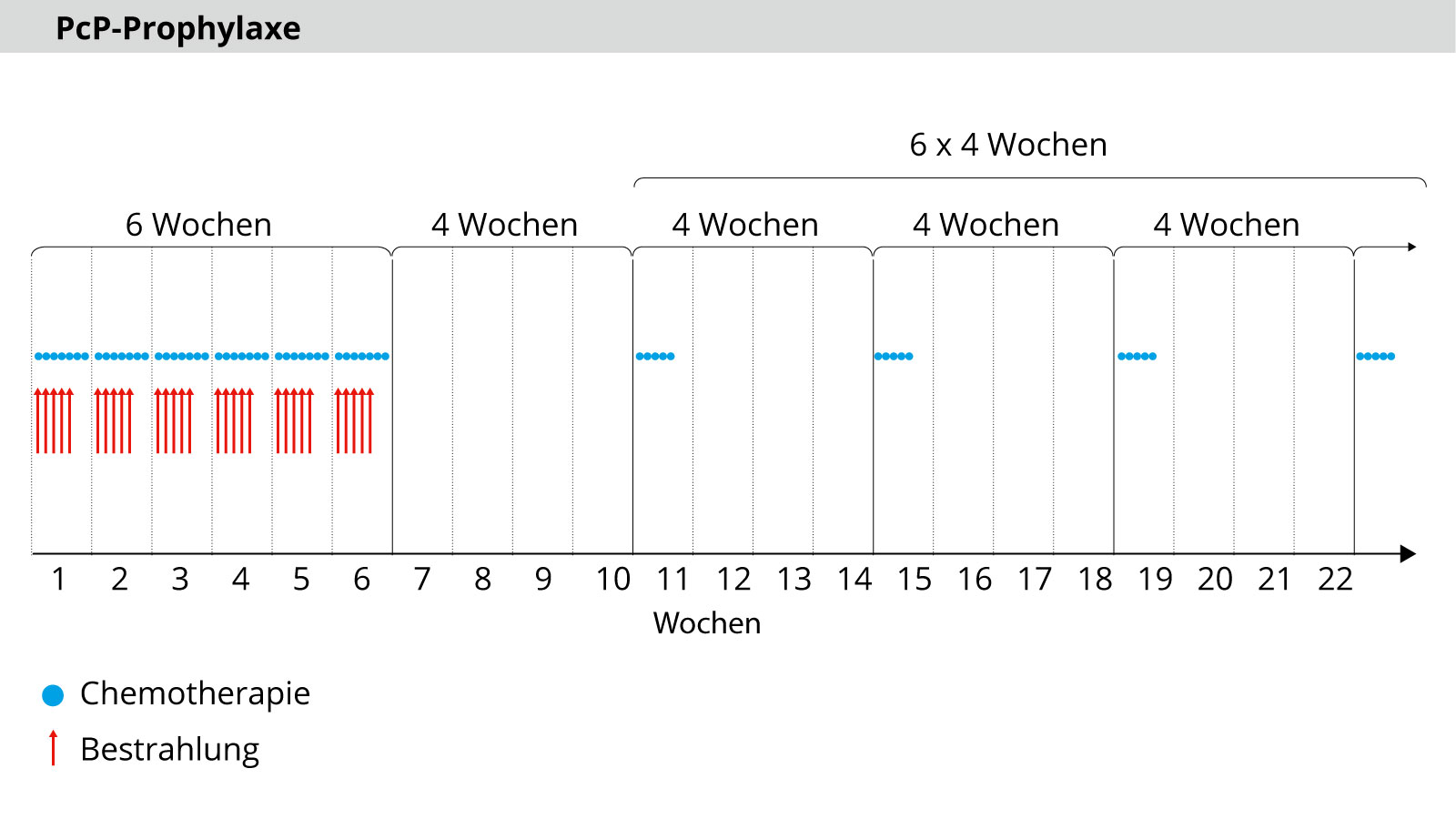
Ältere Patienten
Ein Spezialfall in der Behandlung stellen ältere Patienten (über 70 Jahre) dar. Um ältere Patienten durch die Therapie nicht zu stark zu belasten, werden sie nach einem verkürzten Schema behandelt. Die Bestrahlung wird dann meist in 15 Sitzungen bis zu einer Gesamtdosis von 40 Gy durchgeführt *.
Alternativ kann bei Patienten mit schlechterem Allgemeinzustand auch entweder nur eine Bestrahlung oder nur eine Chemotherapie erfolgen – abhängig von der DNA des Tumors *.
Chemotherapeutika
Temodal
Als Chemotherapeutikum kommt Temozolomid (Temodal®) zur Anwendung. In der grossen EORCT-NCIC-Studie konnte die Wirksamkeit der Chemotherapie zusätzlich zur Bestrahlung belegt werden *, *. Auch die Langzeitergebnisse der genannten Studie bestätigen das *. Insbesondere Patienten mit MGMT-Promotor-Methylierung, bei denen die Tumorzellen ihre DNA-Schäden nicht mehr reparieren können, profitieren von einer zusätzlichen Chemotherapie.
Im Allgemeinen wird die Therapie mit Temodal gut toleriert. Die häufigste Nebenwirkung ist eine leichte Übelkeit. Eine seltene, aber schwere Nebenwirkung ist die Knochenmarkssuppression.
Nach 6 Behandlungszyklen mit Temodal tritt der Patient in die Beobachtungsphase über mit Kontroll-MRI alle 3 Monate.
Mehrere Versuche mit darüberhinausgehenden, längeren, intensivierten oder zusätzlichen Temodalgaben zeigten nicht die erwarteten besseren Ergebnisse *, *, *, *.
Lomustin
Noch unklar ist aktuell, ob Patienten mit MGMT-Promotor-Hypermethylierung von einer Zugabe des Medikaments Lomustin zusätzlich zur Bestrahlung und Temodaltherapie profitieren. In der 2019 publizierten NOA-09-Studie konnte ein Überlebensvorteil für die Kombinationsbehandlung gefunden werden, aufgrund der geringen Anzahl Patienten sind diese Ergebnisse jedoch noch nicht konklusiv *.
Wir behandeln Patienten mit klarer MGMT-Methylierung und gutem Allgemeinzustand nach dem Lomustin-/Temodal-Schema.
Immuntherapie
Einen vielversprechenden Therapieansatz stellt die Immuntherapie dar. Durch die Modulation des Immunsystems soll die eigene Immunantwort gegen die Krebszellen gestärkt werden. Unter Immuntherapie im weiteren Sinne werden mehrere Therapieansätze zusammengefasst:
Peptidvakzinierung
Hierbei wird durch eine Art Impfung versucht, das körpereigene Immunsystem für spezifische Oberflächenmoleküle der Glioblastomzellen zu sensibilisieren. Durch die Wiedererkennung dieser Oberflächenmoleküle wird der Angriff des Immunsystems auf die Tumorzellen eingeleitet.
Bisherige grossangelegte Studien, wie beispielsweise mit der EGFR-spezifischen Peptidvakzine Rindopepimut, blieben erfolglos *. Eine aktuelle Studie zu dem Thema ist die NOA-21-Studie, die bei IDH1-mutierten Tumoren die Wirkung einer IDH1-Peptidvakzine alleine oder in Kombination mit einem Immun-Checkpoint-Hemmer untersucht.
Onkolytische Viren
Diese Viren infizieren bevorzugt Tumorzellen. Durch die Infektion mit dem Virus stirbt die Tumorzelle ab oder wird für das Immunsystem angreifbar. Für Glioblastome existieren ermutigende Ergebnisse mit rekombinanten Polioviren (PVSRIPO), Adenoviren (DNX-2401) sowie TOCA 511 *, *, *.
Radioimmuntherapie
Hierbei wird ein strahlendes Radionukleid mit einem gliom-spezifischen Antikörper gekoppelt. Durch den Antikörper bleiben die strahlenden Radionukleide an den Gliomzellen haften und erreichen so eine hohe lokale Dosis. Versuche mit den Isotopen Iod-131 und Yttrium-90 zeigten ermutigende Ergebnisse *. Der Ansatz wird in der aktuellen NOA-22-Studie weiterverfolgt.
Immun-Checkpoint-Hemmer
Dieses Prinzip basiert auf der Hemmung sogenannter Checkpoints des körpereigenen Immunsystems. Diese Checkpoints hemmen normalerweise die Immunantwort und verhindern eine unkontrollierte Aktivierung des Immunsystems. Einige Tumoren können diese Checkpoints gezielt aktivieren und so dem Immunsystem entkommen. Deshalb zielt die Therapie mit Checkpoint-Hemmern auf die Unterdrückung dieser Checkpoints und folglich die Aktivierung des Immunsystems. Der am besten untersuchte Checkpoint ist die Interaktion zwischen PD-1 und PD-1-Ligand. Antikörper gegen PD-1, beispielsweise Nivolumab, Durvalumab oder Avelumab, werden bei verschiedenen Krebsarten erfolgreich eingesetzt und auch beim Glioblastom getestet. Die NOA-21-Studie testet aktuell Avelumab mit oder ohne Kombination mit einer Peptidvakzine.
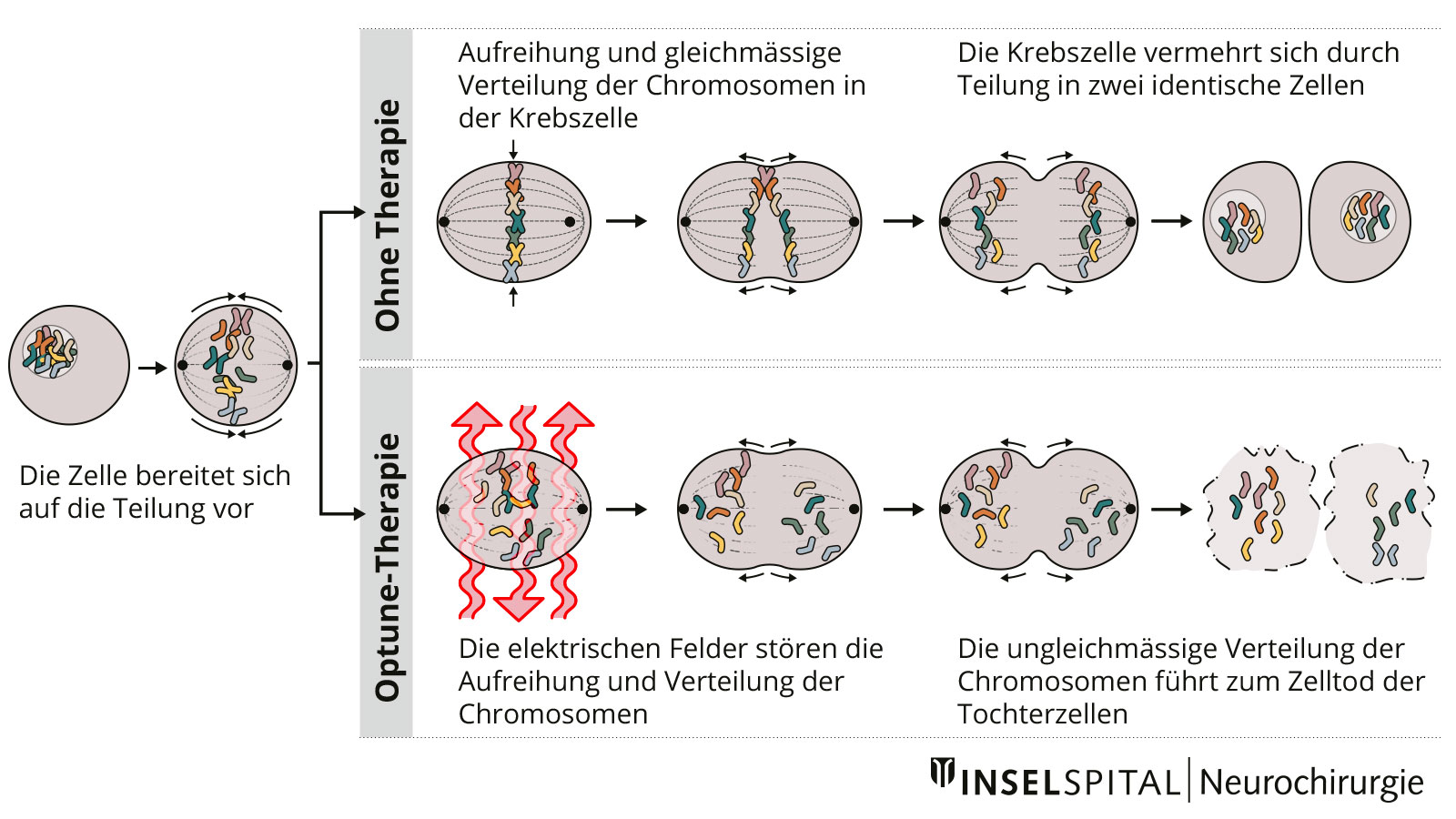
Tumor treating fields
Tumor treating fields (TTF oder TTFields, dt. auch Tumortherapiefelder) stellen eine neue nicht-invasive Therapiemethode für Patienten mit einem Glioblastom dar. Mit Hilfe eines Therapiegeräts (Optune®) werden über einen auf der Kopfhaut platzierten Transducer elektrische Felder mit niedriger Intensität, sogenannte tumor treating fields oder Tumortherapiefelder, erzeugt. Diese sollen Tumorzellen an der Zellteilung und Vermehrung hindern.
Bei einem neu diagnostizierten Glioblastom zeigte eine Studie mit wechselnden Stromfeldern einen Überlebensvorteil für Patienten, welche nach Bestrahlung zusätzlich zur Chemotherapie mit TTF behandelt wurden *. Das Gerät muss täglich so lange wie möglich getragen werden, die Haare müssen vollständig rasiert sein.
Wir sind der Meinung, dass sich die Behandlung mit TTF spätestens nach einer weiteren positiven Studie oder mit einer neuen Implantationsform als «Goldstandard» in der Behandlung des Glioblastoms etablieren wird. Wir beantworten hierzu gerne Ihre Fragen und stellen den Kontakt her.
Methadon
In den letzten Jahren wurde vermehrt das Thema Methadon im Rahmen der Glioblastomtherapie diskutiert. Trotz der zahlreichen Beiträge in Internetforen und zum Teil auch Vorbehalten gegenüber der Standardtherapie basiert die Annahme, dass die Gabe von Methadon hilft, nicht auf systematischen, wissenschaftlich erhobenen und öffentlich zugänglichen Daten. Bis heute gibt es keinen Nachweis für die Wirksamkeit der Methadontherapie bei Glioblastomen. Des Weiteren ist Methadon nicht ohne Nebenwirkungen.
Was geschieht, wenn der Tumor wieder wächst?
Leider erleiden die meisten Patienten mit einem Glioblastom auch nach erfolgreicher Operation und anschliessender idealer Nachbehandlung irgendwann ein Rezidiv. Die Ursache hierfür liegt zum einen im diffus infiltrierenden Wachstum dieser Tumoren. Zum anderen gibt es Hinweise darauf, dass sogenannte Tumorstammzellen eine wichtige Rolle spielen. Diese übernehmen möglicherweise schon eine Führung bei der Tumorentstehung, sind resistent gegen die üblichen Therapien und triggern dadurch das Rezidiv. Idealerweise sollte eine Therapie auch gegen diese Tumorstammzellen wirksam sein. Leider ist dies bisher noch nicht der Fall.
Wie die Behandlung bei einem Rezidiv aussieht, hängt von verschiedenen Faktoren ab:
- neurologischer Zustand des Patienten
- zeitliche Dynamik
- molekulare Tumormarker
- bereits erfolgte Therapien
Wir vertreten im Inselspital einen aggressiven Ansatz, der auf der Beobachtung des Wachstumsmusters basiert. Tumoren schaffen sich mit zunehmender Grösse ihr eigenes Milieu, in dem sie besser gedeihen können. Deshalb ist die engmaschige MRI-Überwachung und sofortige Therapie auch kleinster Rezidive einer unserer wichtigsten Grundsätze des OPTIMISST-Protokolls. Wir sind überzeugt, dass eine Wartezeit von mehreren Wochen zu einer Verminderung der Überlebenszeit führt, weil der Tumor während dieser Zeit «aufgetankte» Zellen in die weitere Umgebung schickt, die sich einer chirurgischen Resektion entziehen.
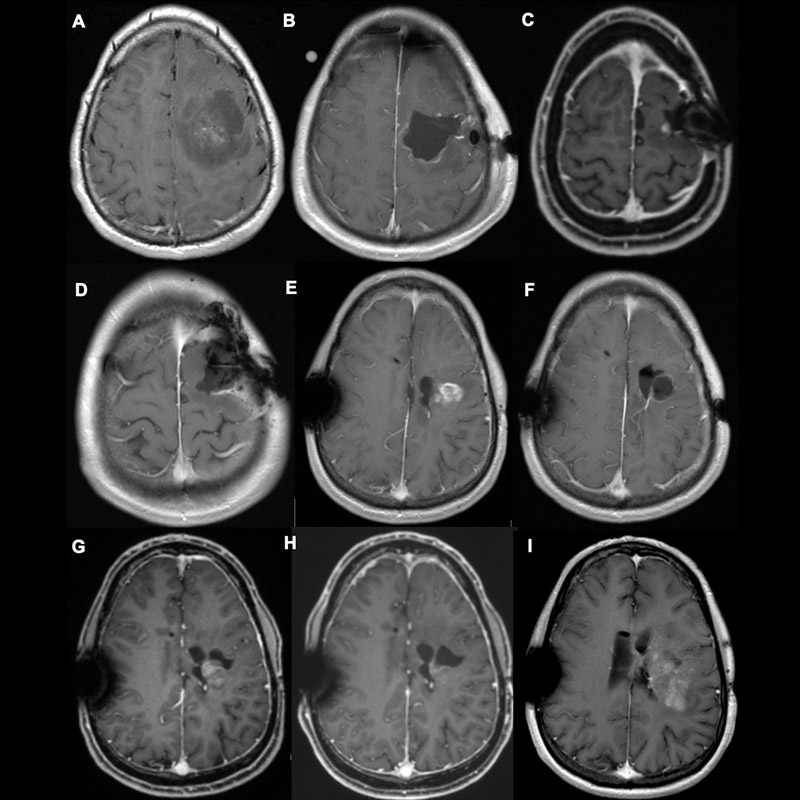
Operation bei einem Rezidiv
Grundsätzlich sollte bei einem Rezidiv immer die erneute chirurgische Resektion des Rezidivtumors in Betracht gezogen werden. Allerdings ist bei Rezidivoperationen mit einer höheren Komplikationsrate zu rechnen. Hier gilt, dass nur bei Erhaltung der Funktionen, die den Patienten eine gute Lebensqualität sichern, die Überlebenszeit günstig beeinflusst wird.
Wir haben am Inselspital deshalb die ReSurge-Studie initiiert, die aktuell in Europa durchgeführt wird. Damit wollen wir herausfinden, welche Patienten von einer Rezidivoperation profitieren und welche nicht.
Bestrahlung und/oder Chemotherapie bei einem Rezidiv
Zusätzlich zu einer Operation können oft eine weitere Bestrahlung und/oder Chemotherapie durchgeführt werden. Bei Patienten mit MGMT-Promotor Hypermethylierung und einem Rezidiv in der Therapiepause konnte die DIRECTOR-Studie nachweisen, dass diese Patienten erneut von einer Behandlung mit Temodal profitieren *.
Eine standardisierte Zweitlinienchemotherapie existiert bisher nicht. Über diese wird bei uns im Rahmen unseres interdisziplinären Tumor-Boards am Inselspital entschieden. Wichtige Faktoren bei der Entscheidung sind die unterschiedlichen molekularen Eigenschaften des Tumors und eine detaillierte genetische Analyse der Antriebsmutationen des Tumors. In der Diskussion mit renommierten Fachleuten, die per Konferenzschaltung dem Tumorboard zugeschaltet werden, können dann unter Umständen Medikamente identifiziert und eingesetzt werden, die bei anderen Tumorarten mit den gleichen Mutationen erfolgreich waren.
Wie ist die Prognose bei einem Glioblastom?
Die Prognose der Erkrankung wird von vielen Faktoren bestimmt. Aus grossen Studien wissen wir, dass verschiedene Faktoren einen Einfluss auf die Überlebenszeit der Patienten haben.
Faktoren, die die Überlebenszeit beeinflussen
Nicht beeinflussbare Faktoren
- jüngeres Alter
- guter Allgemein- und Leistungszustand
- keine Ausfälle neurologischer Teilfunktionen vor der Operation
- im Tumorgewebe: MGMT-Promotor-Hypermethylierung des Tumors
- im Tumorgewebe: IDH-Mutation
Beeinflussbare Faktoren
- kurze Zeit bis zur Operation, also frühestmögliche Entfernung des Tumors
- minimale oder keine Steroidgabe (Dexamethason) vor und nach der Operation
- keine Ausfälle neurologischer Teilfunktionen nach der Operation, insbesondere keine Lähmungen oder Teillähmungen, die als Komplikation einer Operation entstanden sind
- komplette Tumorentfernung im T1-Kontrastmittel-MRI (CRET nach RANO)
- komplette Entfernung des FLAIR-positiven Signals im MRI oder des T2-hyperintensen Signals im MRI
- keine Komplikation während und nach der Operation
- minimale oder keine Steroidgabe (Dexamethason) während der Strahlentherapie
- multifaktorielle Einflüsse (übrige Faktoren der OPTIMISST-Checkliste)
Wichtig ist, dass für den einzelnen Patienten nur eine grobe Schätzung des zeitlichen Verlaufs, aber keine exakte Vorhersage gemacht werden kann. Alle genannten Zahlen basieren auf dem «Durchschnittswert» einer grossen Anzahl Patienten und lassen keinen Rückschluss auf den einzelnen Patienten zu.
Langzeitüberleben mit Glioblastom unter der heutigen Therapie
Als Langzeitüberlebende werden Patienten mit mehr als 5 Jahren Überlebenszeit nach Diagnosestellung definiert. In einer grossen Studie basierend auf der heutigen Standardtherapie waren das ca. 10 % der Patienten *. Diese Rate variiert jedoch mit den Charakteristika des Patienten und des Tumors. Während sie bei Patienten unter 50 Jahre 17 % beträgt, liegt sie bei Patienten über 50 Jahre nur noch bei 6,4 %. Ein junges Patientenalter, ein guter Allgemeinzustand, das Vorhandensein einer IDH-Mutation, eine MGMT-Promotor-Hypermethylierung sowie eine neurochirurgische Komplettresektion sind nachweislich mit Langzeitüberleben assoziiert *, *, *.
Obwohl viele Langzeitüberlebende kognitive Defizite aufweisen, kann dennoch in den meisten Fällen eine gute Lebensqualität erreicht werden *, *. Wichtig ist zu wissen, dass auch bei Langzeitüberlebenden Rezidive auftreten, deshalb kann nicht von einer Heilung gesprochen werden *.
Warum Sie sich am Inselspital behandeln lassen sollten
Am Inselspital wird für jeden Patienten eine auf seine persönlichen Anforderungen individuelle Behandlungsstrategie festgelegt.
Dies geschieht im zertifizierten Hirntumorzentrum, wo ein interdisziplinäres Team alle Therapieoptionen individuell für jeden einzelnen Patienten diskutiert und festlegt. Wir sind als interdisziplinäres Hirntumorzentrum zertifiziert nach den Kriterien der ISO-Normen (durch das internationale Zertifizierungsinstitut ClarCert) und der Deutschen Krebsgesellschaft (durch das unabhängige Zertifizierungsinstitut OnkoZert). Alle am Tumorboard beteiligten Disziplinen müssen dafür hohe Qualitätsnormen erfüllen.
Unser wöchentlich stattfindendes Tumor-Board arbeitet interdisziplinär und setzt sich aus Spezialisten der Neurochirurgie, Neurologie, Neuroonkologie, Neuroradiologie, Nuklearmedizin, Radioonkologie sowie Pathologie zusammen.
Ein ergänzendes Behandlungskonzept, unser OPTIMISST-Protokoll, wurde am Inselspital entwickelt und implementiert.
Referenzen
-
McGirt MJ, Mukherjee D, Chaichana KL, Than KD, Weingart JD, Quinones-Hinojosa A. Association of surgically acquired motor and language deficits on overall survival after resection of glioblastoma multiforme. Neurosurgery. 2009;65:463-470.
-
Pitter KL, Tamagno I, Alikhanyan K et al. Corticosteroids compromise survival in glioblastoma. Brain. 2016;139:1458-1471.
-
Ostrom QT, Gittleman H, Xu J et al. CBTRUS Statistical Report: Primary Brain and Other Central Nervous System Tumors Diagnosed in the United States in 2009-2013. Neuro Oncol. 2016;18:v1-v75.
-
Ostrom QT, Gittleman H, de Blank PM et al. American brain tumor association adolescent and young adult primary brain and central nervous system tumors diagnosed in the United States in 2008-2012. Neuro-oncology. 2016;18:i1-i50.
-
Lahkola A, Auvinen A, Raitanen J et al. Mobile phone use and risk of glioma in 5 North European countries. International journal of cancer. 2007;120:1769-1775.
-
Ostrom QT, Bauchet L, Davis FG et al. The epidemiology of glioma in adults: a “state of the science” review. Neuro Oncol. 2014;16:896-913.
-
Capper D, Jones DTW, Sill M et al. DNA methylation-based classification of central nervous system tumours. Nature. 2018;555:469-474.
-
Soffietti R, Baumert BG, Bello L et al. Guidelines on management of low-grade gliomas: report of an EFNS-EANO Task Force. Eur J Neurol. 2010;17:1124-1133.
-
Inskip PD, Tarone RE, Hatch EE et al. Cellular-telephone use and brain tumors. N Engl J Med. 2001;344:79-86.
-
Pedersen CL, Romner B. Current treatment of low grade astrocytoma: a review. Clin Neurol Neurosurg. 2013;115:1-8.
-
Claus EB, Black PM. Survival rates and patterns of care for patients diagnosed with supratentorial low-grade gliomas: data from the SEER program, 1973-2001. Cancer. 2006;106:1358-1363.
-
Wen PY, Kesari S. Malignant gliomas in adults. N Engl J Med. 2008;359:492-507.
-
Mintz A, Perry J, Spithoff K, Chambers A, Laperriere N. Management of single brain metastasis: a practice guideline. Curr Oncol. 2007;14:131-143.
-
Patchell RA, Tibbs PA, Walsh JW et al. A randomized trial of surgery in the treatment of single metastases to the brain. N Engl J Med. 1990;322:494-500.
-
Jakola AS, Skjulsvik AJ, Myrmel KS et al. Surgical resection versus watchful waiting in low-grade gliomas. Ann Oncol. 2017;28:1942-1948.
-
Sanai N, Polley MY, McDermott MW, Parsa AT, Berger MS. An extent of resection threshold for newly diagnosed glioblastomas. J Neurosurg. 2011;115:3-8.
-
Sanai N, Berger MS. Extent of resection influences outcomes for patients with gliomas. Rev Neurol (Paris). 2011;167:648-654.
-
Cancer GARN. Comprehensive genomic characterization defines human glioblastoma genes and core pathways. Nature. 2008;455:1061-1068.
-
Lacroix M, Abi-Said D, Fourney DR et al. A multivariate analysis of 416 patients with glioblastoma multiforme: prognosis, extent of resection, and survival. J Neurosurg. 2001;95:190-198.
-
Salvati M, Pichierri A, Piccirilli M et al. Extent of tumor removal and molecular markers in cerebral glioblastoma: a combined prognostic factors study in a surgical series of 105 patients. Journal of neurosurgery. 2012;117:204-211.
-
Capelle L, Fontaine D, Mandonnet E et al. Spontaneous and therapeutic prognostic factors in adult hemispheric World Health Organization Grade II gliomas: a series of 1097 cases. Journal of neurosurgery. 2013;118:1157-1168.
-
McGirt MJ, Chaichana KL, Attenello FJ et al. Extent of surgical resection is independently associated with survival in patients with hemispheric infiltrating low-grade gliomas. Neurosurgery. 2008;63:700-7; author reply 707.
-
Bloch O, Han SJ, Cha S et al. Impact of extent of resection for recurrent glioblastoma on overall survival: clinical article. J Neurosurg. 2012;117:1032-1038.
-
Chaichana KL, Cabrera-Aldana EE, Jusue-Torres I et al. When gross total resection of a glioblastoma is possible, how much resection should be achieved. World Neurosurg. 2014;82:e257-65.
-
Keles GE, Lamborn KR, Berger MS. Low-grade hemispheric gliomas in adults: a critical review of extent of resection as a factor influencing outcome. J Neurosurg. 2001;95:735-745.
-
Oppenlander ME, Wolf AB, Snyder LA et al. An extent of resection threshold for recurrent glioblastoma and its risk for neurological morbidity. J Neurosurg. 2014;120:846-853.
-
Schucht P, Murek M, Jilch A et al. Early re-do surgery for glioblastoma is a feasible and safe strategy to achieve complete resection of enhancing tumor. PLoS One. 2013;8:e79846.
-
Schucht P, Knittel S, Slotboom J et al. 5-ALA complete resections go beyond MR contrast enhancement: shift corrected volumetric analysis of the extent of resection in surgery for glioblastoma. Acta Neurochir (Wien). 2014;156:305-12; discussion 312.
-
Gill BJ, Pisapia DJ, Malone HR et al. MRI-localized biopsies reveal subtype-specific differences in molecular and cellular composition at the margins of glioblastoma. Proc Natl Acad Sci U S A. 2014;111:12550-12555.
-
Jain R, Poisson LM, Gutman D et al. Outcome prediction in patients with glioblastoma by using imaging, clinical, and genomic biomarkers: focus on the nonenhancing component of the tumor. Radiology. 2014;272:484-493.
-
Yordanova YN, Moritz-Gasser S, Duffau H. Awake surgery for WHO Grade II gliomas within “noneloquent” areas in the left dominant hemisphere: toward a “supratotal” resection. Journal of neurosurgery. 2011
-
Gil-Robles S, Duffau H. Surgical management of World Health Organization Grade II gliomas in eloquent areas: the necessity of preserving a margin around functional structures. Neurosurg Focus. 2010;28:E8.
-
Duffau H. Is supratotal resection of glioblastoma in noneloquent areas possible. World Neurosurg. 2014;82:e101-3.
-
Ius T, Angelini E, Thiebaut de Schotten M, Mandonnet E, Duffau H. Evidence for potentials and limitations of brain plasticity using an atlas of functional resectability of WHO grade II gliomas: towards a “minimal common brain”. Neuroimage. 2011;56:992-1000.
-
Duffau H, Taillandier L. New concepts in the management of diffuse low-grade glioma: Proposal of a multistage and individualized therapeutic approach. Neuro Oncol. 2015;17:332-342.
-
De Witt Hamer PC, Robles SG, Zwinderman AH, Duffau H, Berger MS. Impact of intraoperative stimulation brain mapping on glioma surgery outcome: a meta-analysis. J Clin Oncol. 2012;30:2559-2565.
-
Duffau H, Capelle L, Denvil D, et al. Usefulness of intraoperative electrical subcortical mapping during surgery for low-grade gliomas located within eloquent brain regions: functional results in a consecutive series of 103 patients. J Neurosurg 2003;98:764-78.
-
Duffau H, Peggy Gatignol ST, Mandonnet E, Capelle L, Taillandier L. Intraoperative subcortical stimulation mapping of language pathways in a consecutive series of 115 patients with Grade II glioma in the left dominant hemisphere. J Neurosurg 2008;109:
-
Keles GE, Lundin DA, Lamborn KR, Chang EF, Ojemann G, Berger MS. Intraoperative subcortical stimulation mapping for hemispherical perirolandic gliomas located within or adjacent to the descending motor pathways: evaluation of morbidity and assessment of functional outcome in 294 patients. J Neurosurg. 2004;100:369-375.
-
Raabe A, Beck J, Schucht P, Seidel K. Continuous dynamic mapping of the corticospinal tract during surgery of motor eloquent brain tumors: evaluation of a new method. J Neurosurg. 2014;120:1015-1024.
-
Chacko AG, Thomas SG, Babu KS et al. Awake craniotomy and electrophysiological mapping for eloquent area tumours. Clin Neurol Neurosurg. 2013;115:329-334.
-
Spena G, Garbossa D, Panciani PP, Griva F, Fontanella MM. Purely subcortical tumors in eloquent areas: awake surgery and cortical and subcortical electrical stimulation (CSES) ensure safe and effective surgery. Clin Neurol Neurosurg. 2013;115:1595-1601.
-
Stummer W, Pichlmeier U, Meinel T et al. Fluorescence-guided surgery with 5-aminolevulinic acid for resection of malignant glioma: a randomised controlled multicentre phase III trial. Lancet Oncol. 2006;7:392-401.
-
Stummer W, Stocker S, Wagner S et al. Intraoperative detection of malignant gliomas by 5-aminolevulinic acid-induced porphyrin fluorescence. Neurosurgery. 1998;42:518-25; discussion 525.
-
Pogue BW, Gibbs-Strauss S, Valdés PA, Samkoe K, Roberts DW, Paulsen KD. Review of Neurosurgical Fluorescence Imaging Methodologies. IEEE J Sel Top Quantum Electron. 2010;16:493-505.
-
Hebeda KM, Saarnak AE, Olivo M, Sterenborg HJ, Wolbers JG. 5-Aminolevulinic acid induced endogenous porphyrin fluorescence in 9L and C6 brain tumours and in the normal rat brain. Acta Neurochir (Wien). 1998;140:503-12; discussion 512.
-
Schucht P, Beck J, Abu-Isa J et al. Gross total resection rates in contemporary glioblastoma surgery: results of an institutional protocol combining 5-aminolevulinic acid intraoperative fluorescence imaging and brain mapping. Neurosurgery. 2012;71:927-35; discussion 935.
-
Louvel G, Metellus P, Noel G, et al. Delaying standard combined chemoradiotherapy after surgical resection does not impact survival in newly diagnosed glioblastoma patients. Radiother Oncol 2016;118:9-15.
-
Loureiro LV, Victor ES, Callegaro-Filho D et al. Minimizing the uncertainties regarding the effects of delaying radiotherapy for Glioblastoma: A systematic review and meta-analysis. Radiother Oncol. 2016;118:1-8.
-
Stupp R, Mason WP, van den Bent MJ et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med. 2005;352:987-996.
-
Stupp R, Hegi ME, Mason WP, et al. Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase III study: 5-year analysis of the EORTC-NCIC trial. Lancet Oncol 2009;10:459-66.
-
Chinot OL, Wick W, Mason W et al. Bevacizumab plus radiotherapy-temozolomide for newly diagnosed glioblastoma. N Engl J Med. 2014;370:709-722.
-
Schäfer N, Proescholdt M, Steinbach JP et al. Quality of life in the GLARIUS trial randomizing bevacizumab/irinotecan versus temozolomide in newly diagnosed, MGMT-nonmethylated glioblastoma. Neuro Oncol. 2018;20:975-985.
-
Blumenthal DT, Gorlia T, Gilbert MR et al. Is more better? The impact of extended adjuvant temozolomide in newly diagnosed glioblastoma: a secondary analysis of EORTC and NRG Oncology/RTOG. Neuro Oncol. 2017;19:1119-1126.
-
Gilbert MR, Wang M, Aldape KD et al. Dose-dense temozolomide for newly diagnosed glioblastoma: a randomized phase III clinical trial. J Clin Oncol. 2013;31:4085-4091.
-
Herrlinger U, Tzaridis T, Mack F et al. Lomustine-temozolomide combination therapy versus standard temozolomide therapy in patients with newly diagnosed glioblastoma with methylated MGMT promoter (CeTeG/NOA-09): a randomised, open-label, phase 3 trial. Lancet. 2019;393:678-688.
-
Wick W, Platten M, Meisner C et al. Temozolomide chemotherapy alone versus radiotherapy alone for malignant astrocytoma in the elderly: the NOA-08 randomised, phase 3 trial. Lancet Oncol. 2012;13:707-715.
-
Perry JR, Laperriere N, O’Callaghan CJ et al. Short-Course Radiation plus Temozolomide in Elderly Patients with Glioblastoma. N Engl J Med. 2017;376:1027-1037.
-
Weller M, Butowski N, Tran DD et al. Rindopepimut with temozolomide for patients with newly diagnosed, EGFRvIII-expressing glioblastoma (ACT IV): a randomised, double-blind, international phase 3 trial. Lancet Oncol. 2017;18:1373-1385.
-
Desjardins A, Gromeier M, Herndon JE et al. Recurrent Glioblastoma Treated with Recombinant Poliovirus. N Engl J Med. 2018;379:150-161.
-
Lang FF, Conrad C, Gomez-Manzano C et al. Phase I Study of DNX-2401 (Delta-24-RGD) Oncolytic Adenovirus: Replication and Immunotherapeutic Effects in Recurrent Malignant Glioma. J Clin Oncol. 2018;36:1419-1427.
-
Mitchell LA, Lopez Espinoza F, Mendoza D et al. Toca 511 gene transfer and treatment with the prodrug, 5-fluorocytosine, promotes durable antitumor immunity in a mouse glioma model. Neuro Oncol. 2017;19:930-939.
-
Reulen HJ, Poepperl G, Goetz C et al. Long-term outcome of patients with WHO Grade III and IV gliomas treated by fractionated intracavitary radioimmunotherapy. J Neurosurg. 2015;123:760-770.
-
Stupp R, Taillibert S, Kanner AA et al. Maintenance Therapy With Tumor-Treating Fields Plus Temozolomide vs Temozolomide Alone for Glioblastoma: A Randomized Clinical Trial. JAMA. 2015;314:2535-2543.
-
Weller M, Tabatabai G, Kästner B et al. MGMT Promoter Methylation Is a Strong Prognostic Biomarker for Benefit from Dose-Intensified Temozolomide Rechallenge in Progressive Glioblastoma: The DIRECTOR Trial. Clin Cancer Res. 2015;21:2057-2064.
-
Gately L, McLachlan SA, Philip J, Ruben J, Dowling A. Long-term survivors of glioblastoma: a closer look. J Neurooncol. 2018;136:155-162.
-
Krex D, Klink B, Hartmann C et al. Long-term survival with glioblastoma multiforme. Brain. 2007;130:2596-2606.
-
Reifenberger G, Weber RG, Riehmer V et al. Molecular characterization of long-term survivors of glioblastoma using genome- and transcriptome-wide profiling. Int J Cancer. 2014;135:1822-1831.
-
Archibald YM, Lunn D, Ruttan LA et al. Cognitive functioning in long-term survivors of high-grade glioma. J Neurosurg. 1994;80:247-253.
-
Steinbach JP, Blaicher HP, Herrlinger U et al. Surviving glioblastoma for more than 5 years: the patient’s perspective. Neurology. 2006;66:239-242.
-
Bähr O, Herrlinger U, Weller M, Steinbach JP. Very late relapses in glioblastoma long-term survivors. J Neurol. 2009;256:1756-1758.