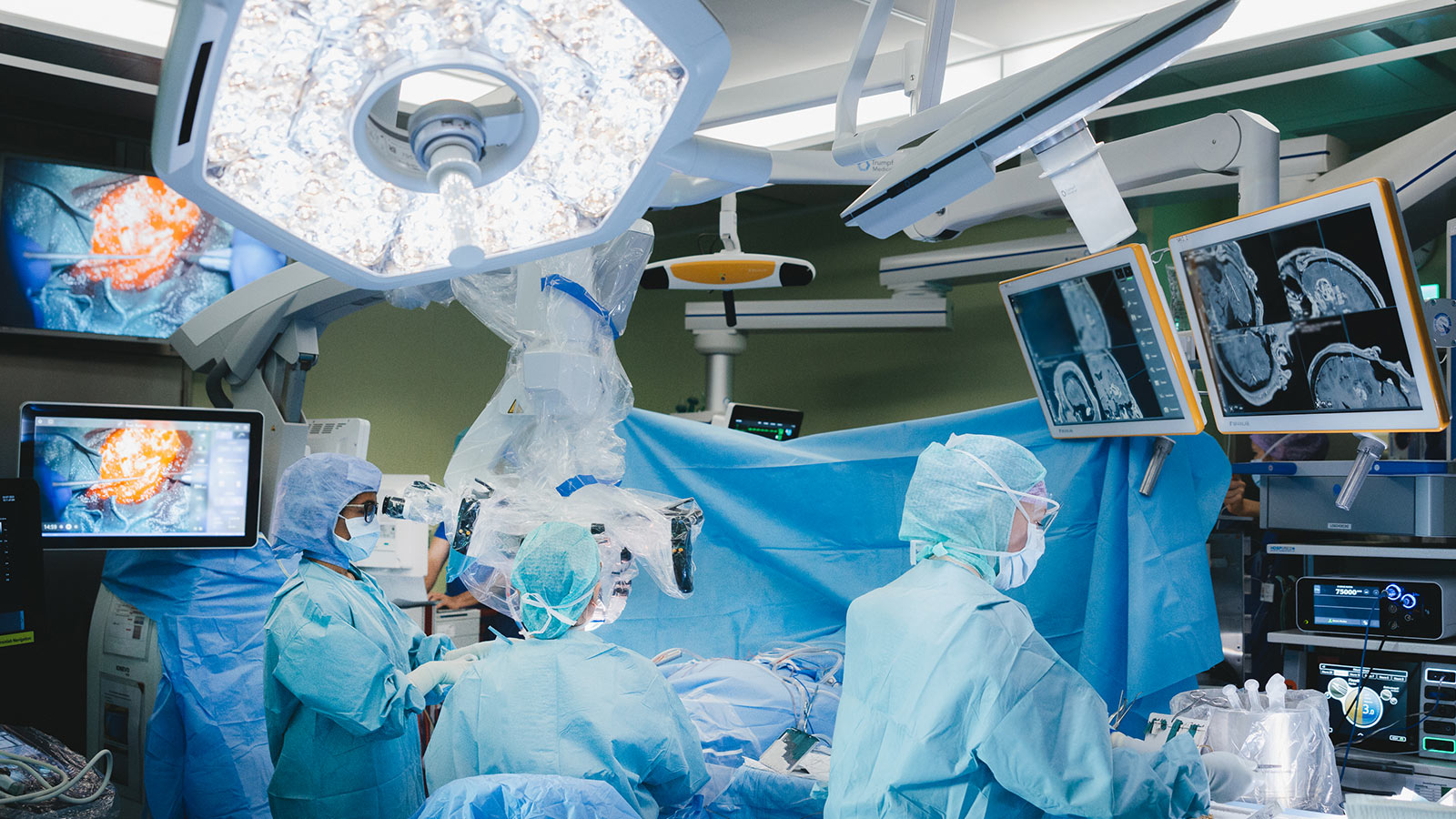
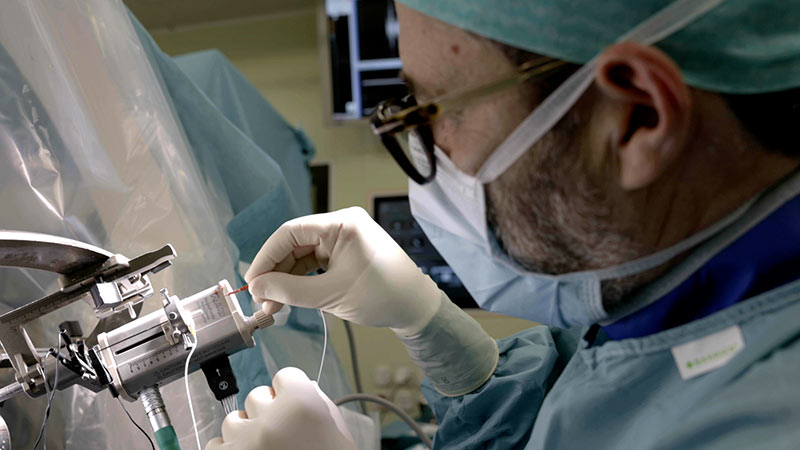
Forschung Neurochirurgie & Hirntumoren
Neurochirurgische Forschung ist entscheidend, um die Sicherheit und Präzision bei Eingriffen am Gehirn und Rückenmark weiter zu verbessern. Dank modernster Technologien können wir heute lebenswichtige Strukturen im Gehirn sichtbar machen und so selbst die komplexesten Eingriffe sicherer gestalten.
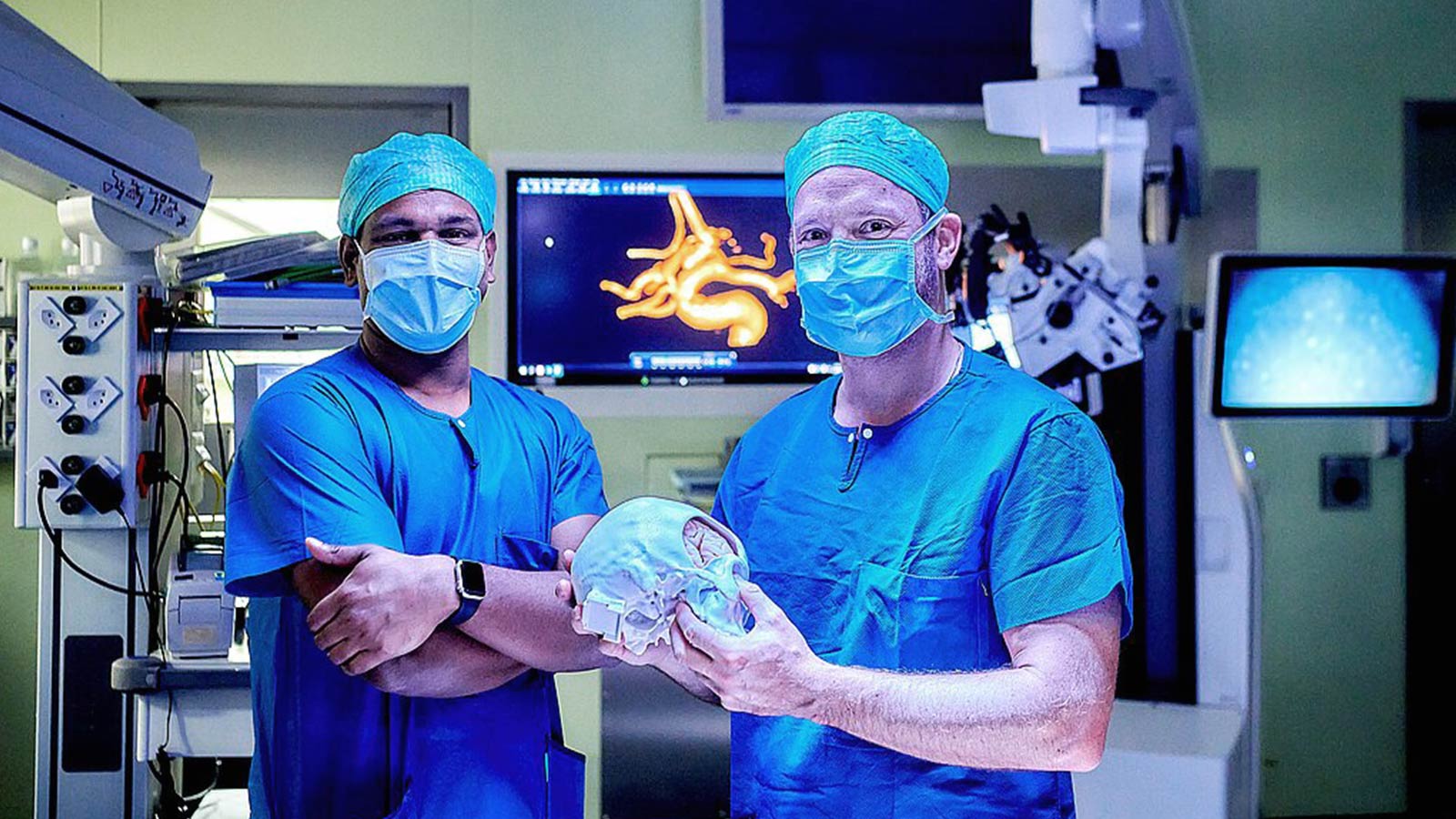
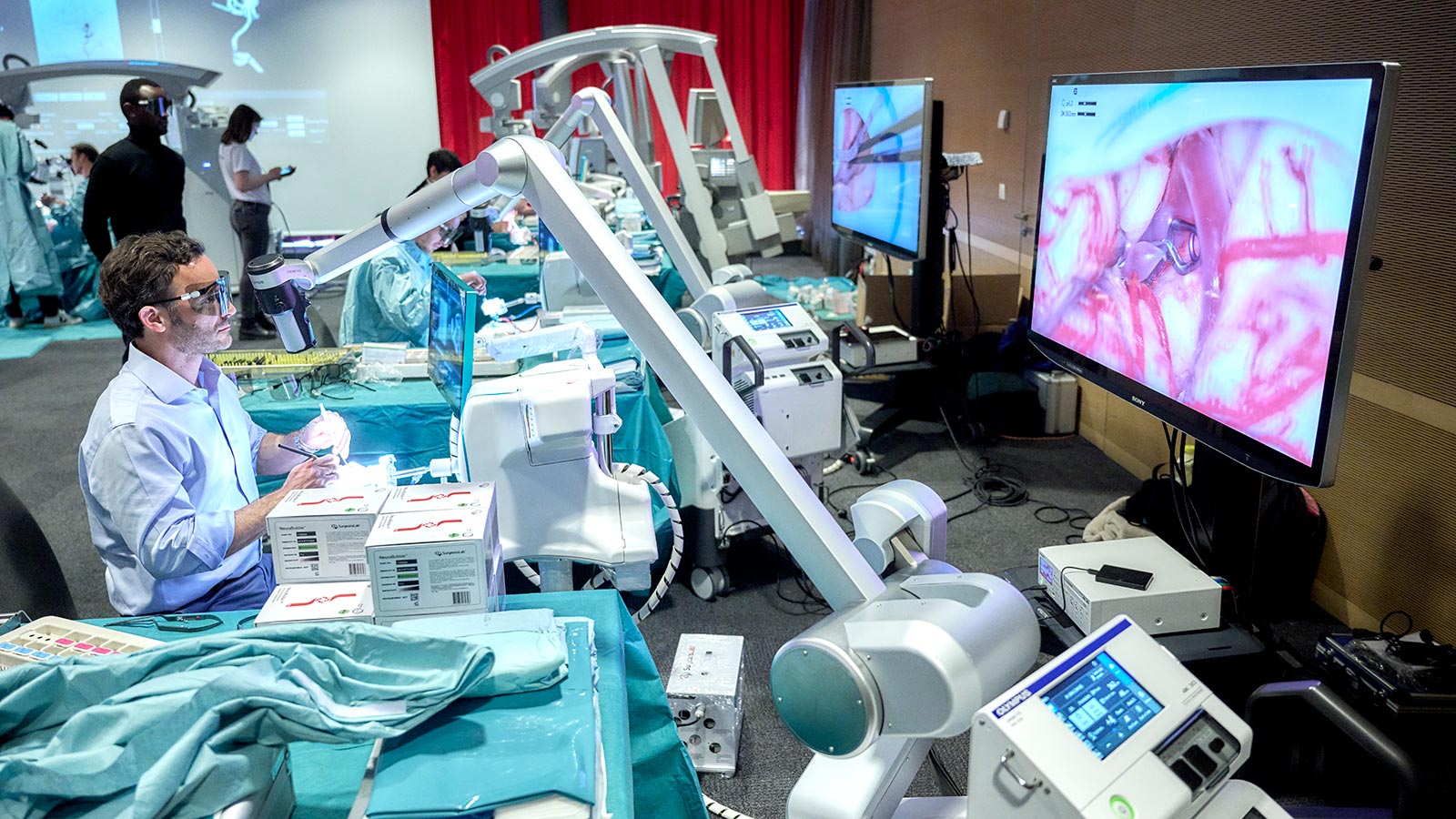
HORAO-Projekt: sicherere Hirntumor-OPs
Unterstützen Sie unser grosses Forschungsprojekt HORAO. Wir forschen intensiv an einem neuartigen Operationsmikroskop, das bei einer Hirntumoroperation eine radikalere und gleichzeitig sicherere Entfernung von Hirntumoren ermöglichen soll. Derzeit werden erste Prototypen direkt im OP getestet.
Forschung Wirbelsäule
Die Forschung in der Wirbelsäulenchirurgie ist entscheidend, um die Behandlung häufiger und komplexer Rückenleiden wie Bandscheibenvorfälle, Spinalkanalstenosen und Wirbelbrüche zu verbessern. Schonendere Techniken, moderne Implantate und regenerative Ansätze steigern die Lebensqualität der Patienten.
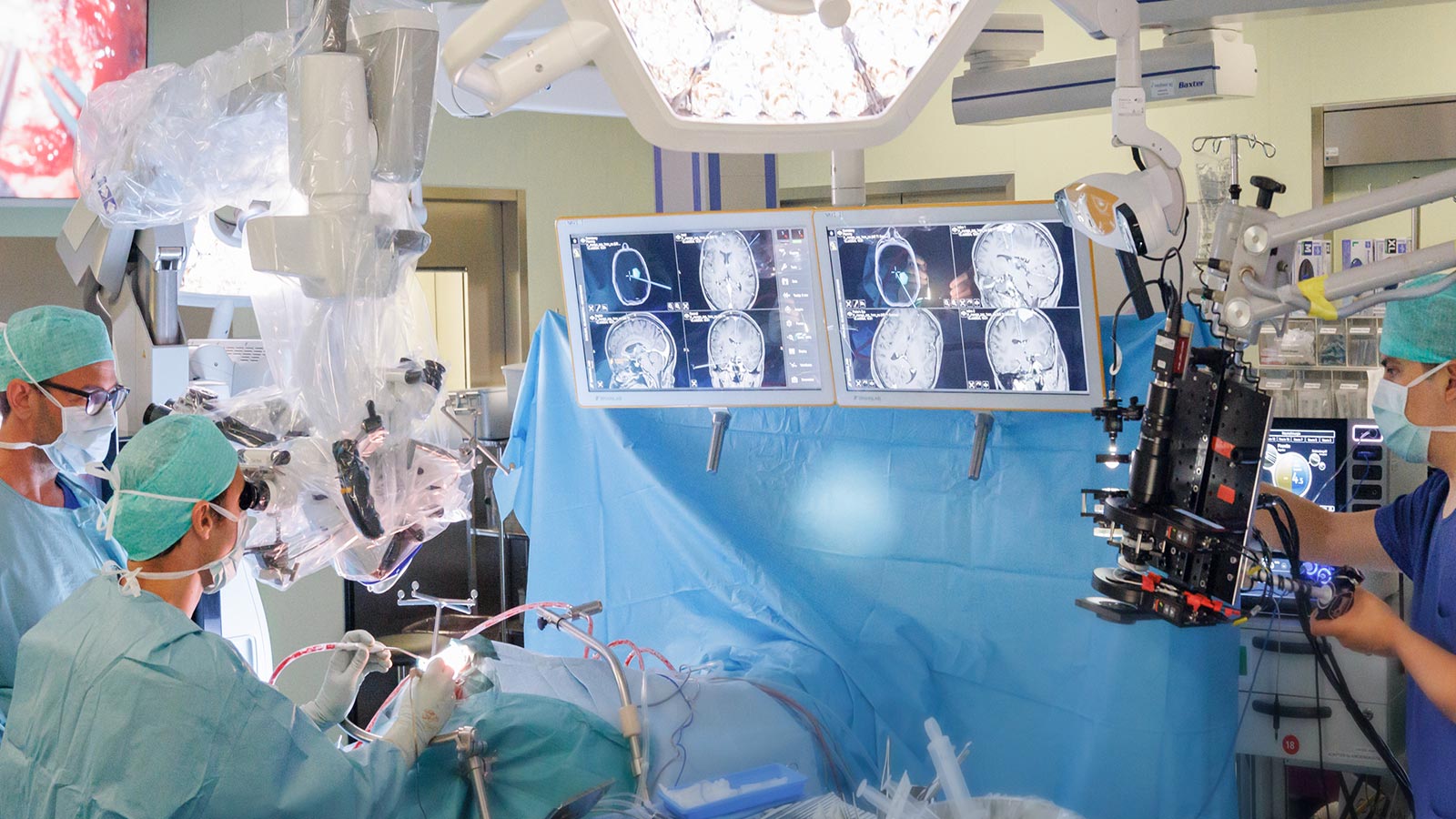
Forschung Hirngefässe
Die Forschung auf dem Gebiet der vaskulären Neurochirurgie ist entscheidend, um die Behandlung lebensbedrohlicher Gefässerkrankungen wie beispielsweise Aneurysmen, Schlaganfälle oder Gefässmissbildungen stetig zu verbessern und Risiken für Patienten zu minimieren.
Forschung Funktionsüberwachung (IOM)
Das intraoperative Neuromonitoring (IOM) wird eingesetzt, um Hirnfunktionen während chirurgischer Eingriffe zu überwachen. Das Ziel ist, neurologische Schäden zu vermeiden, besonders bei Eingriffen in der Nähe empfindlicher Hirnstrukturen, und so die Patientensicherheit zu maximieren.
Forschung Funktionelle Neurochirurgie
Millionen Menschen weltweit leiden unter Krankheiten wie Parkinson, Epilepsie oder Migräne, die auf Fehlfunktionen des Nervensystems zurückzuführen sind. Fortschritte in der Forschung ermöglichen neue Therapien und bessere Diagnosen, die Betroffenen ein aktiveres und schmerzfreieres Leben ermöglichen.