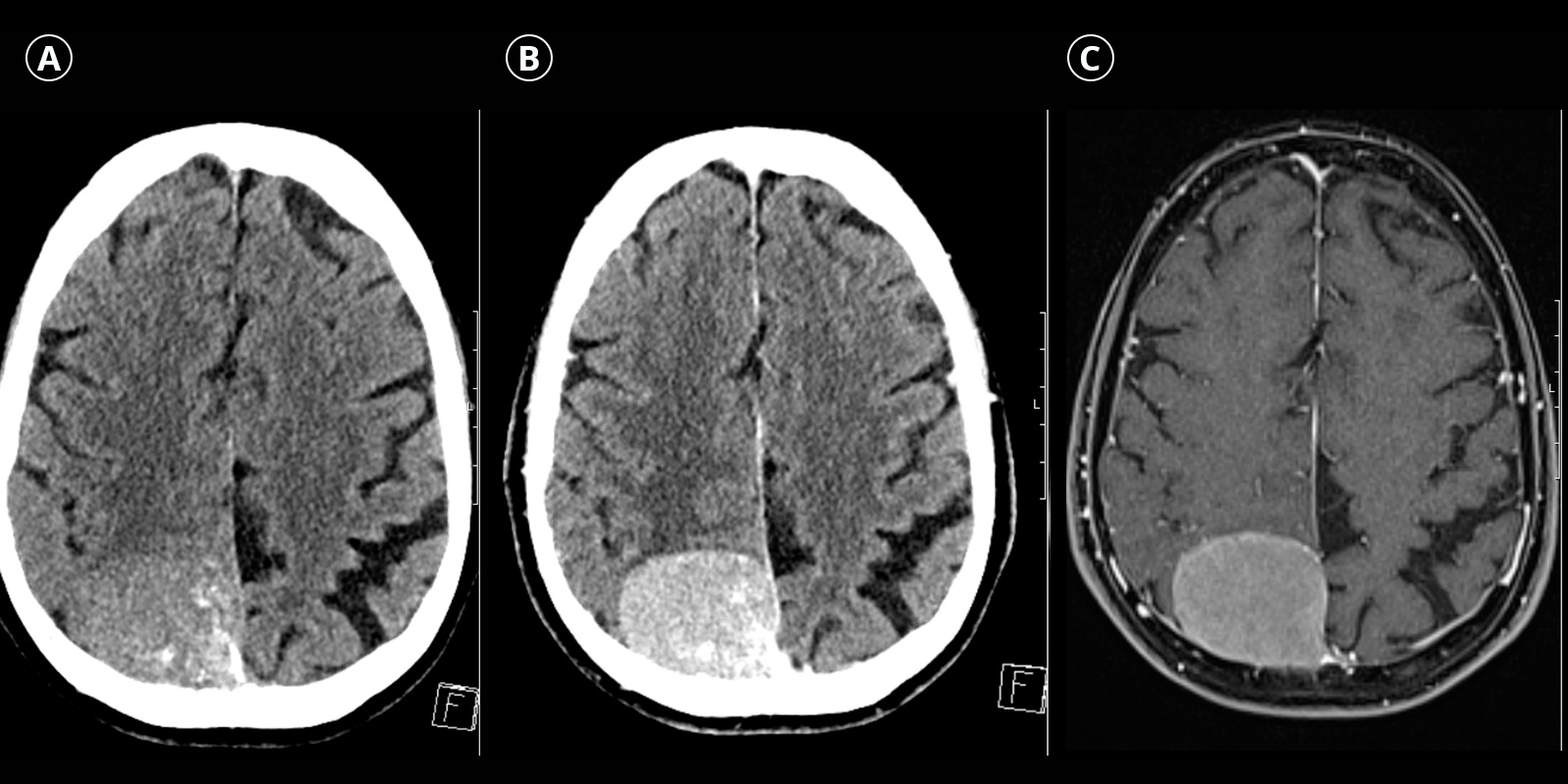
Meningeome sind langsam wachsende Tumoren, die von den Hirnhäuten ausgehen. Sie zählen mit rund 35 % zu den häufigsten Tumoren des zentralen Nervensystems (ZNS) und treten vermehrt ab dem 50. Lebensjahr auf. Mehr als 90 % der Meningeome sind gutartig. Wenn Meningeome kontinuierlich wachsen und eine Grösse erreichen, die das Hirn komprimiert und Symptome verursacht, sollten sie behandelt werden.
Klinische Bedeutung
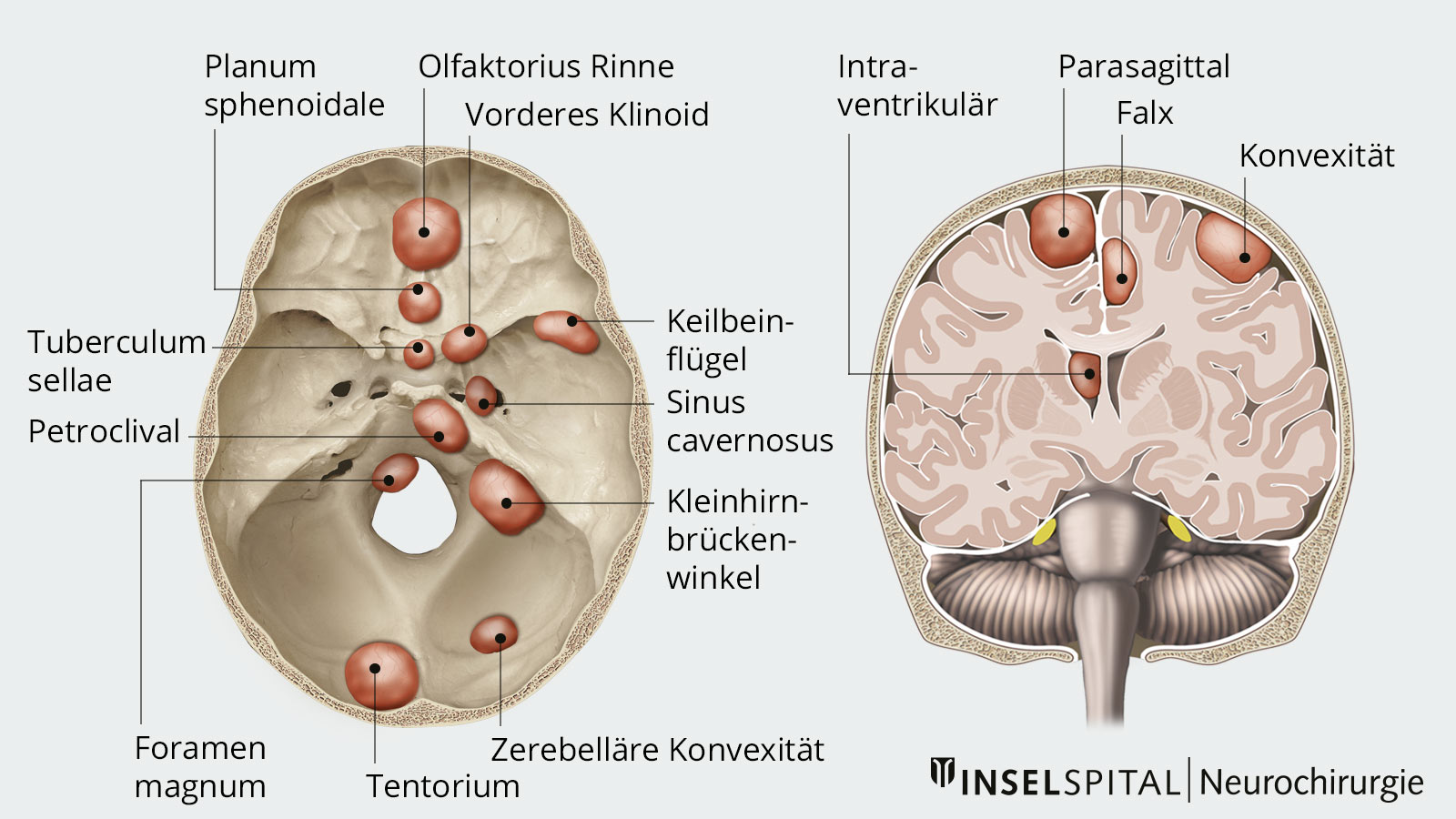
Hirn und Rückenmark sind von drei schützenden Membranen umgeben, den sogenannten Meningen. Tumoren, die aus der Spinnwebenhaut (Arachnoidea) der Meningen entspringen, werden als Meningeome bezeichnet. Meningeome sind die häufigsten gutartigen intrakraniellen Tumoren. Die Krankheitshäufigkeit bei älteren Menschen beträgt ca. 3 %. Je nach Lage verursacht ein Meningeom unterschiedliche Beschwerden.
Meningeome wachsen in der Regel sehr langsam, können jedoch in seltenen Fällen das umgebende Gewebe infiltrieren und Metastasen bilden. Obwohl Meningeome meistens gutartig sind, bleiben sie mitunter aufgrund ihres schleichenden, verdrängenden Wachstums über einen längeren Zeitraum unerkannt und können so zu schweren Schäden und Behinderungen führen.
Was ist, wenn ein Meningeom zufällig entdeckt wird?
Viele Meningeome werden entdeckt, weil Patienten an allgemeinen Kopfschmerzen leiden oder z. B. nach einem Unfall eine Magnetresonanztomografie (MRT bzw. MRI von Magnetic Resonance Imaging) oder eine Computertomografie (CT) erhalten. Solche Befunde werden als Zufallsbefunde bezeichnet. In den meisten Fällen wird sich der behandelnde Arzt für eine Verlaufsbeobachtung mittels jährlicher MRI-Untersuchung entscheiden, wenn das Meningeom klein ist, keine Symptome macht und nicht an der Grenze zu kritischen Arealen liegt. Es gibt indirekte Zeichen eines Wachstums wie die Grösse > 2,5 cm, ein Ödem oder ein helles zellreiches Aussehen im sogenannten T2-MRI-Bild. In diesen und anderen begründeten Fällen kann auch ein zufällig gefundenes Meningeom eine Indikation zur Behandlung darstellen.
Was sind die Ursachen für Meningeome?
Ionisierende Strahlung ist nach heutigem Wissensstand der grösste Risikofaktor für die Entstehung von Meningeomen. So haben Personen, die einer besonders hohen Strahlendosis ausgesetzt waren, ein deutlich erhöhtes Risiko, ein Meningeom zu entwickeln. Dies sind zum Beispiel Atombomben-Überlebende (mit 6- bis 10-fach erhöhtem Risiko) oder Patienten nach Strahlentherapie im Kopf- und Nackenbereich. Auch Patienten mit der Erbkrankheit Neurofibromatose Typ 2 neigen zur Bildung von Meningeomen.
Häufigkeit und Risikofaktoren
- Häufigste Tumoren des ZNS
- Vermehrtes Auftreten ab dem 50. Lebensjahr
- Grösster Risikofaktor: ionisierende Strahlung
Wie werden Meningeome eingeteilt?
Gemäss der Weltgesundheitsorganisation (WHO) werden Meningeome nach feingeweblichen Kriterien in drei Schweregrade eingeteilt:
- WHO-Grad I = 70 %
- WHO-Grad II = 27 %
- WHO-Grad III = 3 %
WHO-Grad-II-Meningeome sind gutartig, wachsen aber schneller, haben eine erhöhte Neigung, das umgebende Gewebe zu infiltrieren, und kehren nach einer erfolgreichen Therapie oft wieder (Rezidiv). WHO-Grad-III-Meningeome sind dagegen bösartige Tumoren und benötigen immer eine zusätzliche Radio-Chemotherapie.
Welche Symptome verursachen Meningeome?
Meningeome wachsen in der Regel langsam, verdrängen dabei aber nach und nach das gesunde umliegende Hirngewebe. Je nach Lage und Wachstumsgeschwindigkeit können dadurch Symptome wie Kopfschmerzen, epileptische Anfälle, Verschlechterung des Seh-, Riech- und Sprachvermögens wie auch Lähmungen und Veränderungen der Sensibilität auftreten. Diese Symptome verstärken sich typischerweise nur schleichend aufgrund des langsamen Tumorwachstums.
- Kopfschmerzen
- epileptische Anfälle
- Seh-, Riech- und Sprachstörungen
- oftmals nur Zufallsbefunde
Wie werden Meningeome diagnostiziert?
Bildgebende Verfahren
Die Diagnose erfolgt meist im Rahmen der Abklärung von Symptomen oder als Zufallsbefund im Rahmen anderweitiger Diagnostik.
Sowohl in der Computertomografie (CT) als auch in der Magnetresonanztomografie (MRI) stellen sich Meningeome meist als gut abgrenzbare, extraaxiale (primär ausserhalb des Hirngewebes gelegene) Tumoren dar, die breitflächig auf der harten Hirnhaut (Dura mater) aufliegen und das angrenzende Hirngewebe komprimieren. Bei Kontrastmittelgabe nehmen Meningeome dieses homogen auf. Im CT sind als weiteres Merkmal zum Teil Verkalkungen sowie sekundäre Knochenveränderungen nachweisbar. Im MRI lassen sich häufig nach aussen auslaufende, durale Verdickungen nachweisen, das sogenannte Dural Tail Sign.
Wie werden Meningeome behandelt?
Kleine Meningeome, die nicht an Grösse zunehmen, können konservativ behandelt werden. Wachsen Meningeome kontinuierlich oder haben eine Grösse erreicht, die das Hirn komprimiert, ein Hirnödem verursacht oder symptomatisch wird, sollten sie behandelt werden. Standardtherapie ist die Operation, seltener eine radiochirurgische Therapie. Aufgrund der variablen Lokalisation und Grösse muss die Entscheidung über das beste Vorgehen immer individuell besprochen werden. Die optimale Behandlung richtet sich also nach Grösse, Lage und Wachstumsgeschwindigkeit des Tumors, ausserdem nach der histopathologischen Gewebeanalyse sowie dem Allgemeinzustand des Patienten.
Hirntumorzentrum
Am Inselspital wird individuell für jeden Patienten eine bestmögliche Behandlungsstrategie festgelegt. Dies geschieht im zertifizierten Hirntumorzentrum, wo ein interdisziplinäres Team alle Therapieoptionen individuell für jeden einzelnen Patienten diskutiert und festlegt.
Dieses wöchentlich stattfindende Tumor-Board setzt sich aus Spezialisten der Neurochirurgie, Neurologie, Neuroonkologie, Nuklearmedizin, Radioonkologie sowie Pathologie zusammen.
Konservative Behandlung
Patienten mit asymptomatischen Zufallsbefunden, kleineren Meningeomen oder höherem Lebensalter werden zunächst konservativ behandelt. Das bedeutet, es erfolgen regelmässig klinische Kontrollen inklusive Bildgebung (MRI, CT), um den Verlauf der Erkrankung zu überwachen. Die anfänglichen Nachkontrollen erfolgen innerhalb von 3–6 Monaten nach Stellen der Verdachtsdiagnose. Bei stabilen Befunden können die nachfolgenden Zeitintervalle zwischen den Kontrolluntersuchungen zunehmend verlängert werden.
In diversen Studien zeigte sich während der bildgebenden Verlaufskontrollen über einen durchschnittlichen Zeitraum von 2–5 Jahren bei rund 50–70 % der Patienten eine stabile Meningeomgrösse ohne Wachstumstendenz. Bei Grössenzunahme der Meningeome oder Entwicklung neuer Symptome sollte neu über eine weitere Therapie entschieden werden.
Operation
Die primäre Therapie für ein symptomatisches, sich vergrösserndes Meningeom besteht in einer vollständigen mikrochirurgischen Entfernung. Wenn dies möglich ist, bedeutet das in den meisten Fällen die Heilung für den Patienten.
Deshalb steht an oberster Stelle der Behandlung eine maximal mögliche, zugleich schonende und funktionserhaltende Tumorentfernung mit hohem kosmetischem Anspruch.
Dabei wird das Meningeom zuerst von innen heraus verkleinert, damit die Grenze zum Nachbargewebe entlastet wird. Danach wird der Tumor vorsichtig unter dem Mikroskop vom umgebenden normalen Gehirngewebe abpräpariert. Die tumortragende Hirnhaut wird meist mit entfernt und ersetzt. Die Verzahnung zwischen normalem Hirn und Meningeom ist dabei von Patient zu Patient unterschiedlich intensiv ausgeprägt. Ein Teil der Tumoren hat eine glatte Grenze, andere Tumoren haben die Hirnoberfläche infiltriert und werden von normalen Hirngefässen mit Blut versorgt.
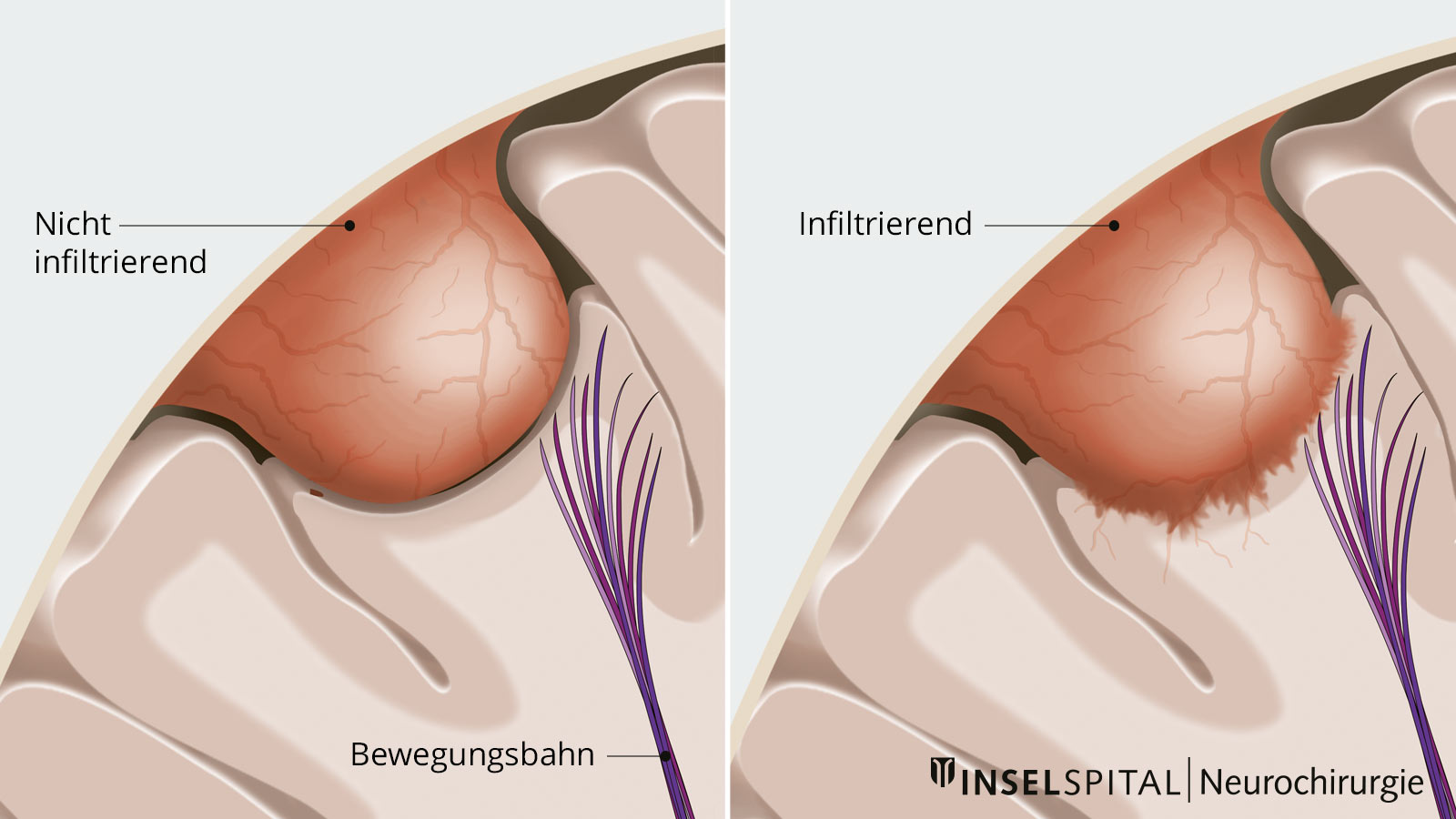
Wenn in diesen Fällen ein wichtiges Hirngebiet betroffen ist, muss die Operation unter Funktionsüberwachung durchgeführt werden. Dazu werden neueste technische Verfahren, wie die Neuronavigation mit Augmented Reality und das sogenannte intraoperative Neuromonitoring, eingesetzt, die dem Neurochirurgen ermöglichen, mit maximaler Präzision und Sicherheit unter dem Operationsmikroskop zu arbeiten und den Patienten gläsern zu machen, also in Gewebe hineinzuschauen.
Präoperative Embolisation
Meningeome sind meist gut durchblutete Tumoren. Darum ist es sehr wichtig, dass die entsprechende Blutversorgung über sogenannte Feeder während der Operation rasch gekappt wird. In ausgewählten Fällen, zum Beispiel bei gewissen Schädelbasismeningeomen, ist der arterielle Tumorfeeder nicht schnell zu erreichen, so dass vor der eigentichen Operation eine endovaskuläre Embolisation des Tumors angewendet werden kann. Dieser künstliche Verschluss der Blutgefässe vor dem Eingriff kann in speziellen Fällen die operative Sicherheit erhöhen.
Bestrahlung
Bei Patienten mit einem behandlungsbedürftigen Meningeom, das nicht oder nur teilweise operierbar ist, ist die Strahlentherapie eine Behandlungsoption mit guter Tumorgrössenkontrolle. Die Strahlentherapie wird ausserdem unterstützend bei höhergradigen Meningeomen oder inkompletter Resektion eingesetzt. Die Meningeome dürfen dafür allerdings eine bestimmte Grösse nicht überschritten haben.
Radionuklidtherapie
In schwierigen Fällen mit progressivem Krankheitsfortschreiten trotz Operation und Bestrahlung bietet die Radionuklidtherapie eine weitere Therapiemöglichkeit. Dabei werden die Tumoren gezielt mit radioaktiven Medikamenten angegriffen. Das Radiopharmakon, die radioaktive Substanz, bindet an spezielle Rezeptoren auf der Oberfläche des Meningeoms, die Somatostatin-Rezeptoren, und erzielt dort eine lokale Strahlenwirkung und zerstört so die Tumorzellen.
Therapie-Komplikationen
Die Komplikationsrate bei einer chirurgischen Tumorentfernung und einer eventuellen weiteren Bestrahlung wird durch etliche Faktoren wie Grösse. Lage und Zugänglichkeit des Tumors sowie den klinischen Zustand und das Alter des Patienten beeinflusst. Normalerweise liegt das Risiko für schwere Komplikationen bei einer «normalen» Meningeom-Operation bei weniger als 2 %. Bei komplizierten Tumoren ist es höher. Wir besprechen gerne anhand Ihrer MRI-Untersuchung persönlich Ihr individuelles Risikoprofil.
Wie ist die Prognose nach der Operation?
Die Prognose hängt in erster Linie von der Lage, Grösse und feingeweblichen Beschaffenheit (WHO-Grad I–III) des Tumors ab. Ein wichtiger Faktor ist hier auch, ob der Tumor vollständig oder nur teilweise entfernt werden konnte. Je nach Ausmass der operativen Entfernung und den Ergebnissen der histologischen Analyse wird als Richtlinie und im Einzelfall abhängig von molekularen Biomarkern folgendes Prozedere empfohlen:
WHO-Grad I und Totalresektion
Eine Kontrolle nach der Operation, je nach Risiko eine weitere Kontrolle nach 2,5 und 10 Jahren
WHO-Grad I und unvollständige Resektion
Verlaufskontrollen jährlich und/oder Radiochirurgie
WHO-Grad II und Totalresektion
Verlaufskontrollen mittels MRI alle 6–24 Monate, ggf. Nachbestrahlung
WHO-Grad II und unvollständige Resektion
Verlaufskontrollen jährlich und/oder Radiochirurgie
WHO-Grad III
Nachbestrahlung, ggf. Radionuklidtherapie oder experimentelle Chemotherapie, sowie MRI-Verlaufskontrollen alle 3–6 Monate