Tremor oder auch Zittern ist eine der häufigsten Bewegungsstörungen. Das Zittern kann so stark ausgeprägt sein, dass die Lebensqualität von Betroffenen in grossem Masse beeinträchtigt ist. Es ist Tremor-Patienten oft nicht möglich, ganz alltägliche Dinge auszuführen, wie beispielsweise aus einem Glas zu trinken, sich zu rasieren, leserlich zu schreiben usw. Für diese schwerwiegenden Einschränkungen gibt es verschiedene Therapiemöglichkeiten. Viele Tremorformen sprechen beispielsweise hervorragend auf die Tiefe Hirnstimulation an. Im Folgenden gehen wir auf die einzelnen Tremorerkrankungen und die Therapieempfehlungen unserer Spezialisten am Inselspital näher ein.
Tiefe Hirnstimulation
Operationsablauf
Funktionsweise
Anwendungsmöglichkeiten
Was ist ein Tremor?
Als Tremor wird ein unwillkürliches, rhythmisches Schwingen von einem oder mehreren Körperteilen bezeichnet. Betroffen sein können dabei die Hände, Arme, Beine oder auch Stimmbänder. Wichtig ist, dass es sich beim Tremor nur um ein Symptom handelt. Die Ursachen für das Zittern können sehr unterschiedlich sein. Deshalb ist auch eine Klassifizierung so schwierig *.
Welche Tremorformen gibt es?
Der Tremor kann verschiedene Körperteile betreffen. Entsprechend spricht man dann jeweils von einem Handtremor, Armtremor, Beintremor oder Kopftremor. Sogar die Stimmbänder können betroffen sein. Der Stimmtremor führt zu einer zittrigen, teilweise schwer verständlichen Stimme.
Auch kann das Zittern in einigen Situationen auftreten und in anderen abwesend sein. Man unterscheidet hier unter anderem einen Ruhetremor, der bei körperlicher Entspannung auftritt, von einem Aktionstremor, der sich bei gezielten Bewegungen zeigt.
Der Arzt kann anhand der Kombination der Tremormerkmale und weiteren neurologischen Befunden den Tremor zu einem Tremor-Syndrom zusammenfassen. Diese Unterscheidung ist im Hinblick auf die weiteren Therapiemöglichkeiten sehr wichtig, da die einzelnen Tremorformen sehr unterschiedlich auf verschiedene Behandlungsformen ansprechen.
Einige Tremorformen sprechen sehr gut auf eine chirurgische Therapie an. Im Folgenden gehen wir auf diese Unterformen etwas genauer ein:
Essentieller Tremor
Diese häufige Tremorerkrankung (ca. 4–5 % der über 65-Jährigen sind betroffen) kann schon in der Jugendzeit oder aber auch erst im Alter auftreten, meistens jedoch beginnt die Erkrankung ab dem 40. Lebensjahr. In etwas mehr als der Hälfte der Fälle geht man von einer genetischen Ursache aus, da eine familiäre Häufung vorliegt oder ein Elternteil ebenfalls an einem Tremor erkrankt ist. Allerdings konnte noch kein verantwortliches Gen identifiziert werden.
Der essentielle Tremor verläuft in der Regel progredient, das heisst er wird mit der Zeit immer stärker. Er zeigt sich klinisch vorwiegend als Halte- und Aktionstremor. So sind typischerweise die Arme und Hände beim entspannten Sitzen ruhig und zittern nicht. Sobald jedoch zielgerichtete Bewegungen mit Armen und Händen ausgeführt werden oder die betroffenen Körperteile gehalten werden, kommt es zu einem mittelfrequenten Zittern (5–8 Hz). Betroffen sind in der Regel beide Körperseiten. Etwas mehr als die Hälfte der Betroffenen beschreibt eine Verringerung der Tremorstärke nach Alkoholkonsum.
Unsere Abbildung zeigt eine schematische Übersicht der an der Tremorentstehung beteiligten Strukturen. Eine zentrale Rolle nehmen dabei das Kleinhirn, der Thalamus und die Kerne des Hirnstamms ein sowie die Faserzüge, die diese Gebiete miteinander verbinden, wie zum Beispiel der dentatorubrothalamische Trakt.
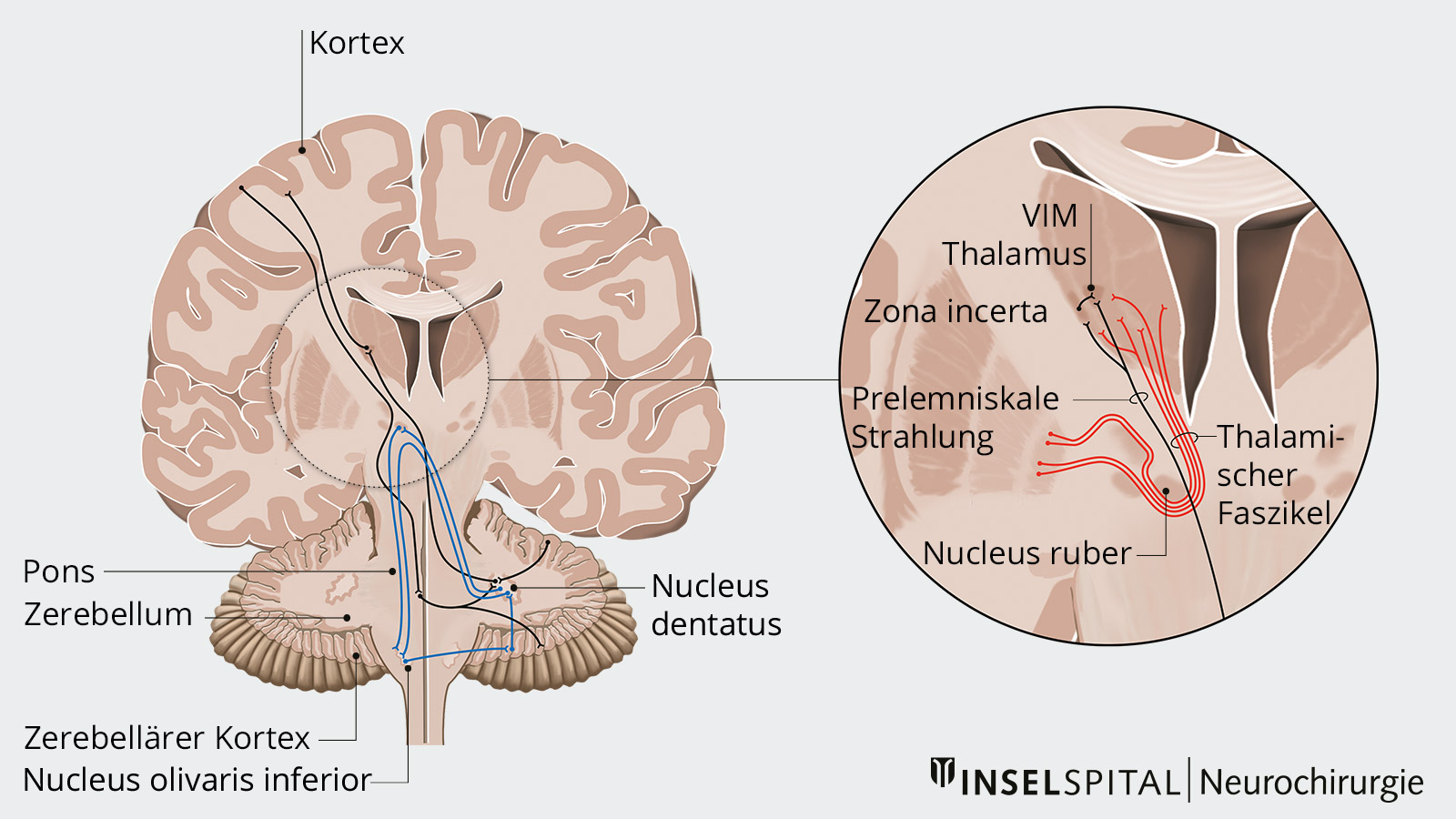
Parkinson-Tremor
Der Tremor bei Parkinson-Patienten ist typischerweise ein Ruhetremor. Dieser kommt sonst fast nur noch beim Holmes-Tremor und beim dystonen Tremor vor. Das Vorliegen eines klassischen, unilateralen (eine Körperseite betreffenden), niedrigfrequenten Ruhetremors ist eines der zuverlässigsten Kriterien für die Diagnose von Morbus Parkinson, denn über 90 % der Parkinson-Patienten leiden an genau dieser Form des Tremors. Seltener kommen bei Parkinson ein Ruhe- und Haltetremor vor.
Holmes-Tremor
Diese Tremorform ist klinisch definiert als Ruhe- und Intentionstremor langsamer Frequenz bei Patienten mit Hirnläsion. Der Zeitraum von der ursächlichen Hirnläsion bis zum Auftreten erster Symptome kann mehrere Wochen bis Jahre umfassen. Als Intentionstremor bezeichnet man einen Tremor, der bei einer zielgerichteten Bewegung auftritt. Am leichtesten lässt sich das an den Händen beim Ergreifen eines Gegenstands beobachten, da der Tremor immer stärker wird, je näher die Hand dem Gegenstand kommt. Die häufigsten Ursachen für einen Holmes-Tremor sind die multiple Sklerose, Hirntraumen und ischämische Hirnläsionen.
Dystoner Tremor
Dieser Tremor variabler Frequenz (um 3–7 Hz) betrifft eine Extremität oder ein Körperteil, die zumindest minimale Zeichen einer Dystonie aufweisen. Ruhe-, Halte- und Aktionstremor sind selten. Diagnostische Schwierigkeiten bereiten Fälle, bei denen der Tremor der Dystonie vorausgeht.
Welche Therapiemöglichkeiten gibt es?
Die Therapie des Tremors richtet sich ganz entscheidend nach der zugrundeliegenden Erkrankung. Diagnosestellung und Therapie erfolgen durch Neurologen mit Erfahrung im Bereich der Bewegungsstörungen. Die entsprechenden Experten am Inselspital finden sich am Zentrum für Parkinson und Bewegungsstörungen (ZfPB).
Medikamentöse Therapie
Die medikamentöse Therapie ist die Therapie der ersten Wahl. *
- Der essentielle Tremor sollte anfangs medikamentös mit Primidon oder Propranolol, einem Betablocker, oder einer Kombination aus beiden erfolgen. Wirkung und Nebenwirkungen limitieren den Einsatz. Topiramat und Gabapentin haben bei manchen Patienten einen guten Erfolg und sollten als Zweitlinientherapie eingesetzt werden.
- Der Parkinson-Tremor bessert sich in der Regel mit einer guten dopaminergen Therapie zur Behandlung von Akinese und Rigor. Bleibt der Tremor unverändert bestehen, können Anticholinergika (z. B. Biperiden), Propranolol oder Clozapin ausprobiert werden.
- Es gibt keine etablierte medikamentöse Therapie für den Holmes-Tremor, und die medikamentöse Behandlung bei Holmes-Tremor ist bisher selten erfolgreich. In Einzelfällen wird ein Erfolg von L-Dopa, Levetirazetam, Clonazepam und Clozapin beobachtet.
- Es gibt auch keine etablierte medikamentöse Therapie für den dystonen Tremor. Die medikamentöse Behandlung basiert auf Expertenmeinungen. Vorgeschlagen werden Trihexyphenidyl, Propranolol, Lioresal und Clonazepam.
Tiefe Hirnstimulation oder Läsionsverfahren – moderne Optionen bei Tremor
Wenn Medikamente keine ausreichende Linderung bringen oder aufgrund von Unverträglichkeiten nicht einsetzbar sind, kann eine funktionelle neurochirurgische Behandlung in Betracht gezogen werden.
Grundsätzlich stehen zwei chirurgische Verfahren zur Verfügung:
- Die Tiefe Hirnstimulation (DBS)
- Läsionsverfahren, wie z. B. die Thalamotomie mittels fokussiertem Ultraschall (MRgFUS)
Die Tiefe Hirnstimulation (DBS) zählt heute zu den wirksamsten und flexibelsten Behandlungsmethoden bei essentiellem Tremor und Parkinson-Tremor. *, *, * Dabei werden Elektroden in bestimmte Hirnregionen implantiert, deren elektrische Stimulation die Tremorsymptome gezielt unterdrücken kann. Der grosse Vorteil: Die Stimulation lässt sich individuell einstellen und ist – anders als eine Läsion – jederzeit anpassbar und umkehrbar. Nebenwirkungen wie Sprech- oder Gleichgewichtsstörungen treten bei DBS seltener auf und sind meist reversibel.
Der motorische Thalamus (VIM) und das posteriore subthalamische Areal (PSA) sind etablierte anatomische Zielpunkte zur erfolgreichen Behandlung des essentiellen Tremors. Hier konnte die Überlegenheit der DBS gegenüber einer Läsion des motorischen Thalamus, der sogenannten Thalamotomie, in einer randomisierten Studie nachgewiesen werden *. Zwar ist der tremorunterdrückende Effekt bei beiden Behandlungsformen vergleichbar, jedoch unterscheiden sich beide Therapieverfahren in Bezug auf die Nebenwirkungen. Nebenwirkungen wie Sprechstörungen (Dysarthrie), Gangunsicherheit, Gefühlsstörungen und kognitive Einschränkungen sind bei der DBS signifikant seltener und in den meisten Fällen auch reversibel.
Am Inselspital ist die Tiefe Hirnstimulation in der Regel die etablierte Behandlungsform. In ausgewählten Fällen kann jedoch auch die Thalamotomie eine sinnvolle Alternative darstellen *. Auch bei der Thalamotomie, etwa mittels fokussiertem Ultraschall (MRgFUS), lassen sich gute Ergebnisse erzielen. Sie bietet eine nicht-invasive Behandlungsoption, die insbesondere für Patienten infrage kommt, bei denen eine Operation nicht möglich oder nicht gewünscht ist. Allerdings sind die Effekte dauerhaft und eventuelle Nebenwirkungen nicht mehr rückgängig zu machen.
Welche Methode die für Sie richtige ist, klären wir gemeinsam mit Ihnen in einer umfassenden ärztlichen Beurteilung.
Wie wird die Tiefe Hirnstimulation bei Tremor eingesetzt?
Beim Parkinson-Patienten können prinzipiell drei Zielstrukturen im Gehirn erfolgreich stimuliert werden und müssen individuell für jeden Patienten im Expertenkomitee diskutiert werden:
- Die Stimulation im Bereich des nucleus subthalamicus wird am häufigsten gewählt, weil durch die Stimulation auch die Akinese und der Rigor erfolgreich behandelt und so die Medikamentendosierung meistens beachtlich reduziert werden kann. Potenzieller Nachteil ist die Verschlechterung einer vorbestehenden Rumpfinstabilität, die sogenannte posturale Instabilität.
- Nach Studienlage aktuell als gleichwertig zu betrachten ist die GPi-Stimulation *.
- In den seltenen Fällen von reiner Tremordominanz des Parkinson-Patienten im höheren Lebensalter wird die Stimulation im motorischen Thalamus (VIM) oder des posterioren subthalamischen Areals (PSA) eingesetzt. Der Grund dafür ist, dass Patienten nach VIM-Stimulation einen rascheren und komplikationsärmeren Wirkungseintritt haben und bei sehr langsamer Progression im hohen Alter die Spätstadien meist nicht mehr erleben.
Weniger klar ist die Datenlage bei anderen Tremorformen wie dem Holmes-Tremor und dem dystonen Tremor. Fallbeschreibungen und Fallserien legen beim Holmes-Tremor eine gute Tremorreduktion von durchschnittlich über 70 % nahe *, beim dystonen Tremor sind die Ergebnisse weniger gut *. Die Möglichkeiten der Tiefen Hirnstimulation bei Patienten mit schwer ausgeprägten Formen dieser Tremorarten sollten in jedem Fall interdisziplinär diskutiert werden.
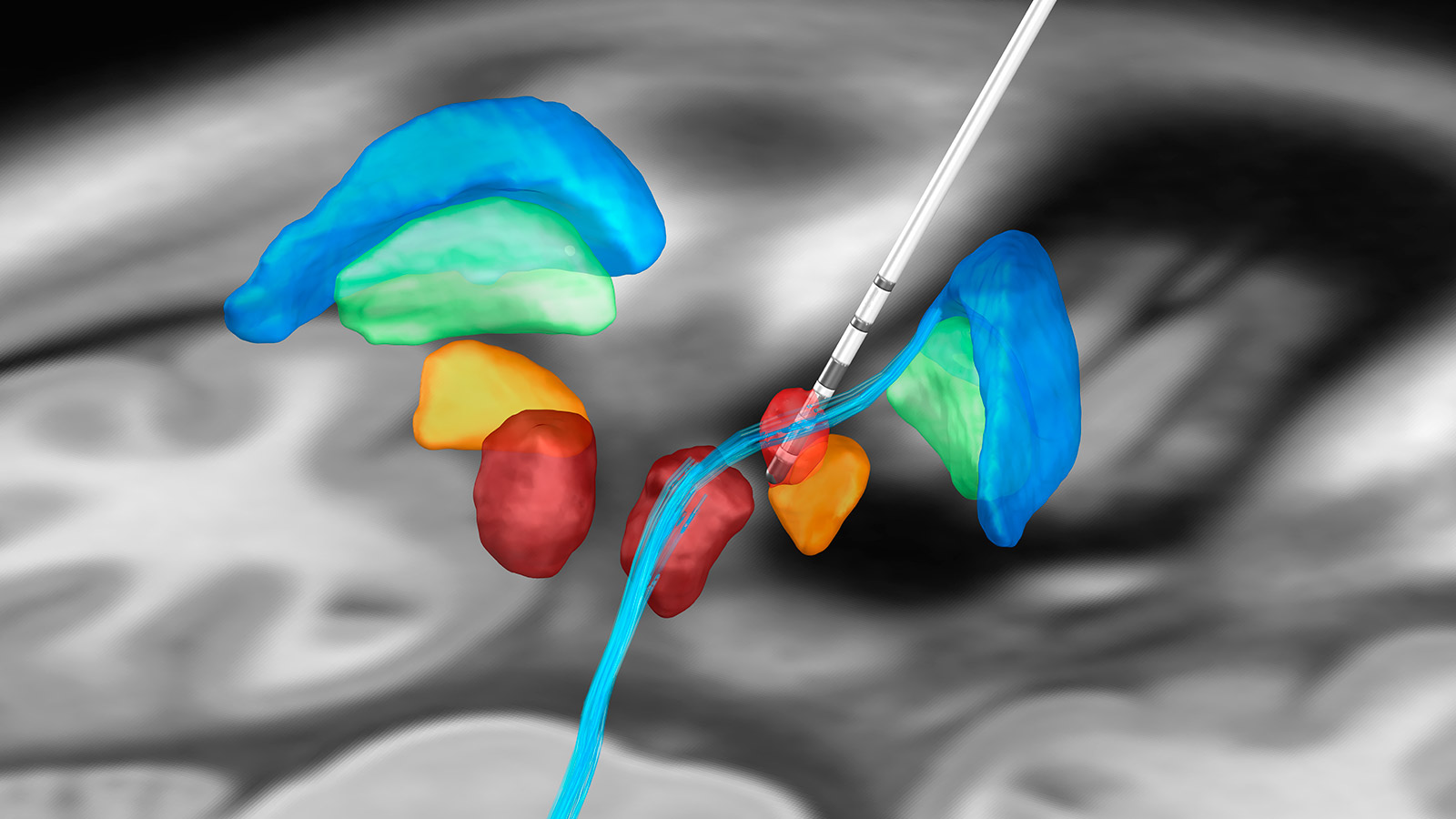
Nach Analyse unserer veröffentlichten Ergebnisse aus dem Jahr 2018 erreichen wir am Inselspital eine durchschnittliche Tremorreduktion von 55–72 % je nach zugrunde liegender Erkrankung und Tremorsubtyp *, *.
Welche Nebenwirkungen sind bei der Tiefen Hirnstimulation zu erwarten?
Grundsätzlich gelten dieselben Nebenwirkungen wie bei allen stereotaktischen funktionellen DBS-Verfahren. Spezifische Risiken bei der PSA-Stimulation zur Behandlung eines Tremors können muskuläre Zuckungen oder Verkrampfungen, Sprechstörungen oder sensible Missempfindungen sein. Die Sprechstörungen sind dabei die häufigste Nebenwirkung. In der Regel sind diese stimulationsinduzierten Nebenwirkungen allerdings reversibel.
Patientenerfahrungen
«Ich habe ein neues Leben bekommen.»
«Die Verbesserungen sind drastisch.»
Warum Sie sich am Inselspital behandeln lassen sollten
Wie bei anderen Erkrankungen auch wird die Indikation zu DBS generell interdisziplinär von Neurologen und Neurochirurgen gestellt. Im Vorfeld erfolgen aufwändige Untersuchungen wie neurologische Untersuchungen, neuropsychologische Tests, eine psychiatrische Beurteilung sowie eine chirurgische Beurteilung. Dies soll sicherstellen, dass nur Patienten mit sehr guten Aussichten auf eine Verbesserung ihrer Beschwerden für den Eingriff ausgewählt werden. Am Inselspital werden dazu Patientenfälle individuell von unserem interdisziplinären Board für Bewegungsstörungen diskutiert, um jedem einzelnen Patienten die besten Therapieoptionen anbieten zu können.
Die DBS-Operation selbst ist ein technisch sehr aufwändiges Verfahren, das nur in wenigen spezialisierten Zentren angeboten wird. Mit etwas über 40 Eingriffen dieser Art pro Jahr ist das Inselspital schweizweit führend. Unsere Spezialisten verfügen über die nötige Expertise und Erfahrung, um diese sehr komplexe moderne Operationstechnik erfolgreich durchführen zu können. Uns ist dabei wichtig, dass trotz aller modernen Technik und innovativer Verfahren der Patient und seine individuellen Bedürfnisse stets im Mittelpunkt stehen.
Referenzen
-
Deuschl, G., Bain, P. & Brin, M. Consensus statement of the Movement Disorder Society on Tremor. Ad Hoc Scientific Committee. Movement disorders : official journal of the Movement Disorder Society 1998;13 Suppl 3, 2-23.
-
Deuschl, G. et al. A randomized trial of deep-brain stimulation for Parkinson's disease. The New England journal of medicine. 2006;355, 896-908.
-
Odekerken, V. J. et al. Subthalamic nucleus versus globus pallidus bilateral deep brain stimulation for advanced Parkinson's disease (NSTAPS study): a randomised controlled trial. Lancet neurology 2013;12, 37-44.
-
Limousin, P., Speelman, J. D., Gielen, F. & Janssens, M. Multicentre European study of thalamic stimulation in parkinsonian and essential tremor. Journal of neurology, neurosurgery, and psychiatry 1999;66, 289-296.
-
Schuurman, P. R. et al. A comparison of continuous thalamic stimulation and thalamotomy for suppression of severe tremor. The New England journal of medicine 2000;342, 461-468.
-
Elias, W. J. et al. A Randomized Trial of Focused Ultrasound Thalamotomy for Essential Tremor. The New England journal of medicine 2016;375, 730-739.
-
Fiechter, M. et al. Deep Brain Stimulation for Tremor: Is There a Common Structure? Stereotactic and functional neurosurgery 2017;95, 243-250.
-
Nowacki, A. et al. Targeting the posterior subthalamic area for essential tremor: proposal for MRI-based anatomical landmarks. Journal of neurosurgery 2018;1-8.
-
Odekerken, V. J. et al. Subthalamic nucleus versus globus pallidus bilateral deep brain stimulation for advanced Parkinson's disease (NSTAPS study): a randomised controlled trial. Lancet neurology 2013;12, 37-44.
-
Mendonca, M. D., Meira, B., Fernandes, M., Barbosa, R. & Bugalho, P. Deep brain stimulation for lesion-related tremors: A systematic review and meta-analysis. Parkinsonism & related disorders 2018;47, 8-14.
-
Cury, R. G. et al. Thalamic deep brain stimulation for tremor in Parkinson disease, essential tremor, and dystonia. Neurology 2017;89, 1416-1423
