Die Tiefe Hirnstimulation (auch DBS von engl. deep brain stimulation) ist ein modernes Therapieverfahren aus dem Bereich der funktionellen Neurochirurgie, also jenem Teilbereich der Neurochirurgie, der pathologische Hirnfunktionen moduliert, um Symptome neurologischer Erkrankungen zu lindern. Die Forschung der letzten 30 Jahre konnte zeigen, dass mit Hilfe der DBS viele Erkrankungen erfolgreich therapiert werden können. Am Inselspital wird eine DBS routinemässig in Vollnarkose und nicht als Wachoperation durchgeführt. Voraussetzung dafür sind allerdings ein hohes Mass an Expertise und viel Erfahrung bei den behandelnden Ärztinnen und Ärzten.
Tiefe Hirnstimulation
Operationsablauf
Funktionsweise
Anwendungsmöglichkeiten
Wie läuft eine DBS-Operation ab?
Patientenselektion
Vor der eigentlichen Operation ist eine sehr gute Patientenselektion die Voraussetzung für den Therapieerfolg. Nicht alle Patienten sind für eine DBS-Operation geeignete Kandidaten. Die Indikation muss interdisziplinär von Neurologen, Neurochirurgen, Neuropsychologen und Psychiatern diskutiert und gemeinsam gestellt werden. Alle potenziellen Kandidaten werden am Inselspital im Rahmen eines solchen interdisziplinären Boards besprochen. Hierbei werden die Indikation, Vor- und Nachteile gewisser Behandlungsalternativen zur DBS (fokussierter Ultraschall), der genaue Zielpunkt mit den zu erwartenden Wirkungen und Nebenwirkungen im Kontext mit dem jeweiligen Erkrankungsbild des Patienten und seinen individuellen Bedürfnissen diskutiert. Kriterien wie die Operabilität und andere Begleitfaktoren (z. B. neuropsychologische Befunde, psychiatrische Begleiterkrankungen) werden dabei auch berücksichtigt.
Voruntersuchungen
Alle Patienten erhalten im Vorfeld der Operation ein qualitativ hochwertiges MRI des Kopfes. Anhand der MRI-Bilder wird der präzise anatomische Zielpunkt für die DBS identifiziert.
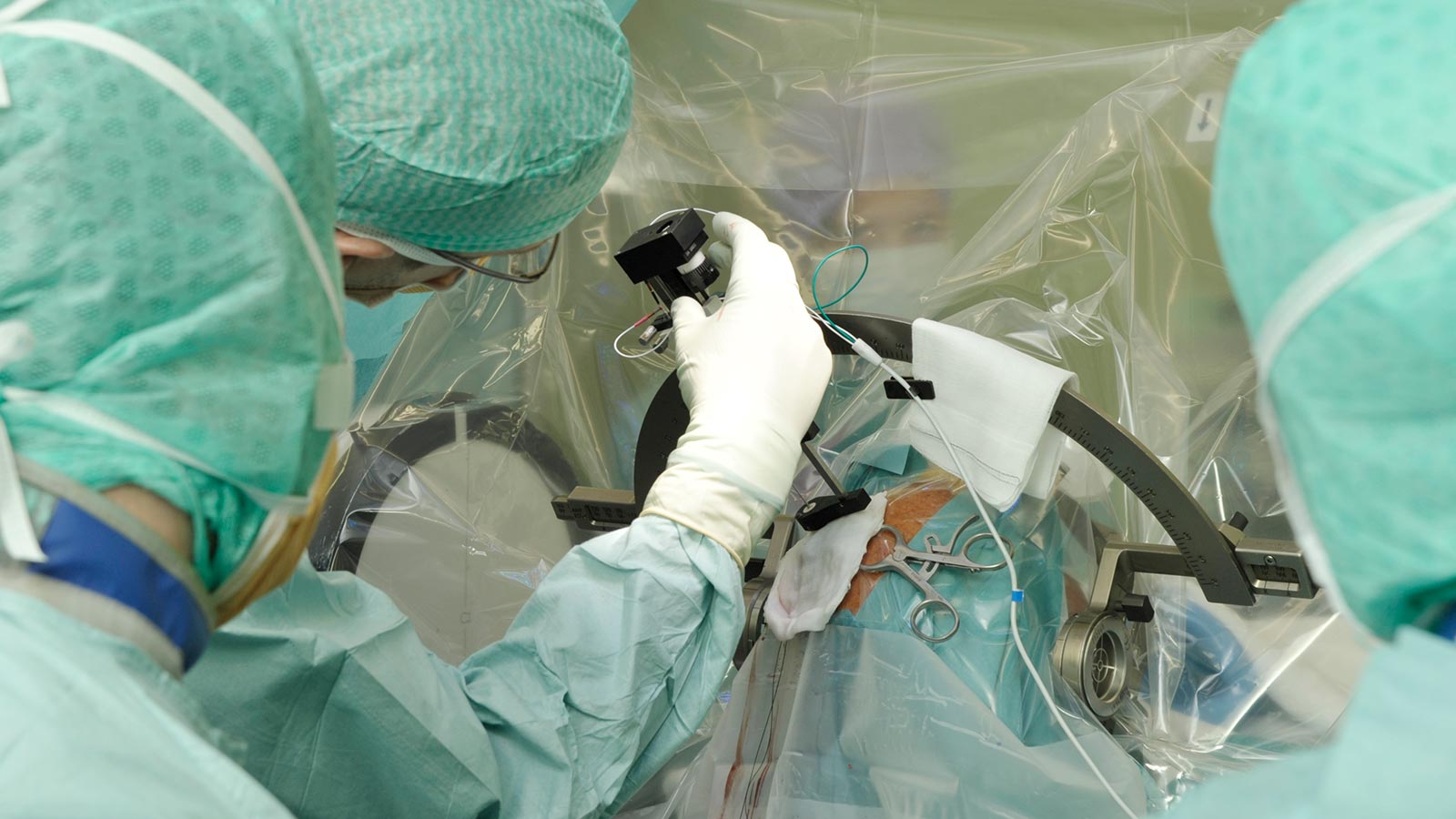
Stereotaxie
Die Operation erfolgt in den meisten Fällen mit einem Stereotaxierahmen. Bei der stereotaktischen Methode erfolgt die fixe Anlage des Stereotaxierahmens an den Schädel des Patienten in der Regel unter Lokalanästhesie. Der Rahmen enthält ein Koordinatensystem, das für die zielgenaue Einführung der Elektroden von Bedeutung ist.
Nach Anlage des Stereotaxierahmens erfolgt eine Bildgebung des Kopfes, meistens eine Computertomografie (CT). Dieses «Stereotaxie-CT» wird mittels Software passgenau auf das MRI des Patienten überlagert und dient dazu, jeden Punkt im Gehirn (auf dem MRI selektiert) gewissen spezifischen Koordinaten am Rahmen zuzuordnen. Diese Koordinaten können am Rahmen später eingestellt werden und ermöglichen das millimetergenaue Einführen der Elektroden an den gewünschten Zielpunkt.
Nach Durchführung des CT begibt sich der Patient in Begleitung des Chirurgen und Betreuers in den Operationssaal, wo die Operation unter streng sterilen Bedingungen durchgeführt wird.
Am Inselspital: Tiefe Hirnstimulation routinemässig in Vollnarkose
Die Vorteile sind:
- Sehr präzises Implantieren der Elektrode
- Keine belastende Wachoperation
- Kürzere Operationsdauer
- Schonenderer Eingriff für unsere Patienten
- Kein Absetzen der Parkinson-Medikamente vor der Operation
Die Umstellung von Wachoperation auf einen Eingriff in Vollnarkose basiert auf der Erfahrung von grossen internationalen Zentren sowie wissenschaftlich publizierten Ergebnissen *. Bereits seit 2021 empfehlen und praktizieren wir die Implantation von Elektroden sowie Schrittmacher in Vollnarkose. Die Resultate der Operation in Narkose sind nach unseren Erfahrungen genauso gut oder sogar noch besser als bei Operationen im Wachzustand. Voraussetzung dafür sind allerdings ein hohes Mass an Expertise und viel Erfahrung bei den behandelnden Ärztinnen und Ärzten. Wir haben auch festgestellt, dass alle unsere Parkinson-Patienten die Operation unter Vollnarkose bevorzugen.
Möglich wurde dieses innovative Vorgehen durch:
- die Verbesserung der modernen Bildgebung, die ein präzises Implantieren der Elektrode auch in Vollnarkose ermöglicht
- die technologische Weiterentwicklung der implantierten Systeme (segmentierte Elektroden)
Wie bei einer Wach-OP auch werden während der Operation unter Vollnarkose elektrophysiologische Signale des Gehirns abgeleitet und eine intraoperative Teststimulation zur Testung der Nebenwirkungen durchgeführt. So kann die millimetergenaue Platzierung der Elektrode präzise überprüft werden. Bei fehlender Ableitung von Hirnsignalen und/oder raschem Eintreten von Nebenwirkungen wird die Elektrode neu platziert und erneut getestet.
Insofern medizinisch indiziert, kann der Eingriff in Einzelfällen auch im wachen Zustand durchgeführt werden. Dies wird das Behandlungsteam mit Ihnen im Vorfeld detailliert besprechen und auch die Abläufe bei einer Wachoperation erklären, falls diese notwendig sein sollte. Bei Patienten mit starker Dystonie muss der Eingriff allerdings immer unter Vollnarkose durchgeführt werden.
Patientenerfahrungen
«Ich habe ein neues Leben bekommen.»
«Die Verbesserungen sind drastisch.»
Welche Erkrankungen können mit DBS behandelt werden?
Die häufigsten Indikationen für die DBS betreffen den Bereich der Bewegungsstörungen *, *, *. Aber auch bei schweren Formen von Zwangsstörungen, die nicht auf die Standardtherapie ansprechen, kommt die DBS als Behandlungsalternative zum Einsatz. Sie ist ebenfalls eine Therapieoption bei chronischen Schmerzsyndromen. Darüber hinaus wird die DBS aktuell erforscht und klinisch geprüft als Option zur Behandlung anderer schwerer Erkrankungen.
Bewegungsstörungen
- idiopathisches Parkinson-Syndrom
- Tremorerkrankungen
- Dystonien
Zwangsstörungen
Chronische Schmerzsyndrome
Aktuelle Forschung
- Alzheimer-Demenz
- Anorexie
- Chorea-Huntington
- Multisystematrophie (MSA) u. v. m.
Die DBS bleibt auch weiterhin Gegenstand intensiver Grundlagen- und klinischer Forschung. Die Anzahl der Erkrankungen, für die die DBS sich als potenziell wirksame Therapiemassnahme herausstellt, wächst stetig an. Auch die stetige technische Weiterentwicklung der Neuro-Stimulatoren und Stimulationselektroden sowie die Verbesserung bildgebender Verfahren in der Medizin tragen zum immensen Entwicklungspotenzial dieses Behandlungsverfahrens bei.
Aktuelle DBS-Forschung am Inselspital
Segmentierte DBS-Elektroden für die direktionelle Stimulation
Bisher bestanden die auf dem Markt erhältlichen DBS-Elektroden aus 4 Ringkontakten, die entlang der vertikalen Achse der Elektrode angeordnet waren und ein eher kugelförmiges elektrisches Feld um die Elektrode (360°) erzeugten. Pionierarbeiten unserer Arbeitsgruppe führten zur Entwicklung einer segmentierten Elektrode, die eine gerichtete Stimulation ermöglicht. Anstatt ein kugelförmiges, sich in alle Richtungen ausbreitendes elektrisches Feld zu generieren, ermöglichen segmentierte Elektroden eine im Raum gezieltere Ausrichtung des elektrischen Felds. Dies hilft uns, dass Strukturen mit einem positiven klinischen Effekt (z. B. Tremorunterdrückung bei Parkinson oder essentiellem Tremor) gezielter stimuliert werden können. Gleichzeitig können Strukturen, deren Stimulation mit unerwünschten Nebenwirkungen einhergeht (z. B. Missempfindungen oder Sprechstörungen) besser vermieden werden. Erste Studien konnten belegen, dass dieses theoretische Konzept auch in der Praxis funktioniert *, *.
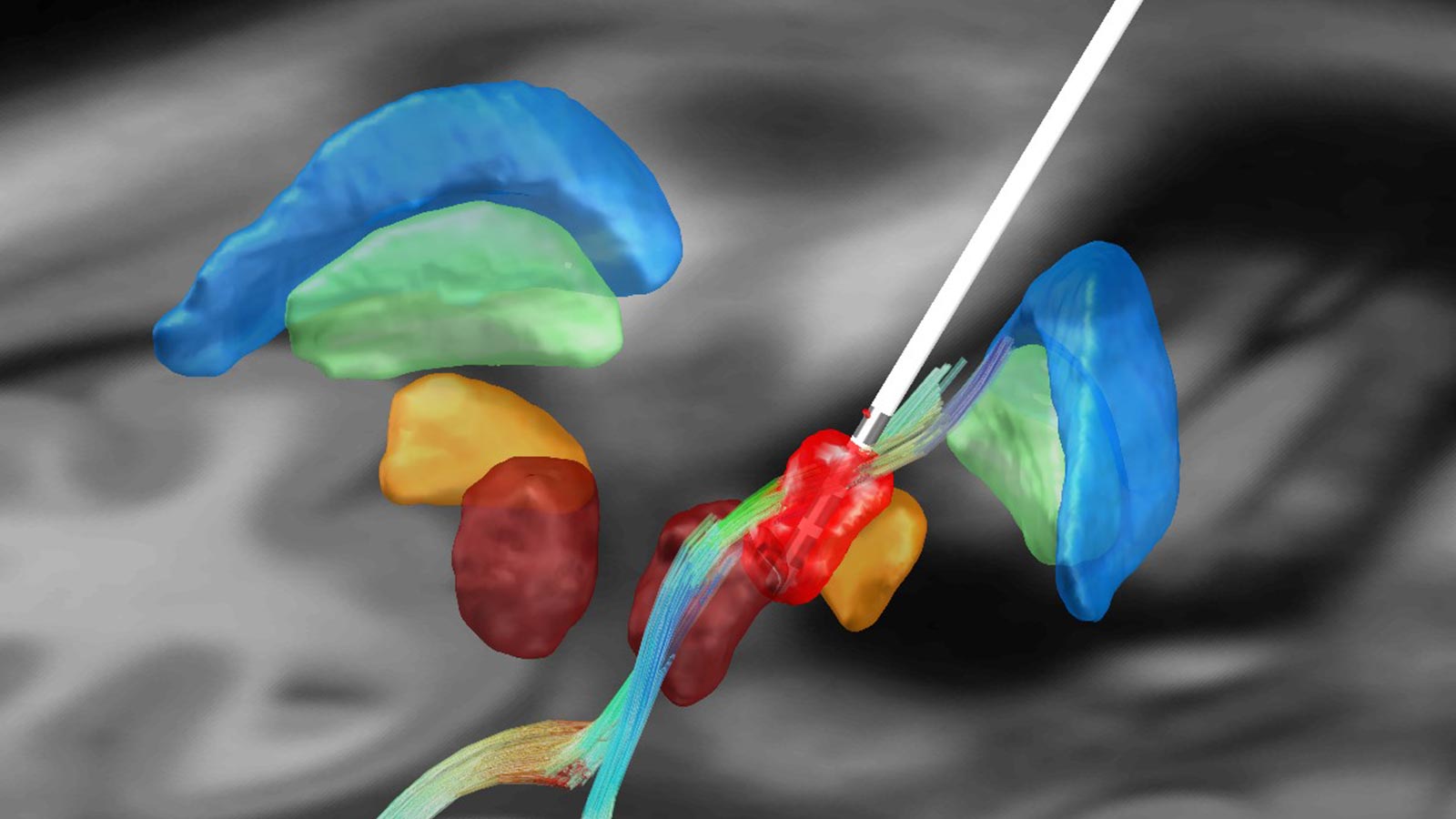
Patientenspezifische Planung mittels Traktografie bei Tremor
Bei der Tiefen Hirnstimulation ist der klassische Zielpunkt zur Behandlung von Tremor der motorische Thalamus (Nucleus ventralis intermedius oder VIM). Auf konventionellen MRI-Aufnahmen sind die Thalamuskerne allerdings nicht voneinander abgrenzbar und identifizierbar. Daher kombiniert man zur Planung des VIM die MRI-Bildgebung des Patienten mit klassischen stereotaktischen Koordinaten, die sich als historisch effektive Mittelwerte zur Anpeilung des VIM geeignet haben.
Moderne bildgebende Verfahren, insbesondere die Diffusionsbildgebung (DWI), ermöglichen eine näherungsweise Darstellung anatomischer Faserbündel. Diese auf mathematischen Modellen beruhenden Bildgebungsverfahren sind allgemein bekannt als diffusion tensor imaging (DTI oder Diffusions-Tensor-Bildgebung). Forschungsarbeiten von anderen Arbeitsgruppen sowie unserer eigenen Arbeitsgruppe legen nahe, dass die Stimulation des sogenannten cerebellothalamischen Trakts (CTT) bzw. des dentatorubrothalamischen Trakts (DRTT) für den tremorsupprimierenden Effekt verantwortlich ist *, * *, *.
Ermöglicht durch moderne bildgebende Verfahren wie DWI/DTI können die Faserbahnen mittels dem Verfahren der Traktografie modelliert werden. Eine individuelle, patientenspezifische Planung des optimalen Zielpunkts zur Behandlung des Tremors wird so möglich.
Vereinfachung der postoperativen Programmierung
Die Entwicklung einer neuen Generation von segmentierten Elektroden, die es ermöglichen, das elektrische Feld gezielt in eine gewünschte Richtung auszurichten, ist vielversprechend, was die Ausweitung der therapeutischen Möglichkeiten angeht. Erste Pilotstudien belegen dies. Allerdings stellen die zusätzlichen Möglichkeiten der Programmierung dieser Elektroden auch grosse Anforderungen an den behandelnden Arzt und den Patienten. Der empirische Ansatz beim Finden der besten Stimulationsparameter ist äusserst zeitaufwendig und kann mehrere Stunden pro Testung in Anspruch nehmen.
Einer unserer Forschungsschwerpunkte ist daher die Entwicklung einer automatisierten Programmierung der DBS-Elektroden. Dabei sollen bildgebende Verfahren zur Analyse der Elektrodenpositionen in Bezug zu den umgebenden anatomischen Strukturen sowie elektrophysiologische Verfahren zur Detektierung symptomspezifischer Potenziale kombiniert werden, um eine klinisch effektive Stimulation vorherzusagen *.
Referenzen
-
Gross RE, Krack P, Rodriguez-Oroz MC, Rezai AR, Benabid AL. Electrophysiological mapping for the implantation of deep brain stimulators for Parkinson’s disease and tremor. Mov Disord. 2006;21 Suppl 14:S259-83.
-
Hariz MI. Safety and risk of microelectrode recording in surgery for movement disorders. Stereotact Funct Neurosurg. 2002;78:146-157.
-
Kocabicak E, Alptekin O, Ackermans L et al. Is there still need for microelectrode recording now the subthalamic nucleus can be well visualized with high field and ultrahigh MR imaging? Front Integr Neurosci. 2015;9:46.
-
Nowacki A, Debove I, Fiechter M et al. Targeting Accuracy of the Subthalamic Nucleus in Deep Brain Stimulation Surgery: Comparison Between 3 T T2-Weighted Magnetic Resonance Imaging and Microelectrode Recording Results. Oper Neurosurg (Hagerstown). 2018;15:66-71.
-
Deuschl G, Schade-Brittinger C, Krack P et al. A randomized trial of deep-brain stimulation for Parkinson’s disease. N Engl J Med. 2006;355:896-908.
-
Kupsch A, Benecke R, Müller J et al. Pallidal deep-brain stimulation in primary generalized or segmental dystonia. N Engl J Med. 2006;355:1978-1990.
-
Limousin P, Speelman JD, Gielen F, Janssens M. Multicentre European study of thalamic stimulation in parkinsonian and essential tremor. J Neurol Neurosurg Psychiatry. 1999;66:289-296.
-
Pollo C, Kaelin-Lang A, Oertel MF et al. Directional deep brain stimulation: an intraoperative double-blind pilot study. Brain. 2014;137:2015-2026.
-
Steigerwald F, Müller L, Johannes S, Matthies C, Volkmann J. Directional deep brain stimulation of the subthalamic nucleus: A pilot study using a novel neurostimulation device. Mov Disord. 2016;31:1240-1243.
-
Akram H, Dayal V, Mahlknecht P et al. Connectivity derived thalamic segmentation in deep brain stimulation for tremor. Neuroimage Clin. 2018;18:130-142.
-
Coenen VA, Allert N, Paus S, Kronenbürger M, Urbach H, Mädler B. Modulation of the cerebello-thalamo-cortical network in thalamic deep brain stimulation for tremor: a diffusion tensor imaging study. Neurosurgery. 2014;75:657-69; discussion 669.
-
Nowacki A, Debove I, Rossi F et al. Targeting the posterior subthalamic area for essential tremor: proposal for MRI-based anatomical landmarks. J Neurosurg. 2018;131:820-827.
-
Nowacki A, Schlaier J, Debove I, Pollo C. Validation of diffusion tensor imaging tractography to visualize the dentatorubrothalamic tract for surgical planning. J Neurosurg. 2018;130:99-108.
-
Tinkhauser G, Pogosyan A, Debove I et al. Directional local field potentials: A tool to optimize deep brain stimulation. Mov Disord. 2018;33:159-164.
-
Holewijn RA, Verbaan D, van den Munckhof PM, Bot M, Geurtsen GJ, Dijk JM, Odekerken VJ, Beudel M, de Bie RMA, Schuurman PR. General Anesthesia vs Local Anesthesia in Microelectrode Recording-Guided Deep-Brain Stimulation for Parkinson Disease: The GALAXY Randomized Clinical Trial. JAMA Neurol. 2021 Oct 1;78(10):1212-1219.
