Morbus Parkinson oder auch einfach Parkinson zählt zu einer der häufigsten neurologischen Krankheiten. Weltweit geht man von rund 6,3 Millionen Betroffenen aus. Erkrankte leiden vor allem an Störungen des Bewegungsablaufs und der Beweglichkeit, einem störenden Ruhezittern sowie Gangstörungen. Um den Leidensdruck dieser Erkrankung zu mildern, ist es sehr wichtig, die Therapie passgenau auf die Patienten anzupassen. Im Falle einer Tiefen Hirnstimulation führen wir diese am Inselspital routinemässig in Vollnarkose durch. Voraussetzung dafür sind ein hohes Mass an Expertise und viel Erfahrung bei den behandelnden Ärztinnen und Ärzten.
Tiefe Hirnstimulation
Operationsablauf
Funktionsweise
Anwendungsmöglichkeiten
Wer ist von Parkinson betroffen?
Es gibt in der Schweiz ca. 15 000 Parkinson-Patienten. Jährlich erkranken in der Schweiz etwa 3000 Patienten neu an Parkinson. Männer sind dabei etwas häufiger betroffen als Frauen. Das durchschnittliche Erkrankungsalter liegt zwischen dem 65. und 70. Lebensjahr.
Wie entsteht Morbus Parkinson?
Man geht davon aus, dass in den meisten Fällen eine Kombination aus äusseren Umwelteinflüssen und erblichen Faktoren ursächlich für die Parkinson-Erkrankung ist. In seltenen Fällen (5–10 % der Parkinson-Patienten) ist die Erkrankung genetisch bedingt. Mutationen in bestimmten Genen (PARK 1–16) werden weitervererbt und können zur Parkinson-Erkrankung führen. Diese Form wird als monogenetische Variante bezeichnet. Betroffene Patienten erkranken meist schon vor dem 40. Lebensjahr.
Parkinson ist eine neurodegenerative Krankheit, bei der mikroskopisch ein fortschreitender Untergang von Nervenzellen in bestimmten Hirnregionen festzustellen ist. Besonders betroffen ist dabei die Substantia nigra, eine Kernstruktur im Bereich des Mittelhirns, wo der Botenstoff Dopamin, ein sogenannter Neurotransmitter, gebildet wird. Das Dopaminsignal der Substantia nigra ist wesentlich für die Verhaltenssteuerung. Es reguliert die Informationsverarbeitung in den Basalganglien – einer Ansammlung von Kernen in der Tiefe des Grosshirns –, die bei der Planung und Selektion von Verhaltensweisen und der Motorik eine zentrale Rolle spielen. Einfach ausgedrückt stösst das Dopaminsignal gewisse Aktivitäten an, während es andere hemmt, und ermöglicht so ein koordiniertes Verhalten. Zudem ist das Dopamin wichtig für das motorische Lernen und die Motivationssteuerung.
Mit dem Fortschreiten der Erkrankung sind auch Nervenzellen in anderen Regionen des Gehirns betroffen, die kein Dopamin produzieren. Dies führt zu zahlreichen Symptomen (vegetative Störungen, Schmerzen, Schlafstörungen, psychische Störungen), die für den Patienten mit dem Verlauf der Erkrankung immer belastender werden. Ein Beispiel hierfür ist der Nucleus pedunculopontinus im Hirnstamm, der wichtige Funktionen bei der Steuerung des stabilen Gehens und der Regulation von Aufmerksamkeit und Schlaf einnimmt.
Was sind typische Symptome von Parkinson?
Das Kardinalsymptom der Parkinsonerkrankung ist die Störung der Bewegungsfunktionen, die Bewegungsverlangsamung bis hin zur Unbeweglichkeit (Bradykinese, Hypokinese, Akinese). In individuell unterschiedlicher Ausprägung können weitere Hauptsymptome hinzukommen:
- Zittern (Tremor)
- Muskelsteifigkeit (Rigor)
- Haltungsinstabilität mit Fallneigung (posturale Instabilität)
Neben motorischen Symptomen können auch nichtmotorische Symptome im Rahmen der Parkinson-Erkrankung vorkommen:
- vegetative Symptome
- psychische Symptome
- kognitive Symptome
Bradykinese, Hypokinese, Akinese
Unter Bradykinese versteht man eine Verlangsamung der Willkürmotorik. Betroffene Patienten können weniger schnell zwischen verschiedenen motorischen Aufgaben oder Bewegungen wechseln und die Aktivitäten sind generell verlangsamt. Praktisch wird das Gangbild kleinschrittig, die Handschrift kleiner und weniger schwungvoll, die Sprache leiser, das Schlucken seltener etc. Zuerst bemerken Patienten dies bei Aktivitäten mit den Händen, wie zum Beispiel beim Schreiben oder beim Spielen eines Musikinstruments. Diese Symptomatik nimmt im Verlauf der Krankheit zu.
Die Bewegungsarmut bzw. verminderte Beweglichkeit bezeichnet man als Hypokinese.
Eine hochgradige Ausprägung der Symptome bis hin zur Bewegungslosigkeit wird als Akinese bezeichnet.
Tremor
Der Tremor ist typischerweise ein Ruhetremor der Extremitäten – ein Zittern ohne willkürliche Bewegung bei körperlicher Entspannung. Die typische rhythmische Tremorbewegung der Finger ähnelt der Fingerbewegung beim Pillendrehen und wird darum oft als Pillendreher-Tremor bezeichnet. Das Zittern nimmt ab, sobald die betroffenen Gliedmassen gezielt bewegt werden. Typisch ist eine Verstärkung des Tremors bei emotionaler oder geistiger Anstrengung.
Rigor
Das Parkinson-Syndrom erhöht dauerhaft den Muskeltonus während des gesamten Bewegungsablaufs. Aufgrund dieser Muskelsteifigkeit haben die Patienten den Eindruck, dass ihre Gliedmassen «wie gelähmt» sind und leiden auch oft unter schmerzhaften Krämpfen.
Posturale Instabilität
Das aufrechte Gehen und das Gleichgewicht sind gestört. Eine gerade Körperhaltung wird mit dem Fortschreiten der Erkrankung deshalb immer schwieriger. Aus diesem Grund gehören Stürze zu einer möglichen gefährlichen Folge von Parkinson.
Freezing of gait
Patienten können überdies an einer speziellen Gangstörung leiden, die mit dem englischen Ausdruck «Freezing of gait» (Einfrieren des Gangs) bezeichnet wird. Hierbei kommt es beim gehenden Parkinson-Patienten plötzlich und ohne Vorankündigung zu einer Blockade. Die Betroffenen erscheinen wie eingefroren oder erstarrt. Bedingt durch die vornübergebeugte Haltung der meisten Parkinson-Patienten kann es dabei auch zu Gleichgewichtsverlust und Stürzen kommen *.
Nichtmotorische Symptome
Obwohl Parkinson als klassische Bewegungsstörung gilt und die motorischen Symptome bei den Patienten im Vordergrund stehen, gibt es auch andere, nichtmotorische Begleitsymptome von Parkinson:
- vegetative Störungen: Störungen beim Wasserlassen, Blutdruckstörungen, Störungen der Temperaturregulation, Schlafstörungen
- psychische Störungen: Depressionen, Angstzustände
- kognitive Störungen: Verhaltensstörungen, Demenz
- sensorische Störungen: Sehstörungen, Geruchsstörungen, Sensibilitätsstörungen
Die kognitiven Schwierigkeiten manifestieren sich oftmals im fortgeschrittenen Stadium der Krankheit und enden im schlimmsten Fall in einer Demenz. Diese Parkinson-Demenz unterscheidet sich klinisch von der wohl allgemein bekanntesten Demenzform, der Alzheimer-Demenz. Während bei der Alzheimer-Demenz vor allem Gedächtnisstörungen auftreten, kommt es bei der Parkinson-Demenz vor allem zu Verhaltensauffälligkeiten wie Apraxien. Der betroffene Patient kann dann komplexe Bewegungsabläufe, wie beispielsweise Kaffee kochen, Ankleiden etc. nicht mehr richtig ausführen.
Welche Formen von Parkinson gibt es?
Je nachdem, welche Hauptsymptome besonders stark ausgeprägt sind, unterscheidet man unterschiedliche Typen des Morbus Parkinson:
- akinetisch-rigider Typ: Bewegungsarmut und Rigor stehen im Vordergrund
- Tremordominanz-Typ: ausgeprägter Tremor, weniger Rigor und posturale Instabilität
- Äquivalenz-Typ: die klassischen Hauptsymptome Akinese, Rigor und Tremor sind etwa gleich stark ausgeprägt
Parkinsonsymptome können auch im Rahmen anderer Erkrankungen des Nervensystems auftreten. Die Prognose ist hier eine andere, und die betroffenen Patienten sprechen auch nicht oder nur unzureichend auf die gängigen Therapien (medikamentöse Behandlung oder Neuromodulation) an. Die Diagnose dieser atypischen Parkinson-Syndrome ist daher sowohl prognostisch wie auch therapeutisch von Bedeutung.
Atypische Parkinson-Syndrome sind:
- Multisystematrophien (MSA)
- Lewy-Körper-Demenz
- progressive supranukleäre Blickparese (PSP)
- kortikobasalganglionäre Degeneration (CBD)
Wie wird Parkinson diagnostiziert?
Die Parkinson-Diagnose wird klinisch gestellt. Dabei sind die Krankheitsgeschichte des Patienten und der klinisch-neurologische Untersuchungsbefund von zentraler Bedeutung. Einzelne Symptome können klinisch graduiert werden und dienen der Stadieneinteilung. Dieses sogenannte Staging erfolgt mittels der Hoehn- und Yahr-Skala (Hoehn 1967) und der Unified Parkinson's Disease Rating Scale (UPDRS). Zusatzuntersuchungen wie die Magnetresonanztomografie (MRT oder MRI von engl. Magnetic Resonance Imaging), die Dopamin-Transporter-Szintigrafie SPECT (DAT-Scan), die Liquordiagnostik etc. werden lediglich unterstützend zum Ausschluss nicht-idiopathischer Parkinsonsyndrome, für die die Ursache bekannt ist, eingesetzt.
Welche Therapiemöglichkeiten gibt es für Parkinson-Patienten?
Für eine erfolgreiche Behandlung von Morbus Parkinson ist eine enge Zusammenarbeit zwischen mehreren Fachdisziplinen entscheidend.
Die medikamentöse Therapie steht dabei an erster Stelle und erfolgt durch Neurologen mit speziellen Kenntnissen im Bereich der Bewegungsstörungen.
Chirurgische Verfahren können bei der Therapie eine wichtige unterstützende Rolle spielen. Zu den gängigen Verfahren gehören:
- läsionelle Verfahren wie der MR-gesteuerte fokussierte Ultraschall
oder
- nicht-läsionelle Verfahren wie die Tiefe Hirnstimulation bzw. Deep Brain Stimulation (DBS)
Diese Verfahren sind hochspezialisiert und erfordern eine fundierte Ausbildung im Bereich der funktionellen Neurochirurgie. Welches Verfahren angewendet wird, hängt in erster Linie von medizinischen Faktoren und individuellen Bedürfnissen des Patienten ab und sollte immer im Detail mit unseren Spezialisten besprochen werden. Die enge interdisziplinäre Zusammenarbeit zwischen Neurologen und funktionellen Neurochirurgen am Inselspital gewährleistet eine kompetente und vor allem individuell auf jeden einzelnen unserer Patienten zugeschnittene ganzheitliche Behandlung.
Medikamentöse Therapie
Aufgrund des Untergangs der Nervenzellen der Substantia nigra, die Dopamin als Neurotransmitter freisetzen, herrscht ein Ungleichgewicht im fein abgestimmten Transmittersystem der Basalganglien. In der Folge kommt es, sehr vereinfacht gesprochen, zu einem Mangel an Dopamin und einem Überschuss an Acetylcholin bei der Signalübertragung zwischen den Nervenzellen im Bereich der Basalganglien. Die medikamentöse Behandlung zielt in erster Linie auf die Wiederherstellung der dopaminergen Signalübertragung und die gleichzeitige Hemmung der Acetylcholin-Übertragung ab. Meistens werden dafür folgende Medikamente eingesetzt:
L-Dopa
L-Dopa ist ein Vorläufer des Dopamins und wird im Gehirn durch das Enzym DOPA-Decarboxylase (DDC) in Dopamin umgewandelt. L-Dopa ist das wirksamste und verträglichste Medikament zur Behandlung von Parkinsonsymptomen und derzeit das Medikament der Wahl. Es bessert vor allem Akinese und Rigor, weniger den Tremor. Aus Langzeitbeobachtungen weiss man, dass bei mehrjähriger L-DOPA Therapie ein allmählicher Wirkungsabfall eintritt und die Wirkung deutlichen Schwankungen (sogenannte Wirkungsfluktuationen) im Tagesverlauf unterliegt.
Dopamin-Agonisten
Die dopaminergen Agonisten wie z. B. Pramipexol, Ropinirol, Rotigotin, Piribedil wirken direkt auf die Dopamin-Rezeptoren. Diese werden u. a. eingesetzt, um die benötigte Menge an L-DOPA zu senken und in Fällen, bei denen Patienten nicht mehr zuverlässig auf L-DOPA ansprechen. Zu den Vorteilen der Dopaminagonisten zählen, dass als Nebenwirkung weniger Wirkungsschwankungen sowie Überbeweglichkeiten (sogenannte Dyskinesien) auftreten. Nachteile sind, dass im Rahmen der Behandlung bei 15 % der Patienten Verhaltensauffälligkeiten wie Zwangsstörungen oder verminderte Impulskontrolle beobachtet wurden. Dies äussert sich beispielsweise in Spielsucht, Kaufrausch, Geldproblemen, Hypersexualität etc.
Inhibitoren der Monoaminooxidase Typ B (IMAO-B)
IMAO-B (Rasagilin) hat eine geringe dopaminerge Wirkung durch die Inhibition des Dopamin-Abbaus. Sie dienen meist als Zusatzwirkstoff, um die Wirkung von L-DOPA zu verstärken und die Wirkungsfluktuationen der L-DOPA-Therapie zur verringern.
Anticholinergika
Zum Beispiel Benserazid. Diese am längsten bekannte Therapie hemmt die Signalübertragung von Acetylcholin. Diese Medikamente haben weiterhin Bedeutung in Fällen, in denen vor allem der Tremor oder vegetative Störungen dominieren. Die Wirkung auf die Akinese und den Rigor steht dabei im Hintergrund. Mögliche Nebenwirkung sind Gedächtnisstörungen und können bei fortgeschrittenem Parkinson ein Problem darstellen.
Die Liste, der hier aufgeführten Medikamenten hat keinen Anspruch auf Vollständigkeit. Die Medikamente können einzeln oder in Kombination eingesetzt werden.
Injektionstherapie
Zusätzlich zu den aufgelisteten Medikamenten kann auch der Dopaminagonist Apomorphin als Injektion unter die Haut oder in Form einer Apomorphin-Pumpe zur kontinuierlichen Verabreichung in den Zwölffingerdarm eingesetzt werden. Diese Therapie kommt zum Tragen, wenn die medikamentöse Behandlung mit Tabletten nicht mehr ausreichend hilft.
Chirurgische Therapie
Die chirurgische Behandlung von Morbus Parkinson ist ein wichtiger Bereich der funktionellen Neurochirurgie, der auf Pionierarbeiten von Alim Louis Benabid in den 1990er Jahren zurückgeht. Seine Forschung zeigte, dass die Implantation von Elektroden zur Hochfrequenzstimulation in spezifischen Hirnregionen funktionale Verbesserungen erzielen kann, während durch die präzise Anpassung der Stimulationsintensität Nebenwirkungen effektiv vermieden werden können *.
Diese neue Therapie wurde als Tiefe Hirnstimulation oder Deep Brain Stimulation (DBS) bezeichnet und ist heute die chirurgische Standardtherapie am Inselspital*.
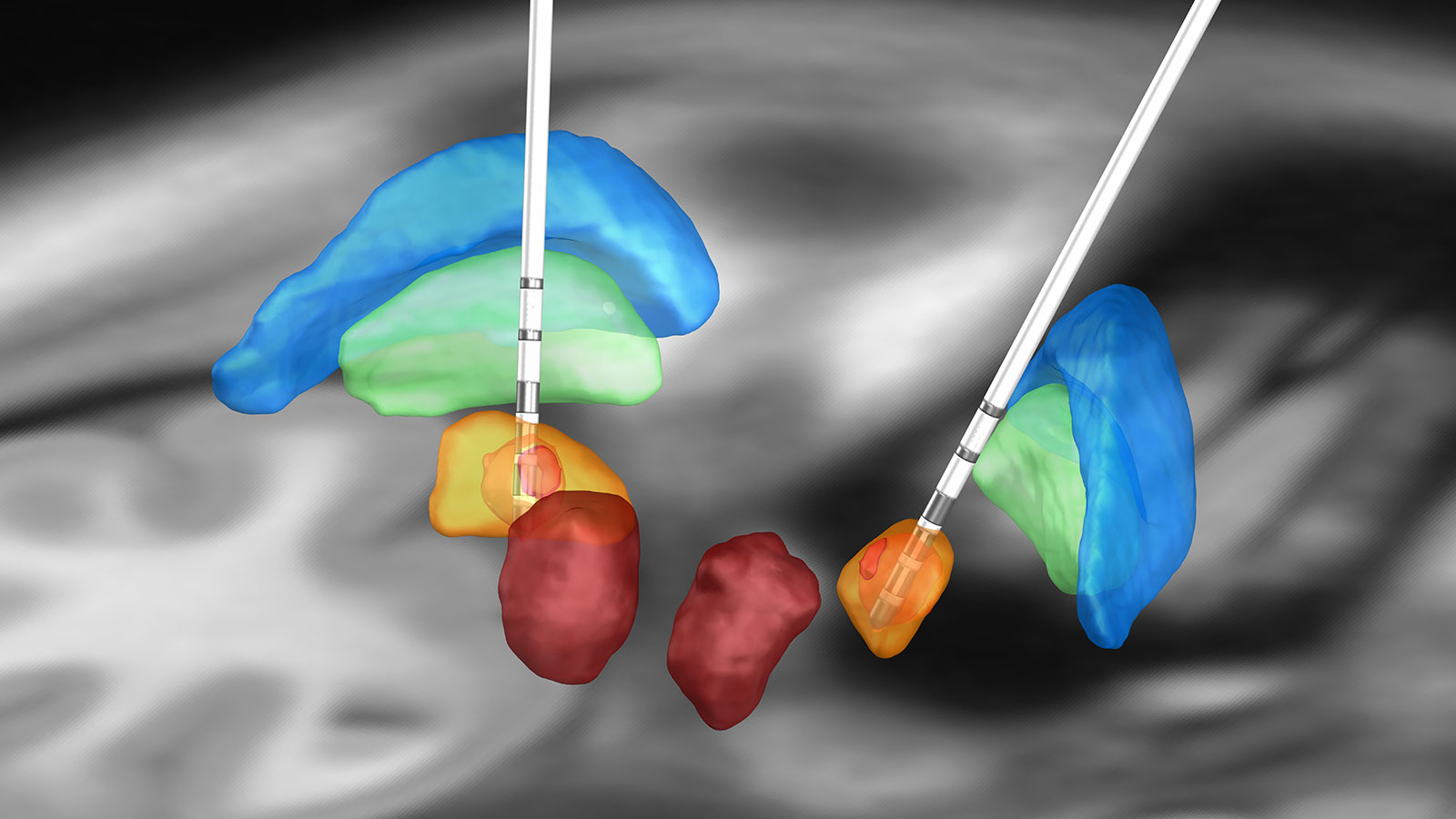
Es gibt drei mögliche Strukturen im Gehirn für die Tiefe Hirnstimulation bei Patienten mit Parkinson:
- der subthalamische Nukleus (STN)
- der Globus pallidus internus (GPi)
- der ventrale intermediäre Nukleus des Thalamus (Vim)
Diese möglichen Zielgebiete müssen als Alternativen bei jedem Patienten individuell im Expertenboard diskutiert werden. Die Stimulation im Bereich des Nucleus subthalamicus (STN) ist der Zielpunkt erster Wahl, weil durch die Stimulation auch die Akinese und der Rigor erfolgreich behandelt werden und die Medikamentendosierung meistens beachtlich reduziert werden kann. Potenzieller Nachteil ist die Verschlechterung einer vorbestehenden posturalen Instabilität. Nach Studienlage aktuell gleichwertig ist die GPi-Stimulation *.
Was kann ein Parkinson-Patient von der Tiefen Hirnstimulation erwarten?
Die Tiefe Hirnstimulation (DBS) bei Parkinson kann die Erkrankung weder heilen noch den Krankheitsprozess aufhalten. Sie mildert nur die motorischen Parkinson-Symptome wie Akinese, Tremor und Rigor sowie verringert medikamenten-induzierte Dyskinesien, also Störungen des Bewegungsablaufs. Dabei ist der Effekt der DBS bezüglich der Symptomlinderung nicht wesentlich grösser als der Effekt der dopaminergen medikamentösen Therapie, allerdings wirkt er konstanter über den Tag verteilt. Störende Dyskinesien treten wesentlich seltener auf. Wenn man im Bereich des Nucleus subthalamicus stimuliert, können ausserdem die Medikamente etwa um die Hälfte reduziert werden. Insgesamt betrachtet führt die Tiefe Hirnstimulation zu einer deutlichen Verbesserung in der Lebensqualität der Patienten – eine Tatsache, die in mehreren qualitativ hochwertigen Studien aufgezeigt werden konnte.
Patientenerfahrungen
«Ich habe ein neues Leben bekommen.»
«Die Verbesserungen sind drastisch.»
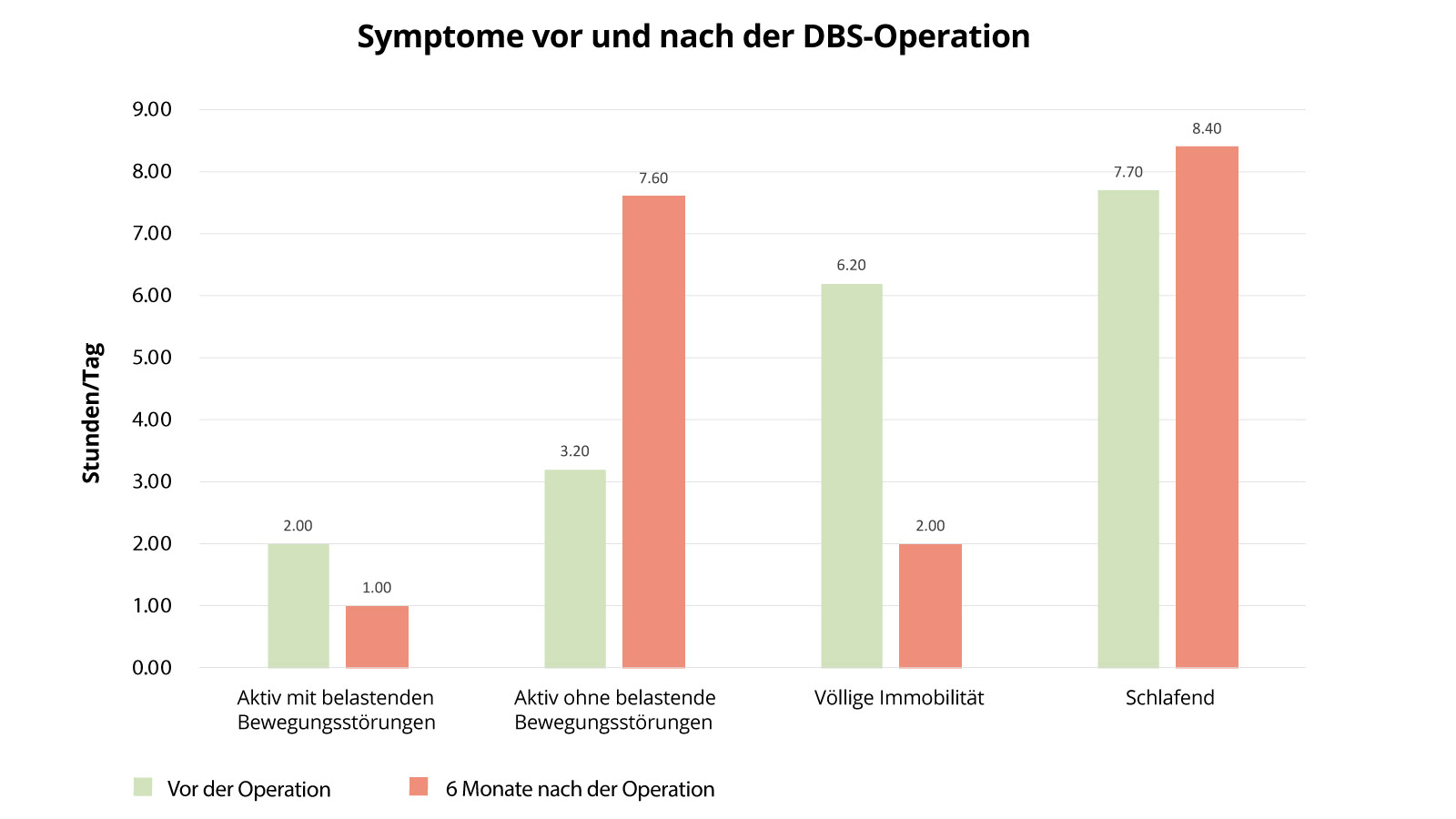
Symptome vor und nach einer DBS-Operation
Das folgende Diagramm zeigt, wie sich der Gesundheitszustand von Parkinson-Patienten nach einer DBS-Operation verändert hat. Untersucht werden die aktiven Zeit mit Bewegungsstörungen, die aktiven Zeiten ohne Bewegungsstörungen, Zeiten der völligen Immobilität und Schlafzeiten. Der Zustand vor Operation wird dabei verglichen mit dem Zustand 6 Monate nach der Operation. Auffällig sind hier vor allem, dass Patienten postoperativ viel weniger Zeit im immobilen Zustand verbringen (6,2 Stunden vor OP gegenüber 2 Stunden nach OP), sie also deutlich aktiver sein können. Diese Aktivitätszeiten sind auch wesentlich weniger belastet durch Bewegungseinschränkungen als vor dem Eingriff (Aktivität ohne belastende Bewegungsstörungen lag bei 3,2 Stunden vor OP und 7,6 Stunden postoperativ). Auch hier ist eine deutliche Verbesserung nachweisbar.
Welche Nebenwirkungen sind bei der Tiefen Hirnstimulation zu erwarten?
Grundsätzlich gelten dieselben Nebenwirkungen wie bei allen stereotaktischen, funktionellen DBS-Verfahren. Spezifische Risiken bei der GPi- oder STN-Stimulation zur Behandlung von Parkinson können vorübergehende Wahrnehmungen von «Lichtblitzen» bei Stimulation des optischen Trakts sein sowie muskuläre Zuckungen, Sprechstörungen (Dysarthrie) oder sensible Missempfindungen. In der Regel sind diese stimulations-induzierten Nebenwirkungen reversibel. Bei etwa 10–15 % der Patienten wurde in grossen Studien eine Verschlechterung der Kognition nach einer DBS-Implantation festgestellt.
Sind alle Parkinson-Patienten geeignet für eine Tiefe Hirnstimulation?
Für die chirurgische Therapie eignen sich nicht alle Patienten. Geeignete Kandidaten erfüllen die folgenden Kriterien:
- Der Patient weist trotz guter medikamentöser Behandlung schwere motorische Beeinträchtigungen (z. B. Dyskinesien) oder einen starken Tremor auf.
- Die medikamentöse Therapie des Patienten unterliegt starken Schwankungen und plötzlichen Wirkungsverlusten im Tagesverlauf (Wearing-off, Wirkungsfluktuationen).
- Der Patient weist keine schweren kognitiven Probleme (Demenz), Verhaltensauffälligkeiten oder Depressionen auf.
Am besten auf die chirurgische Therapie sprechen der Tremor, die Wirkungsfluktuationen und die Linderung der Dyskinesien an. Autonome Symptome (Blutdruckschwankungen, Miktionsstörungen, Speichelfluss etc.) und kognitive Symptome (Parkinson-Demenz) können beim jetzigen Stand nicht verbessert werden. Es laufen hierzu jedoch aktuell mehrere Studien. Durchwachsenen Erfolg liefert die Tiefe Hirnstimulation des Nucleus pedunculopontinus bei Freezing of gait *.
Die Entscheidung muss im Einzelfall getroffen werden. Die Indikation zur DBS wird generell gemeinsam von Neurologen und Neurochirurgen nach zeitlich aufwändigen Untersuchungen (neurologischen Untersuchungen, neuropsychologischen Tests, psychiatrischer Beurteilung, chirurgischer Beurteilung) gestellt, um sicher zu stellen, dass nur Patienten mit hoher Erfolgsaussicht auf eine Verbesserung der Beschwerden für den Eingriff ausgewählt werden.
Warum Sie sich am Inselspital behandeln lassen sollten
Wir führen als einziges Zentrum in der Schweiz die DBS-Operation bei Parkinson routinemässig in Vollnarkose durch.
Die Vorteile sind:
- Sehr präzises Implantieren der Elektrode
- Keine belastende Wachoperation
- Kürzere Operationsdauer
- Schonenderer Eingriff für unsere Patienten
- Kein Absetzen der Parkinson-Medikamente vor der Operation
Die Umstellung von Wachoperation auf einen Eingriff in Vollnarkose basiert auf der Erfahrung von grossen internationalen Zentren sowie wissenschaftlich publizierten Ergebnissen *. Bereits seit 2021 empfehlen und praktizieren wir die Implantation von Elektroden sowie Schrittmacher in Vollnarkose. Die Resultate der Operation in Narkose sind nach unseren Erfahrungen genauso gut oder sogar noch besser als bei Operationen im Wachzustand. Voraussetzung dafür sind allerdings ein hohes Mass an Expertise und viel Erfahrung bei den behandelnden Ärztinnen und Ärzten. Wir haben auch festgestellt, dass alle unsere Parkinson-Patienten die Operation unter Vollnarkose bevorzugen.
Möglich wurde dieses innovative Vorgehen durch:
- die Verbesserung der modernen Bildgebung, die ein präzises Implantieren der Elektrode auch in Vollnarkose ermöglicht
- die technologische Weiterentwicklung der implantierten Systeme (segmentierte Elektroden)
Wie bei einer Wach-OP auch werden während der Operation unter Vollnarkose elektrophysiologische Signale des Gehirns abgeleitet und eine intraoperative Teststimulation zur Testung der Nebenwirkungen durchgeführt. So kann die millimetergenaue Platzierung der Elektrode präzise überprüft werden. Bei fehlender Ableitung von Hirnsignalen und/oder raschem Eintreten von Nebenwirkungen wird die Elektrode neu platziert und erneut getestet.
Insofern medizinisch indiziert, kann der Eingriff in Einzelfällen auch im wachen Zustand durchgeführt werden. Dies wird das Behandlungsteam mit Ihnen im Vorfeld detailliert besprechen und auch die Abläufe bei einer Wachoperation erklären, falls diese notwendig sein sollte. Bei Patienten mit starker Dystonie muss der Eingriff allerdings immer unter Vollnarkose durchgeführt werden.
Referenzen
-
Bluett B, Bayram E, Litvan I. The virtual reality of Parkinson’s disease freezing of gait: A systematic review. Parkinsonism & related disorders. 2019
-
Cif L, Hariz M. Seventy Years with the Globus Pallidus: Pallidal Surgery for Movement Disorders Between 1947 and 2017. Mov Disord. 2017;32:972-982.
-
Deuschl G, Schade-Brittinger C, Krack P et al. A Randomized Trial of Deep-Brain Stimulation for Parkinson's Disease. New England Journal of Medicine. 2006;355:896-908.
-
Odekerken VJJ, van Laar T, Staal MJ et al. Subthalamic nucleus versus globus pallidus bilateral deep brain stimulation for advanced Parkinson’s disease (NSTAPS study): a randomised controlled trial. The Lancet Neurology. 2013;12:37-44.
-
Nowacki A, Galati S, Ai-Schlaeppi J, Bassetti C, Kaelin A, Pollo C. Pedunculopontine nucleus: an integrative view with implications on deep brain stimulation. Neurobiology of disease. 2019;128:75-85.
-
Holewijn RA, Verbaan D, van den Munckhof PM, Bot M, Geurtsen GJ, Dijk JM, Odekerken VJ, Beudel M, de Bie RMA, Schuurman PR. General Anesthesia vs Local Anesthesia in Microelectrode Recording-Guided Deep-Brain Stimulation for Parkinson Disease: The GALAXY Randomized Clinical Trial. JAMA Neurol. 2021 Oct 1;78(10):1212-1219.
