Ein zentrales Prinzip der modernen Neurochirurgie ist die kontinuierliche Überwachung der Hirnfunktionen während eines chirurgischen Eingriffs. Dafür wird das intraoperative Neuromonitoring (IOM), auch bekannt als intraoperative Neurophysiologie oder intraoperatives neurophysiologisches Monitoring, eingesetzt. Mithilfe spezialisierter neurophysiologischer Techniken lassen sich die Funktionen des Nervensystems in Echtzeit überwachen und gezielt schützen. Ziel ist es, neurologische Schäden während der Operation zu minimieren – insbesondere bei Eingriffen in der Nähe empfindlicher neurologischer Strukturen – und damit die Sicherheit und das Wohl der Patienten bestmöglich zu gewährleisten.
Das intraoperative Neuromonitoring (IOM) ist ein Schwerpunkt unserer Klinik. Wir zählen zu den international führenden Kliniken auf diesem Gebiet, insbesondere bei der technologischen Ausstattung, den intraoperativen Methoden, der Erfahrung, der Patientenzahl und der Anzahl wissenschaftlicher Veröffentlichungen. Unsere Klinik war und ist massgeblich an der Entwicklung weltweit neuer Techniken zur Vermeidung neurologischer Defizite beteiligt.
Warum intraoperatives Neuromonitoring?
Während jeder Operation werden zwei Konzepte verfolgt:
- Erreichung des Operationsziels, z. B. radikale Entfernung des Tumors
- Vermeidung von neurologischen Defiziten durch die Operation, die die Lebensqualität des Patienten vermindern *, *.
Deshalb muss jede Operation funktionsgeleitet erfolgen *, *, *, *, *, *. Der Fokus liegt dabei auf folgenden Punkten:
Prävention von Nervenschäden
Durch IOM können Veränderungen in der Nervenfunktion, die auf eine drohende Schädigung hinweisen könnten, früh erkannt werden.
Unterstützung der chirurgischen Entscheidungsfindung
IOM stellt während des Eingriffs Echtzeitinformationen bereit, die den Chirurgen beim Zugang, der Navigation und Durchführung der Operation unterstützen.
Erhöhung der Patientensicherheit
Das Risiko für postoperative neurologische Defizite kann durch IOM-Techniken massgeblich gesenkt werden, da der Chirurg unmittelbar auf potenzielle Schädigungen reagieren kann.
Welche IOM-Verfahren gibt es?
Monitoring
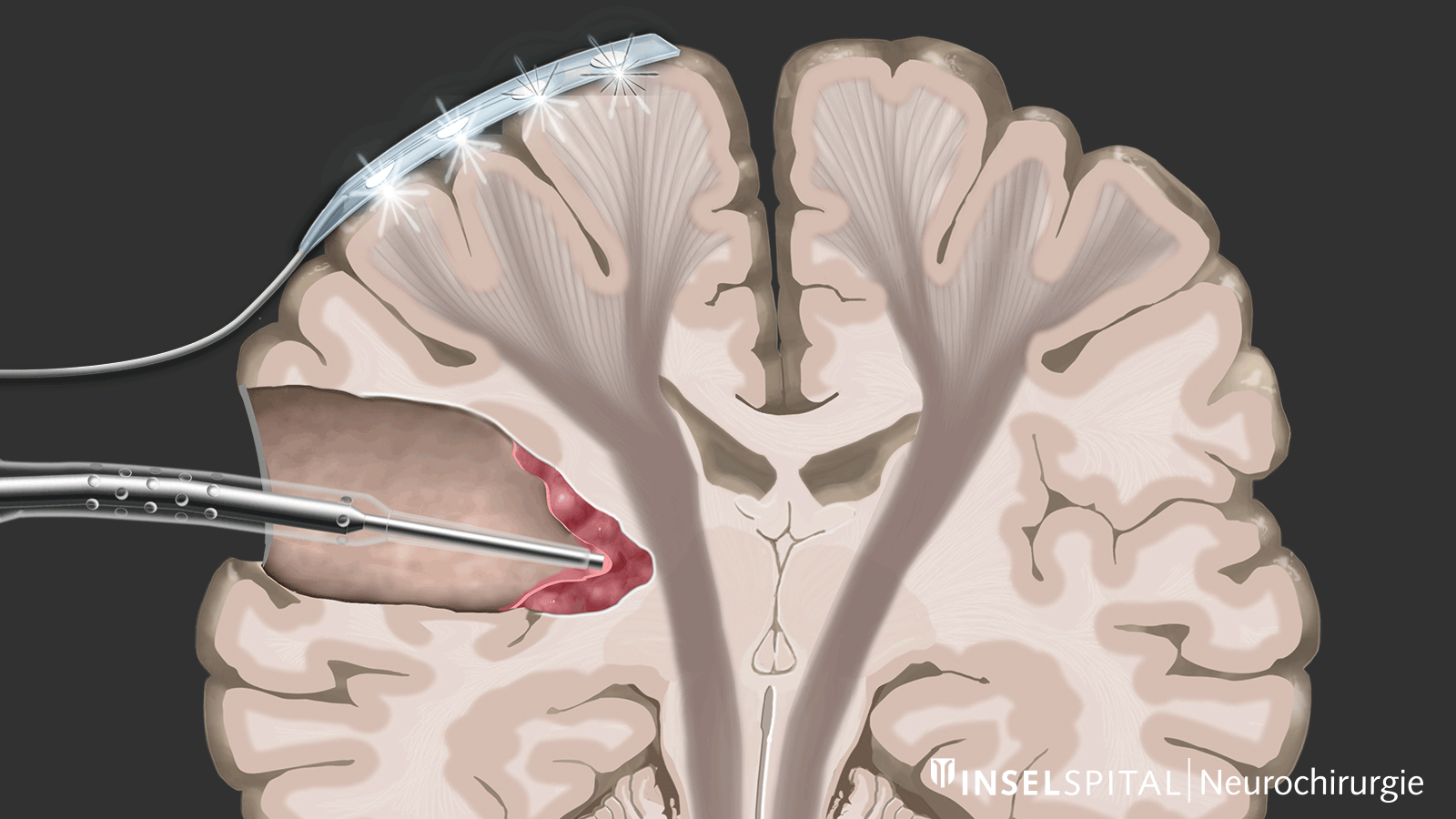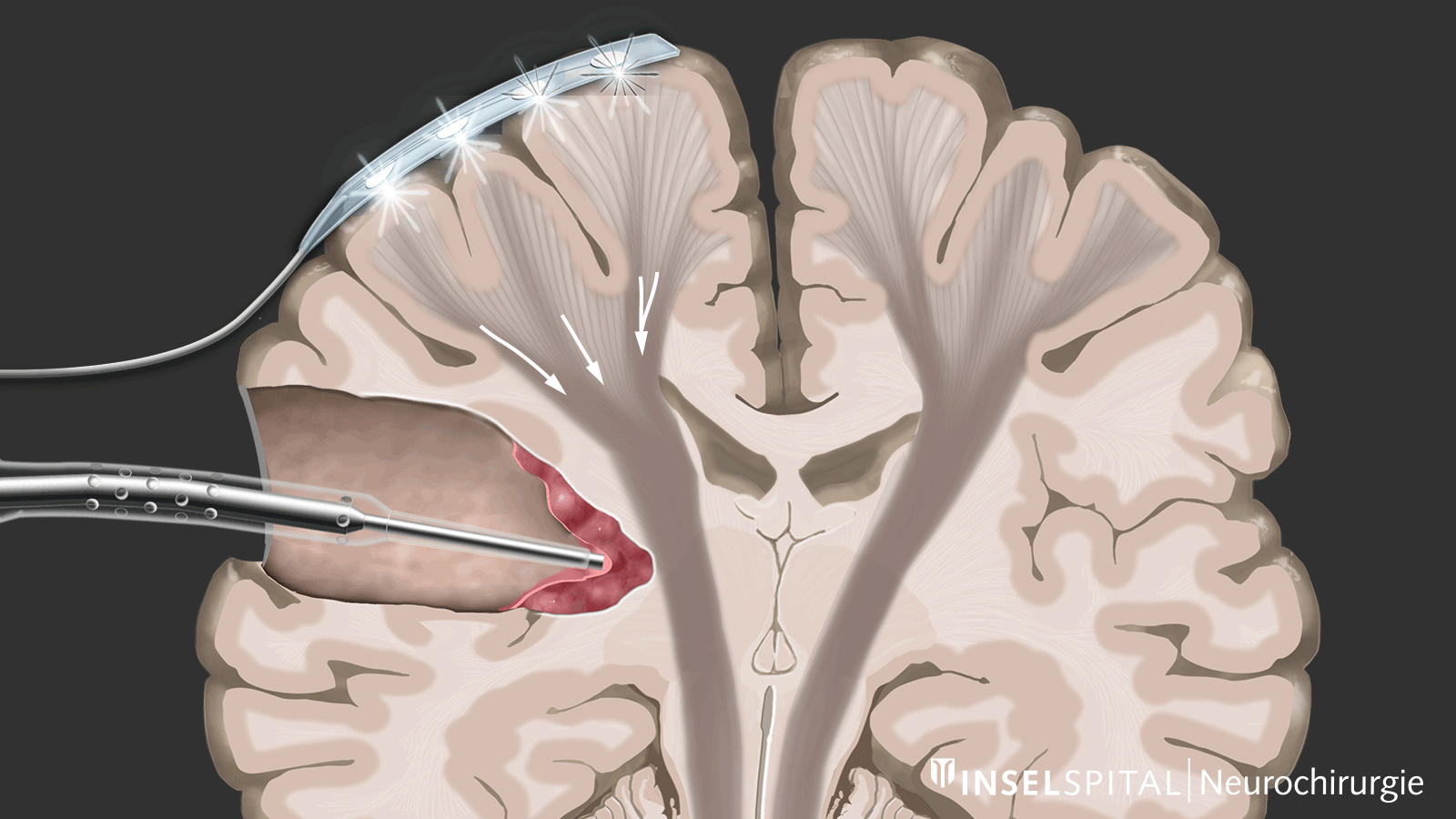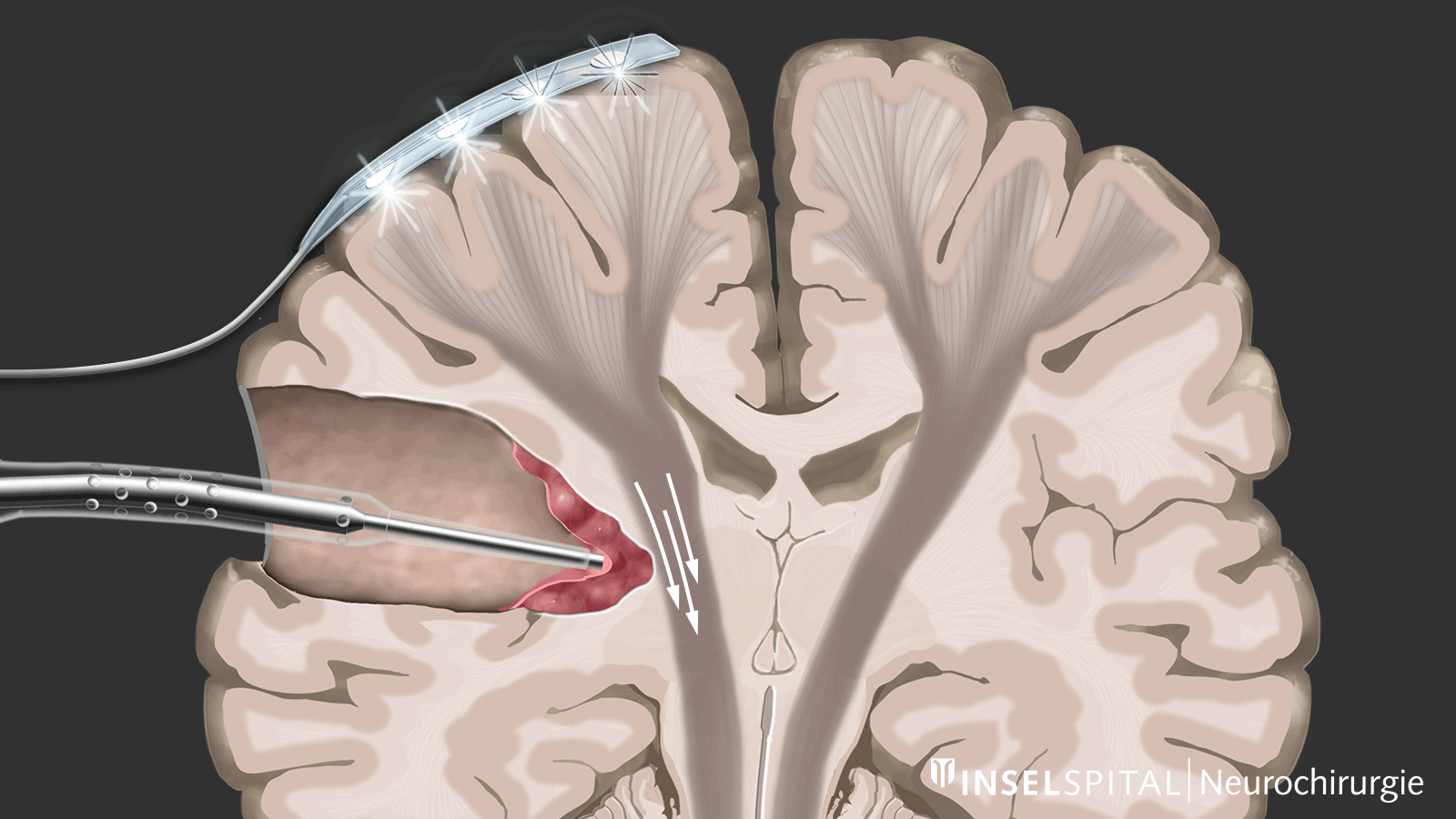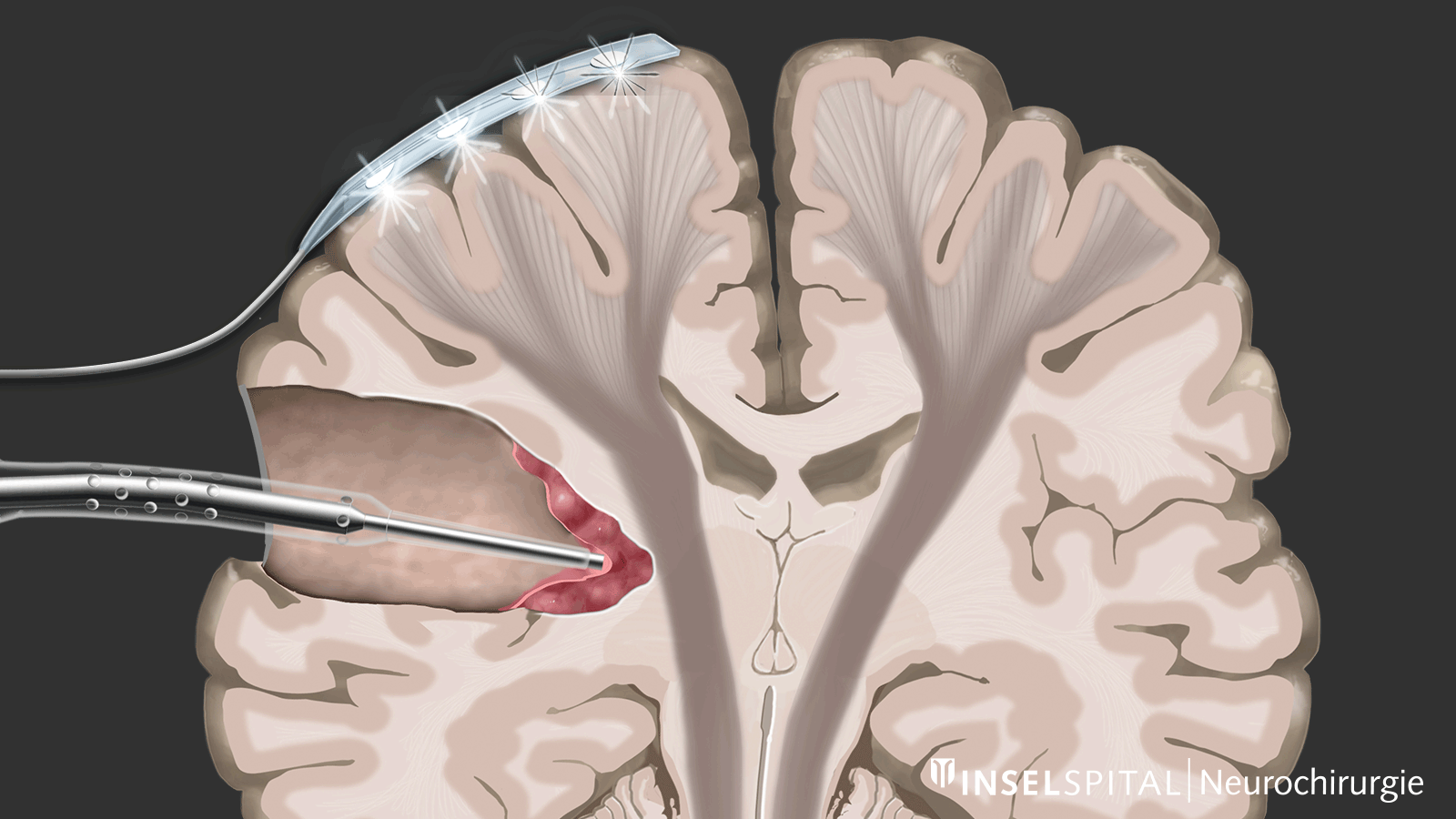
Zu den Verfahren des intraoperativen Neuromonitorings zählen zum einen Methoden, die einen bekannten Funktionsort des Hirn- und Nervengewebes während der Operation konstant stimulieren und auf diese Weise überwachen, genannt Monitoring.
Mapping
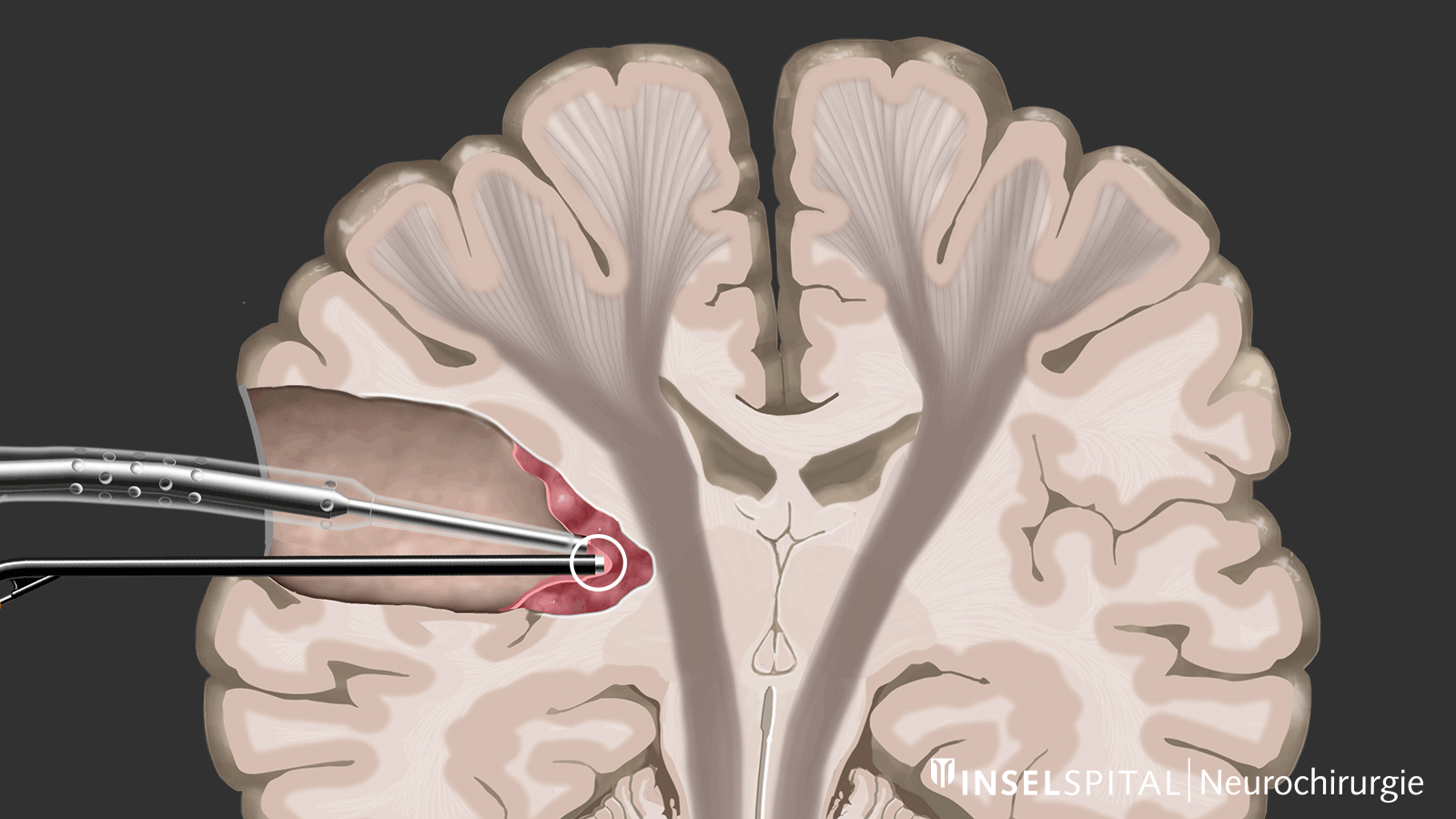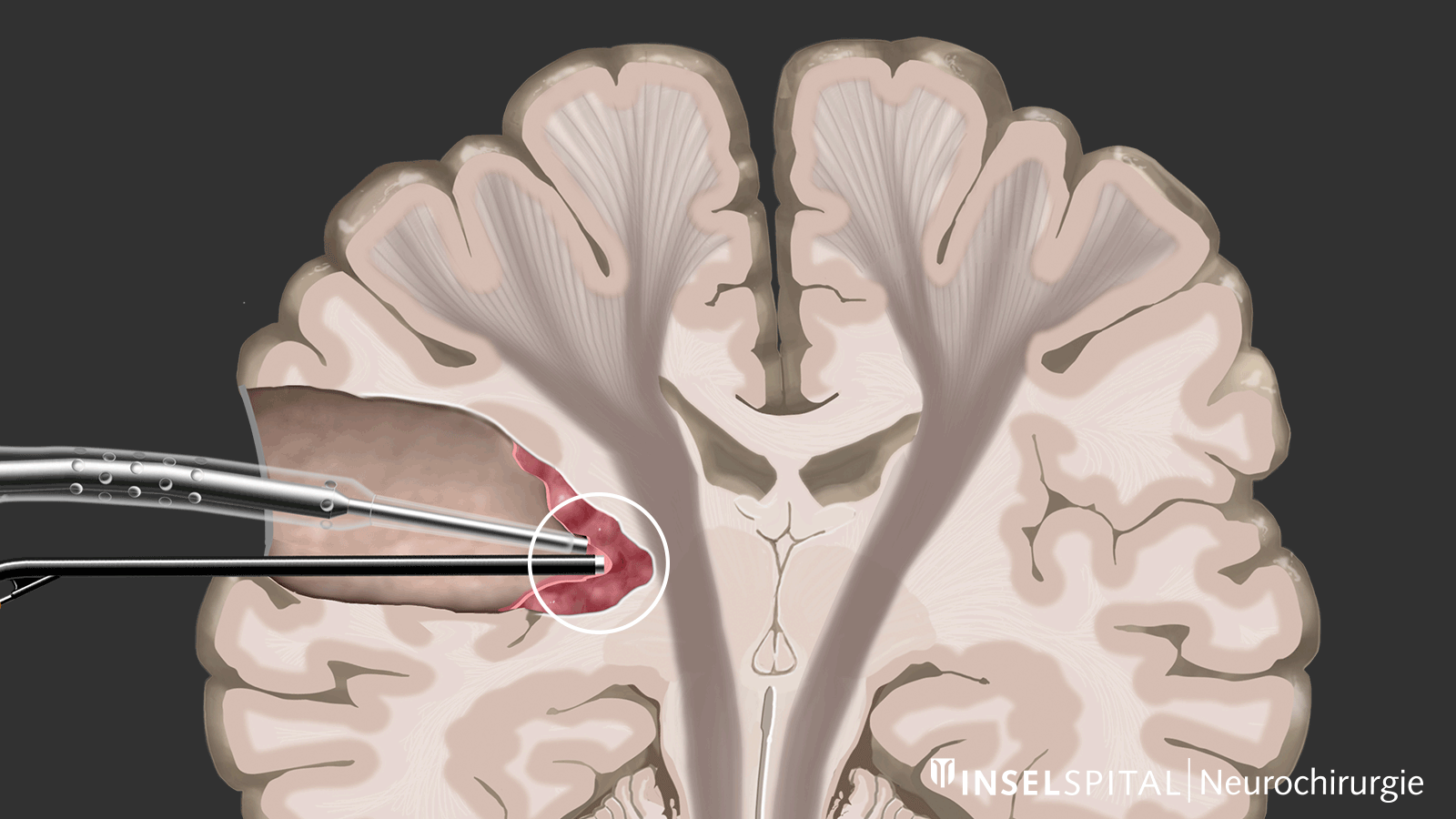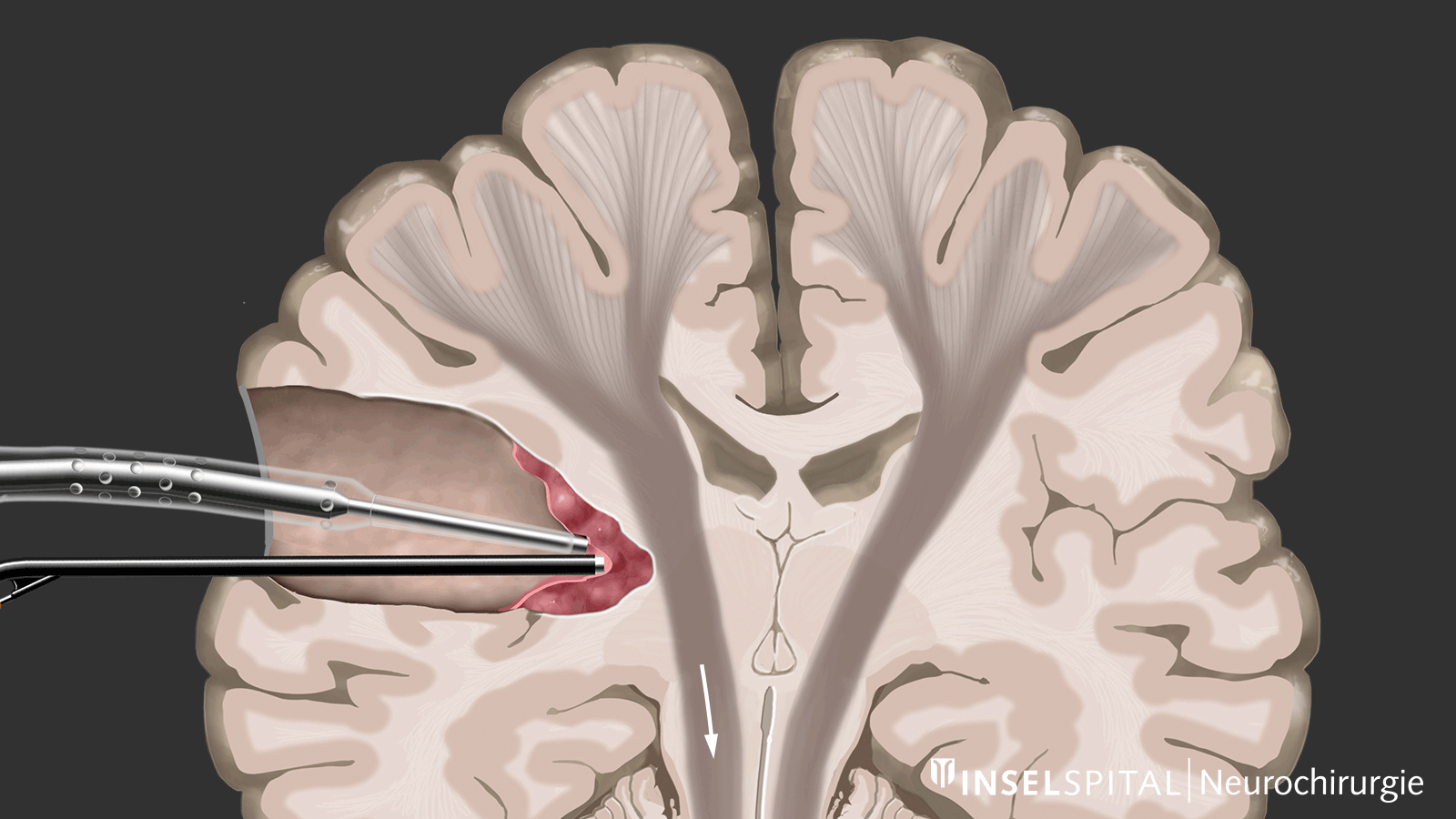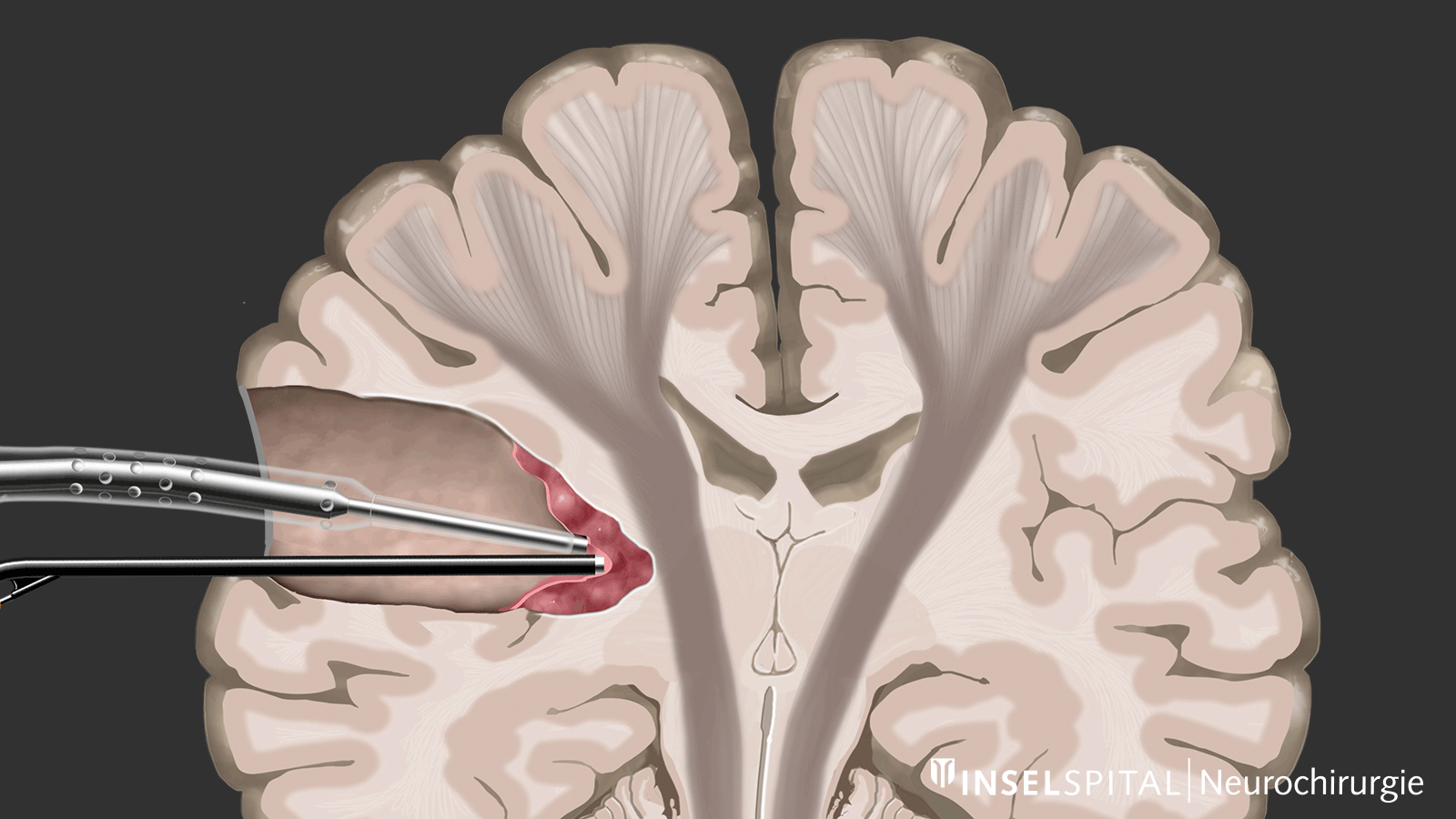
Zum anderen handelt es sich um Methoden, die noch unbekanntes Funktionsgewebe in der Nähe des Operationsgebiets wie mit einem «Such-Radar» aufspüren und rechtzeitig vor der Lokalisation warnen, genannt Mapping.
Wachoperation
Auch eine Wachoperation gehört zum IOM, weil sie es ermöglicht, die Funktion kritischer Gehirnbereiche in Echtzeit zu überwachen, indem der Patient während der Operation wach und ansprechbar ist. Dies hilft, wichtige Funktionen wie Sprache und Bewegung zu erhalten, indem die entsprechenden Hirnregionen direkt kartiert und Schäden vermieden werden.
Bei welchen Operationen wird das intraoprative Neuromonitoring eingesetzt?
Hirntumoren
Eine komplette oder fast komplette Resektion (engl. gross total resection oder GTR) bleibt der Goldstandard für die meisten intrakraniellen Tumoroperationen. Nachweise dafür gibt es sowohl für Glioblastome als auch für Astrozytome, Oligodendrogliome und andere Gliome *, *, *, *, *, *, *.
Ob man einen Hirntumor überhaupt operieren kann, hängt in erster Linie von seiner Lage und der Nähe zu kritischen Hirnfunktionen ab. Anhand von MRI-Bildern werden 10–20 % aller Hirntumoren fälschlicherweise als «eloquent» und inoperabel eingeschätzt *, *, *. Erst das intraoperative Mapping und Monitoring zeigen in der Realität, ob ein im Vorfeld als inoperabel bewerteter Tumor auch wirklich inoperabel ist *. Mit speziellen Mapping-Methoden kann ein solcher Tumor in der Mehrzahl der Fälle trotzdem sicher operiert werden.
Hirnaneurysmen
Beim Clipping von Aneurysmen kommt es darauf an, dass die grosse Arterie offenbleibt, während der Aneurysmasack komplett geclippt – also verschlossen – wird. Aus vielen Studien ist bekannt, dass dies bei etwa 10 % aller Operationen nicht perfekt gelingt. Hier hilft das intraoperative Neuromonitoring, Störungen der Durchblutung sofort zu erkennen, wenn diese kritisch sind. Wir verwenden bei fast allen Operationen von Aneurysmen das Monitoring der Bewegungsfunktion und der sensiblen Wahrnehmung. Beides wird in Narkose durchgeführt.
Rückenmarkstumoren
Bei dieser Art der Operation sind insbesondere die Bewegungsbahnen gefährdet. Meist liegt der Tumor in unmittelbarer Nähe einer oder beider Bahnen, bei deren Verletzung eine Querschnittslähmung auftreten kann. Operationen am Rückenmark müssen immer mit aufwändigem Monitoring von motorisch evozierten Potenzialen (MEP), sensibel evozierten Potenzialen (SEP), D-Wave und ggf. mit Mapping der Hinterstränge und Pyramidenbahn durchgeführt werden.
Vestibularisschwannome
Bei den Vestibularisschwannomen sind die Hörfunktion und die Funktion des Gesichtsnervs, Nervus facialis, von besonderer Bedeutung. Der Gesichtsnerv ist oft mit der Tumorkapsel verwachsen. Bei einer Operation kommen 7 verschiedene Überwachungstechniken gleichzeitig zum Einsatz.
Hirnstammtumoren
Im Hirnstamm liegen die Kerne der Hirnnerven und alle Bahnen, die zwischen Gehirn und Rückenmark verlaufen. Es ist neben dem Rückenmark das Gebiet mit der höchsten Konzentration von wichtigen Funktionen. Eine Operation in diesem Bereich erfordert ein aufwändiges intraoperatives Neuromonitoring mit bis zu 8 verschiedenen Techniken zeitgleich.
Referenzen
-
Chang EF, Clark A, Smith JS, et al. Functional mapping-guided resection of low-grade gliomas in eloquent areas of the brain: improvement of long-term survival. Clinical article. Journal of neurosurgery 2011;114(3):566-73.
-
De Witt Hamer PC, Robles SG, Zwinderman AH, et al. Impact of intraoperative stimulation brain mapping on glioma surgery outcome: a meta-analysis. Journal of clinical oncology. 2012;30(20):2559-65.
-
Raabe A, Beck J, Schucht P, et al. Continuous dynamic mapping of the corticospinal tract during surgery of motor eloquent brain tumors: evaluation of a new method. Journal of neurosurgery 2014;120(5):1015-24.
-
Bello L, Riva M, Fava E, et al. Tailoring neurophysiological strategies with clinical context enhances resection and safety and expands indications in gliomas involving motor pathways. Neuro-oncology 2014;16(8):1110-28.
-
Sala F, Lanteri P. Brain surgery in motor areas: the invaluable assistance of intraoperative neurophysiological monitoring. Journal of neurosurgical sciences 2003;47(2):79-88.
-
Seidel K, Beck J, Stieglitz L, et al. The warning-sign hierarchy between quantitative subcortical motor mapping and continuous motor evoked potential monitoring during resection of supratentorial brain tumors. Journal of neurosurgery 2013;118(2):287-96.
-
Smith JS, Chang EF, Lamborn KR, et al. Role of extent of resection in the long-term outcome of low-grade hemispheric gliomas. Journal of clinical oncology. 2008;26(8):1338-45.
-
Stummer W, Reulen HJ, Meinel T, et al. Extent of resection and survival in glioblastoma multiforme: identification of and adjustment for bias. Neurosurgery 2008;62(3):564-76; discussion 64-76.
-
Senft C, Bink A, Franz K, et al. Intraoperative MRI guidance and extent of resection in glioma surgery: a randomised, controlled trial. Lancet Oncol;12(11):997-1003.
-
Sanai N, Snyder LA, Honea NJ, et al. Intraoperative confocal microscopy in the visualization of 5-aminolevulinic acid fluorescence in low-grade gliomas. J Neurosurg;115(4):740-8.
-
McGirt MJ, Chaichana KL, Gathinji M, et al. Independent association of extent of resection with survival in patients with malignant brain astrocytoma. Journal of neurosurgery 2009;110(1):156-62.
-
McGirt MJ, Chaichana KL, Attenello FJ, et al. Extent of surgical resection is independently associated with survival in patients with hemispheric infiltrating low-grade gliomas. Neurosurgery 2008;63(4):700-7; author reply 07-8.
-
Lacroix M, Abi-Said D, Fourney DR, et al. A multivariate analysis of 416 patients with glioblastoma multiforme: prognosis, extent of resection, and survival. Journal of neurosurgery 2001;95(2):190-8.
-
De Witt Hamer PC, Robles SG, Zwinderman AH, et al. Impact of intraoperative stimulation brain mapping on glioma surgery outcome: a meta-analysis. J Clin Oncol;30(20):2559-65.
-
Stummer W, Pichlmeier U, Meinel T, et al. Fluorescence-guided surgery with 5-aminolevulinic acid for resection of malignant glioma: a randomised controlled multicentre phase III trial. The lancet oncology 2006;7(5):392-401.
Weiterführende Literatur
Bücher/Buchkapitel
- Deletis V, Shils J, Sala F, Seidel K. Neurophysiology in Neurosurgery. A modern intraoperative approach. Second edition. Elsevier 2019.
- Deletis V., Seidel K. Intraoperative Neurophysiology during Surgery for Spinal Cord Tumors. In: Arnautović K.I., Gokaslan Z.L. (eds) Spinal Cord Tumors. Springer, Cham. 2019.
Artikel
- Seidel K, Beck J, Stieglitz L, Schucht P, Raabe A. Low-threshold monopolar motor mapping for resection of primary motor cortex tumors. Neurosurgery. 2012 Sep;71(1 Suppl Operative):104-14; discussion 114-5.
- Seidel K, Beck J, Stieglitz L, Schucht P, Raabe A. The warning-sign hierarchy between quantitative subcortical motor mapping and continuous motor evoked potential monitoring during resection of supratentorial brain Tumors. J Neurosurg. 2013 Feb;118(2):287-96.
- Raabe A, Beck J, Schucht P, Seidel K. Continuous dynamic mapping of the corticospinal tract during surgery of motor eloquent brain tumors: evaluation of a new method. J Neurosurg. 2014 May;120(5):1015-24.
- Schucht P, Seidel K, Beck J, Murek M, Jilch A, Wiest R, Fung C, Raabe A. Intraoperative monopolar mapping during 5-ALA-guided resections of glioblastomas adjacent to motor eloquent areas: evaluation of resection rates and neurological outcome. Neurosurg Focus. 2014 Dec;37(6):E16.
- Raabe A, Seidel K. Prevention of ischemic complications during aneurysm surgery. J Neurosurg Sci. 2016 Mar;60(1):95-103.
- Spena G, Schucht P, Seidel K, Rutten GJ, Freyschlag CF, D'Agata F, Costi E, Zappa F, Fontanella M, Fontaine D, Almairac F, Cavallo M, De Bonis P, Conesa G, Foroglou N, Gil-Robles S, Mandonnet E, Martino J, Picht T, Viegas C, Wager M, Pallud J. Brain tumors in eloquent areas: A European multicenter survey of intraoperative mapping techniques, intraoperative seizures occurrence, and antiepileptic drug prophylaxis. Neurosurg Rev. 2017 Apr;40(2):287-298.
- Krieg SM, Lioumis P, Mäkelä JP, Wilenius J, Karhu J, Hannula H, Savolainen P, Lucas CW, Seidel K, Laakso A, Islam M, Vaalto S, Lehtinen H, Vitikainen AM, Tarapore PE, Picht T. Protocol for motor and language mapping by navigated TMS in patients and healthy volunteers; workshop Report. Acta Neurochir (Wien). 2017 Jul;159(7):1187-1195.
- Tinkhauser G, Pogosyan A, Debove I, Nowacki A, Shah SA, Seidel K, Tan H, Brittain JS, Petermann K, di Biase L, Oertel M, Pollo C, Brown P, Schuepbach M. Directional local field potentials: A tool to optimize deep brain stimulation. Mov Disord. 2018 Jan;33(1):159-164.
- Deletis V, Seidel K, Sala F, Raabe A, Chudy D, Beck J, Kothbauer KF. Intraoperative identification of the corticospinal tract and dorsal column of the spinal cord by electrical Stimulation. J Neurol Neurosurg Psychiatry. 2018 Feb 7. pii: jnnp-2017-317172.
- Seidel K, Biner MS, Zubak I, Rychen J, Beck J, Raabe A. Continuous dynamic mapping to avoid accidental injury of the facial nerve during surgery for large vestibular schwannomas. Neurosurg Rev. 2018 Oct 26.
- Seidel K, Häni L, Lutz K, Zbinden C, Redmann A, Consuegra A, Raabe A, Schucht P. Postoperative navigated transcranial magnetic stimulation to predict motor recovery after surgery of tumors in motor eloquent areas. Clin Neurophysiol. 2019 Jun;130(6):952-959.
