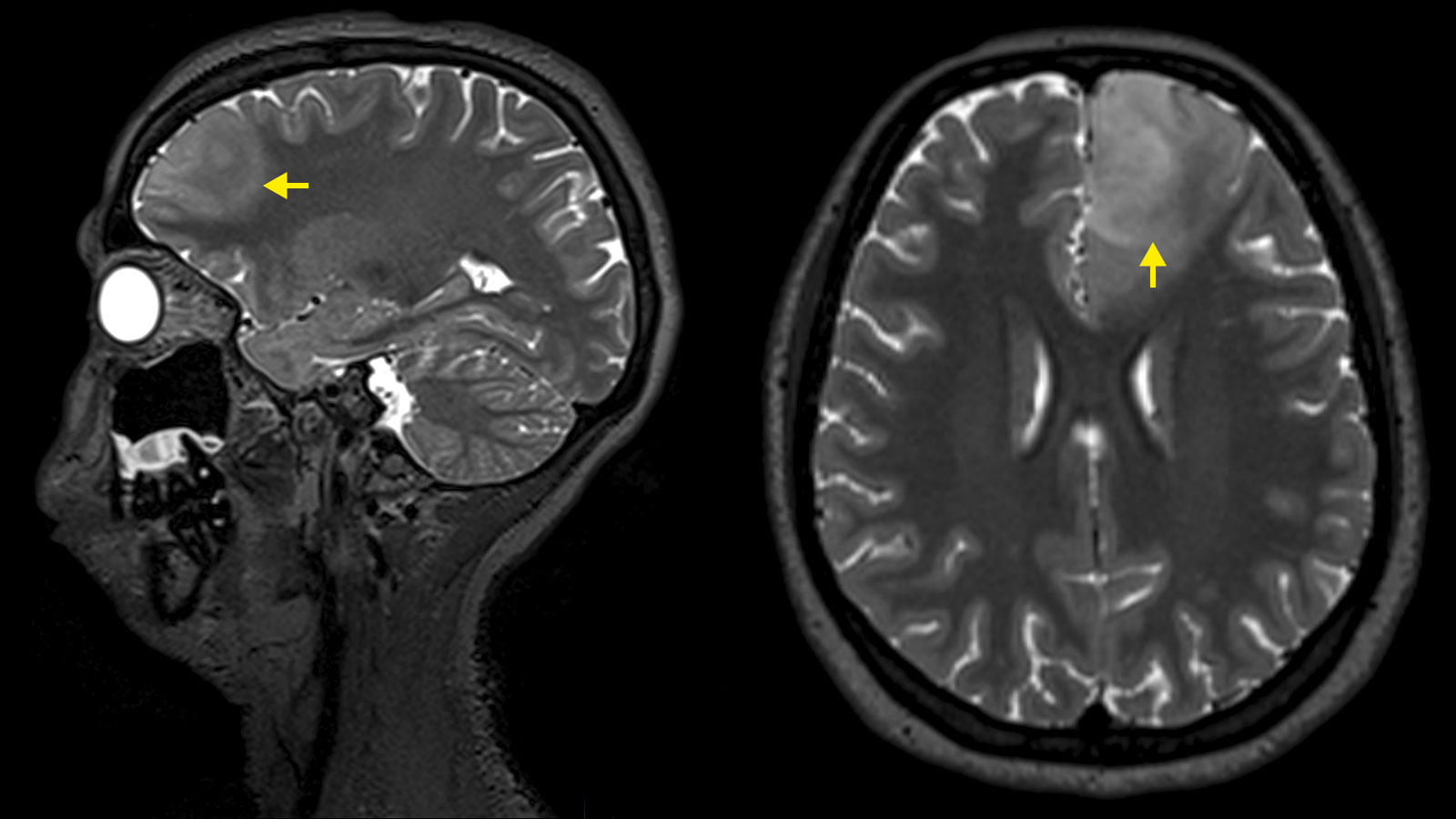
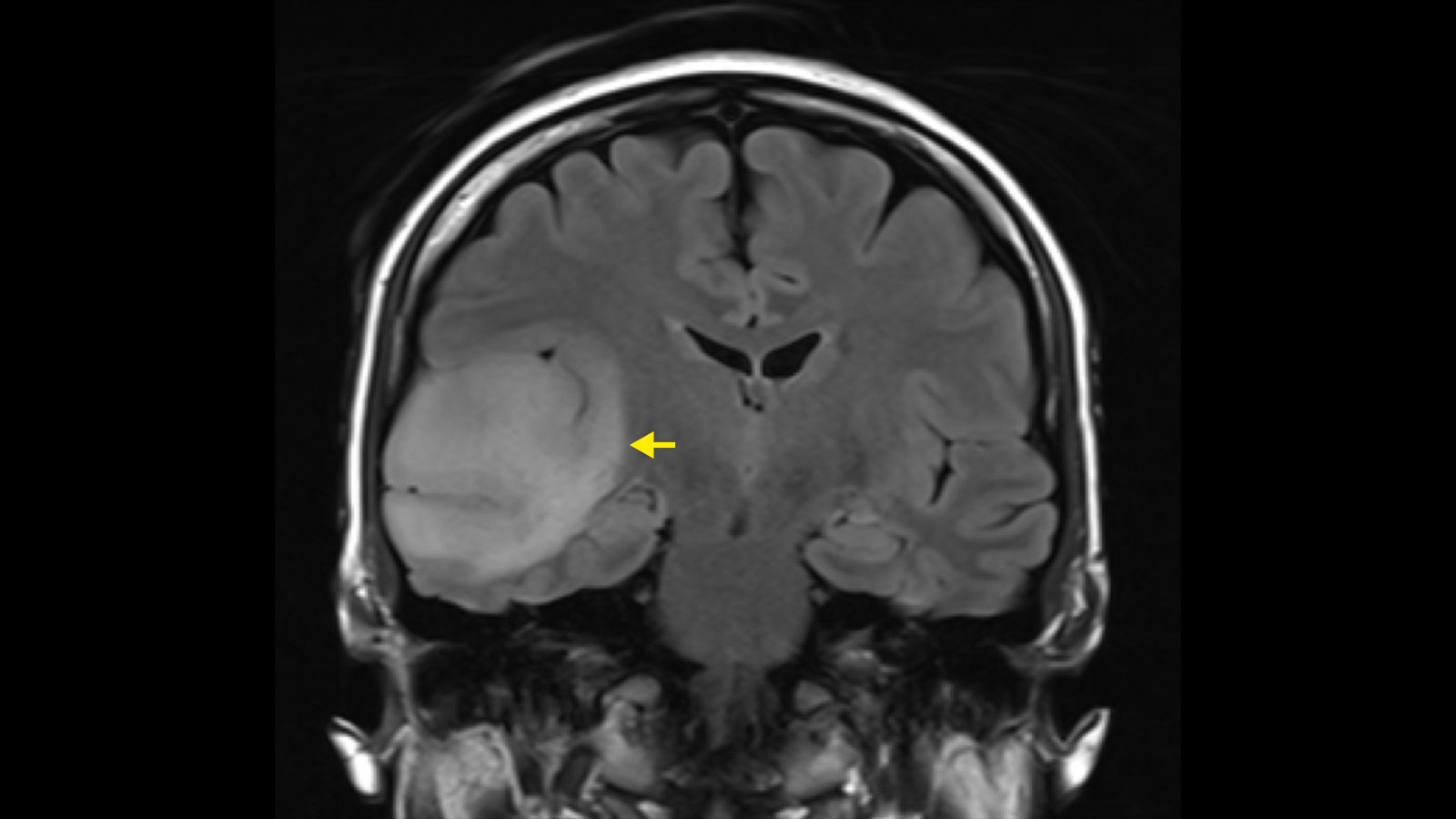
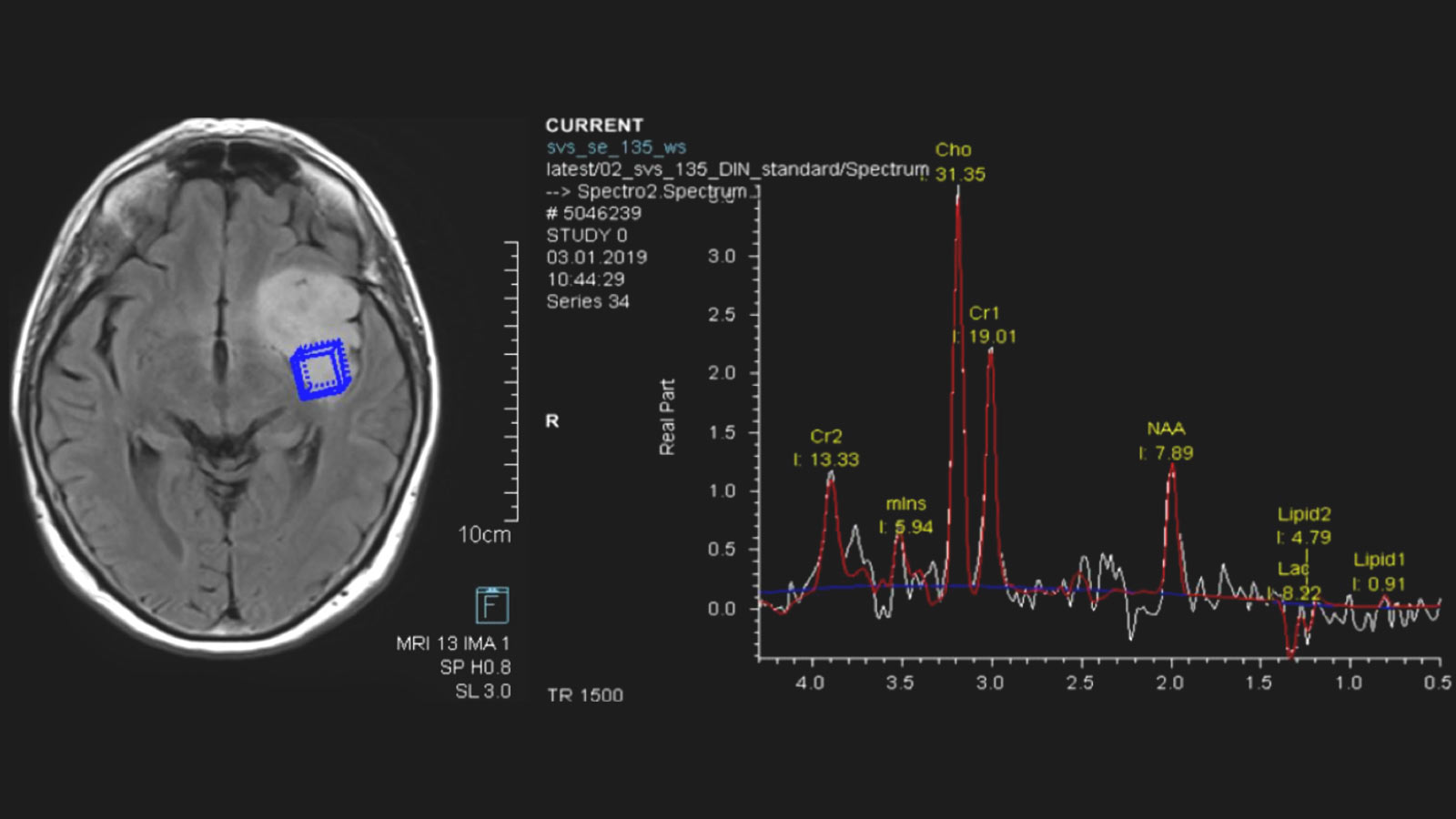
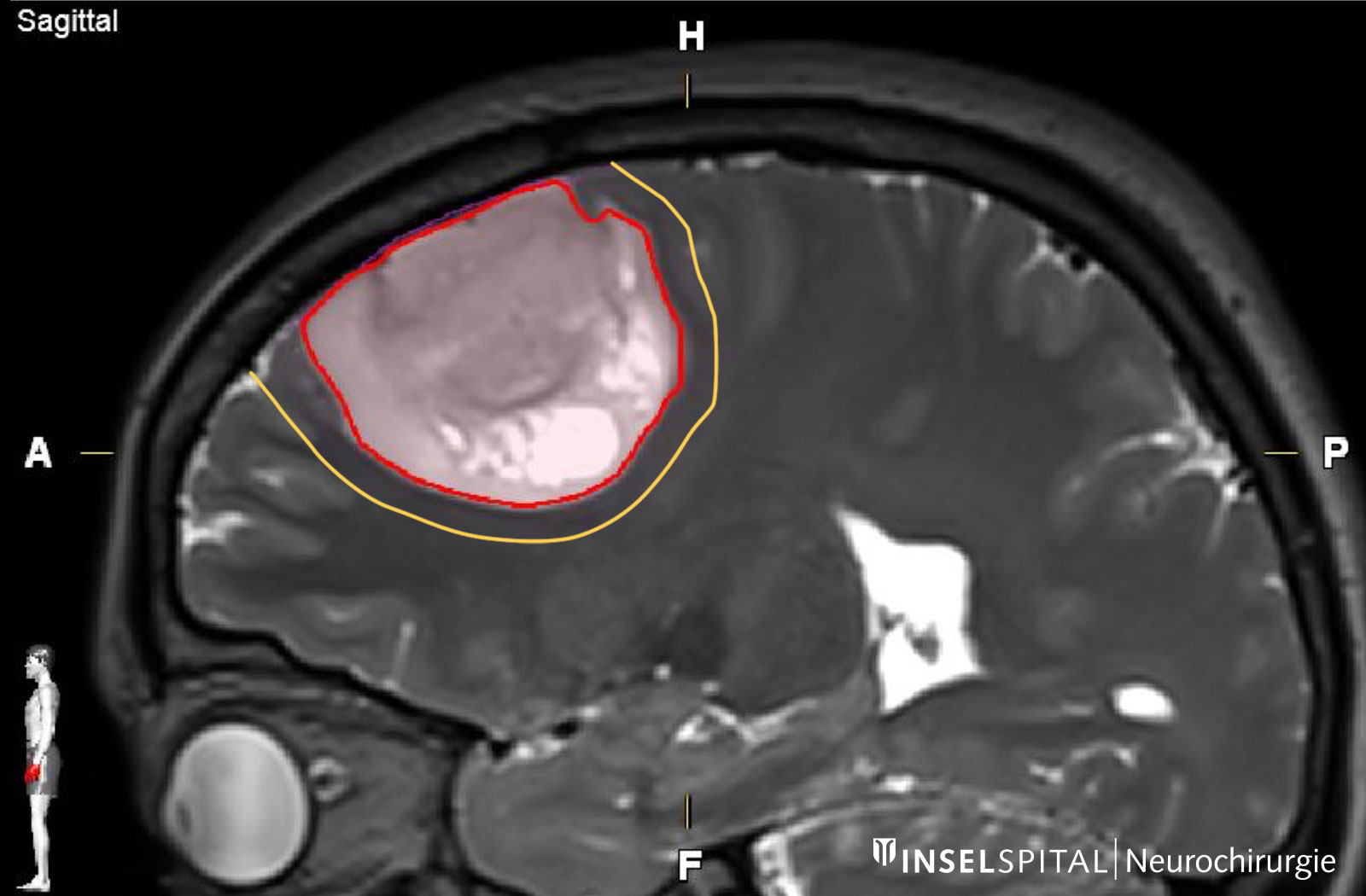
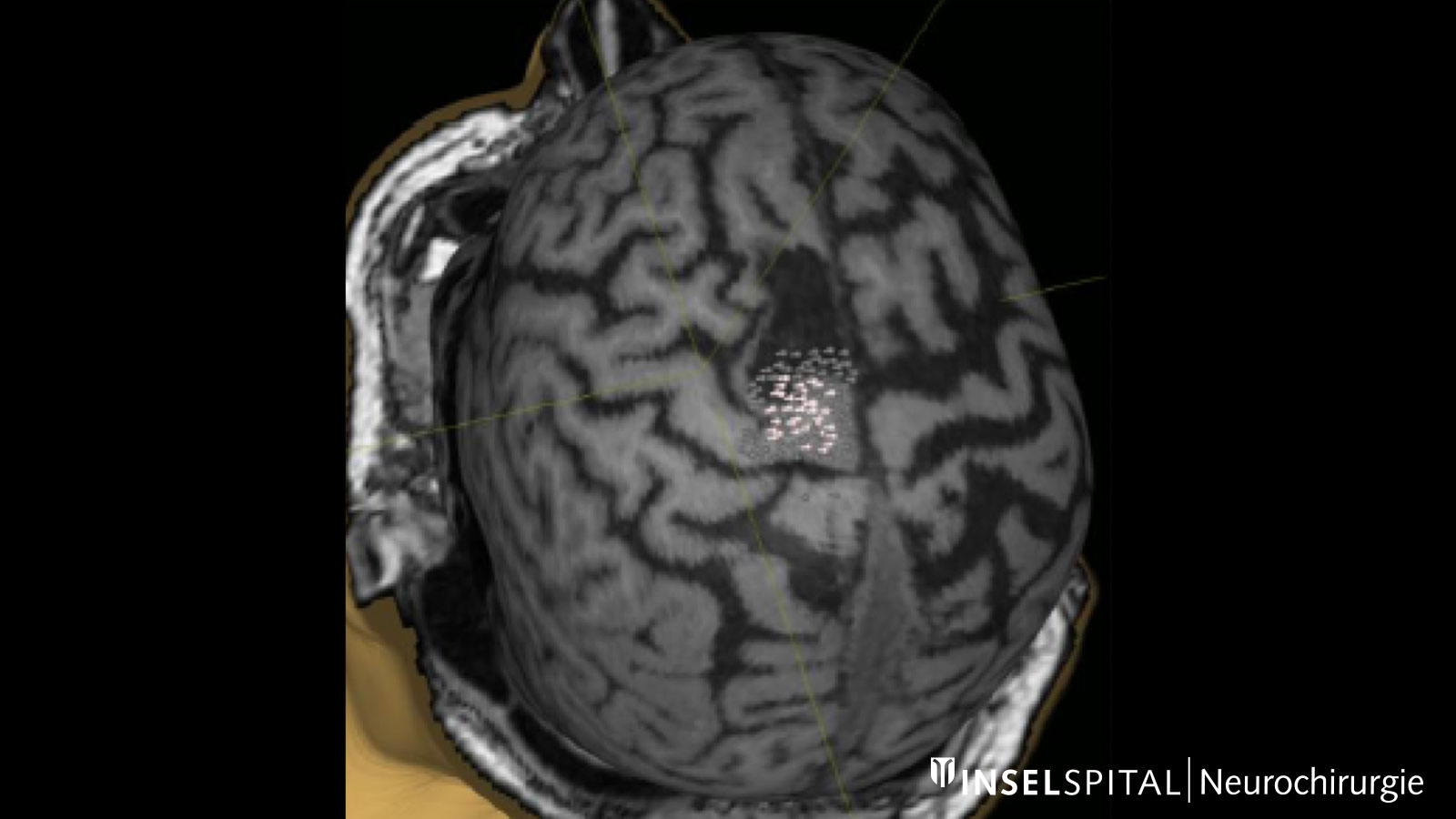
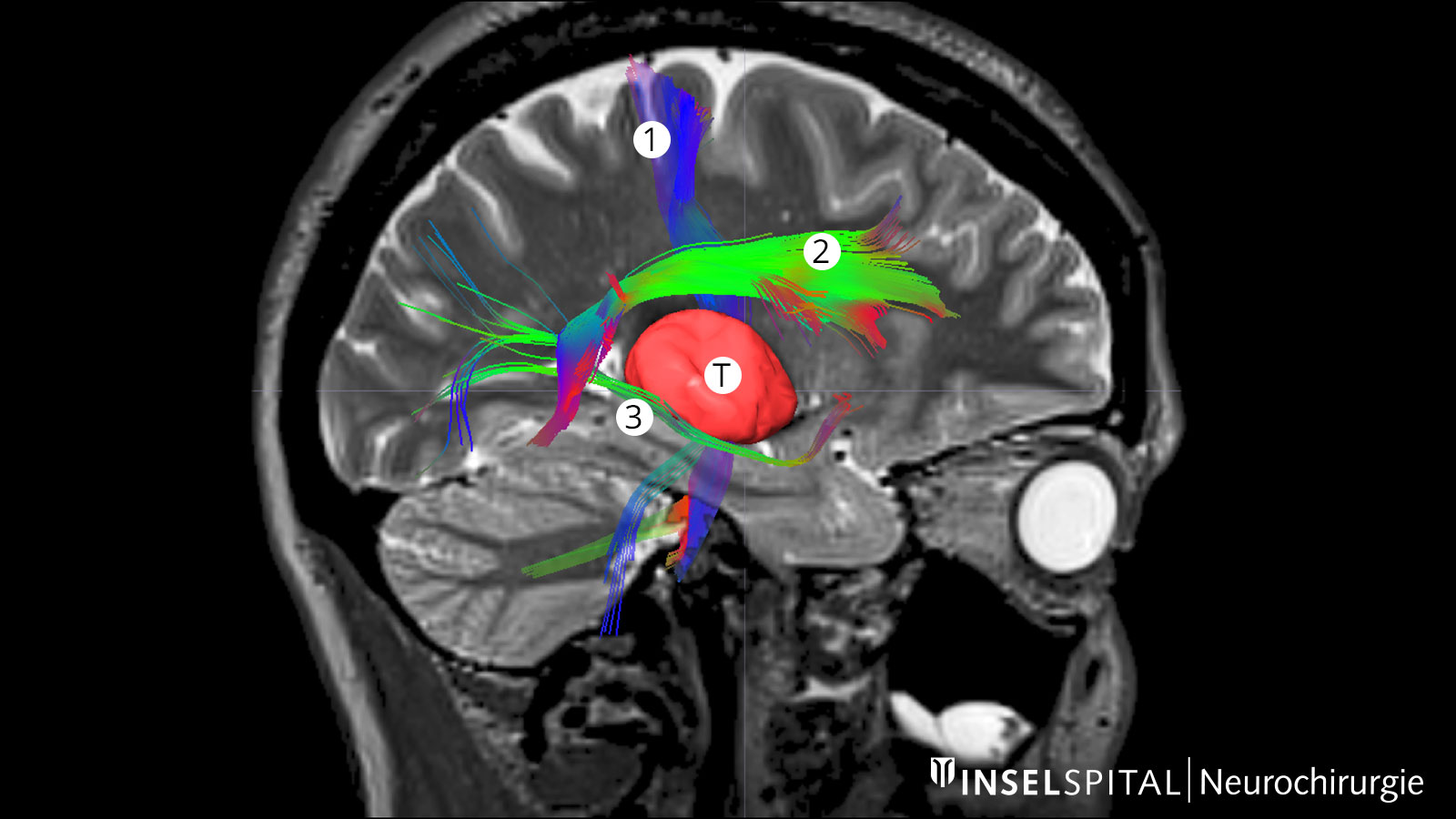
Astrozytome und Oligodendrogliome sind niedriggradige Hirntumoren aus der Gruppe der Gliome. Sie wachsen eher langsam – über Jahre oder sogar Jahrzehnte hinweg. Allerdings besteht die Gefahr, dass sich ein niedriggradiges Gliom bösartig verändert und dann aggressiv weiterwächst. Diese sogenannte maligne Transformation ist abhängig vom Gewebetyp des Tumors, seinen molekularen Eigenschaften und seiner Grösse. Die Standardtherapie bei Astrozytomen und Oligodendrogliomen ist die Operation – bei Bedarf ergänzt durch Chemotherapie und Bestrahlung.
Inselspital Neurochirurgie – unsere Zahlen und Fakten
- Exzellenz: hochspezialisierte Neurochirurginnen und Neurochirurgen sowie speziell ausgebildete Onkologiepflegekräfte (Advanced Practice Nurses oder kurz APN)
- Expertise: 417 Tumoroperationen (Biopsien und Resektionen) im Jahr 2024, davon 359 Gliome
- Interdisziplinäres Team: In unserem wöchentlichen Tumor-Board treffen sich Spezialisten aus 7 Disziplinen – Neurochirurgie, Neurologie, Neuroradiologie, Onkologie, Nuklearmedizin, Radioonkologie, Pathologie
- Entwickelt und erforscht am Inselspital: innovative Neuromonitoring- und Navigationstechniken zur Operationssicherheit und Vermeidung von Defiziten
- Defizitrate unter den niedrigsten weltweit: Die dokumentierte und publizierte Rate von 3–5 % für dauerhafte operationsbedingte Defizite bei motorisch eloquenten Risikotumoren gehört zu den niedrigsten weltweit!
- Resektionsrate unter den höchsten weltweit: Die Rate von > 90 % Komplettresektion bei Gliomen gehört zu den höchsten weltweit!
- Hochmoderne technologische Ausstattung mit intraoperativer Bildgebung, Fluoreszenztechniken, Laser-Thermotherapie und mehr.
- Ergänzendes Behandlungskonzept: unser OPTIMISST-Protokoll (OPTIMISST steht für Optimized Standard and Supportive Therapy)
- Zertifizierung: Zertifiziertes Hirntumorzentrum seit 2016, Garant für einen hohen Qualitätsmassstab in der onkologischen Behandlung
Klassifikation
Astrozytome und Oligodendrogliome zählen zu den häufigsten niedriggradigen Gliomen und weisen typischerweise eine IDH-Mutation auf.
Der Begriff «niedriggradig» entspricht eigentlich einem Grad 2 nach der WHO-Klassifikation der Tumoren des zentralen Nervensystems. Allerdings können die Ärzte ein Gliom weder anhand des MRI-Bilds noch anhand der Gewebeklassifikation sicher einem Grad 2 oder einem Grad 3 zuordnen. Deshalb lassen sich auch die Wachstums-, Rezidiv- und Entartungsneigung eines solchen Tumors nicht verlässlich vorhersagen. Heute spricht man von niedriggradigen Gliomen in Abgrenzung zu aggressiven Glioblastomen(Grad 4) oder zu IDH-Wildtyp-Tumoren.
Heutzutage kennen wir viele Mutationen der DNA der Tumorzellen, die typisch sind für niedriggradige Gliome und uns wichtige Hinweise auf das Verhalten des Tumors geben. Diese Mutationen dienen als genetische Marker.
- Genetische Marker
Wie erwähnt ist ein Definitionsmerkmal von typischen niedriggradigen Gliomen das Vorhandensein einer IDH-Mutation.
Zusätzliche genetische Mutationen unterteilen diese Tumoren dann weiter in Astrozytome und Oligodendrogliome.
Von einem Oligodendrogliom spricht man, wenn eine spezifische Veränderung zweier Chromosomen vorliegt, nämlich ein Verlust des kurzen Arms des Chromosoms 1 und des langen Arms des Chromosoms 19. Es handelt sich dabei um eine sogenannte unbalancierte Translokation (loss of heterozygosity oder Kodeletion1p/19q).
Bei Astrozytomen liegt diese Kodeletion 1p/19q nicht vor, jedoch findet sich hier typischerweise eine Mutation im ATRX-Gen.
- Das p53-Gen
Eine weitere wichtige Rolle spielt das p53-Gen, dessen Produkt als Tumorsuppressor wirkt und deshalb eine wichtige Kontrollinstanz bei der Regulation des Zellwachstums darstellt. Mutationen im p53 werden bei einer Vielzahl von niedriggradigen Gliomen nachgewiesen, insbesondere wenn eine Transformation zu einem höhergradigen Gliom erfolgt.
Schon früh in der Entstehungsphase eines niedriggradigen Glioms wird eine Veränderung am MDM2-Gen beobachtet, welches als Regulator von p53 fungiert und somit am gleichen genetischen «Hebel» ansetzt.
Wie häufig sind niedriggradige Gliome und wer ist betroffen?
Generell handelt es sich um seltene Tumoren mit einer jährlichen Neudiagnoserate von 1 auf 100 000 Einwohner *.
Astrozytome und Oligodendrogliome treten typischerweise bei jungen Erwachsenen mit einem Durchschnittsalter von 35–45 Jahren auf * * *.
Was ist die Ursache für niedriggradige Gliome?
Die exakte Ursache für die Entstehung von Astrozytomen und Oligodendrogliomen ist unklar.
Der einzige bekannte klare Risikofaktor für die Entwicklung eines niedriggradigen Glioms ist eine vorangegangene Bestrahlung des Kopfs.
Erbliche Faktoren spielen nur eine untergeordnete Rolle. Allerdings treten diese Tumoren bei Patienten mit Neurofibromatose Typ 1 oder Li-Fraumeni-Syndrom, zwei seltenen Erbkrankheiten, häufiger auf.
Was sind die typischen Symptome?
Niedriggradige Gliome wachsen langsam und stören die normalen Funktionen des befallenen Hirnareals nur geringfügig. Das langsame Wachstum erlaubt dem Gehirn, sich anzupassen und wichtige Funktionen aus dem Tumorbereich in andere, gesunde Bereiche des Gehirns zu verlagern. Diese funktionelle Anpassung bezeichnet man als Plastizität. Astrozytome und Oligodendrogliome können so über Jahre auf eine beträchtliche Grösse heranwachsen, ohne dass Beschwerden auftreten. Nicht selten werden diese Tumoren ganz zufällig im MRI entdeckt, nachdem die Bildgebung aus einem anderen Grund veranlasst wurde.
In 80 % der Fälle ist ein epileptischer Anfall das erste Symptom.
Weitere unspezifische Beschwerden wie Kopfschmerzen, Wesensveränderung, Müdigkeit, Schwindel, Gangunsicherheit, Übelkeit und Erbrechen sind möglich, treten aber meist erst dann auf, wenn der Tumor ein grosses Volumen erreicht hat. Zwischen epileptischen Anfällen sind die meisten Patienten beschwerdefrei.
Wie werden niedriggradige Gliome diagnostiziert?
Magnetresonanztomografie
Die Diagnose erfolgt in erster Linie mit Hilfe der Magnetresonanztomografie (MRT oder MRI von magnetic resonance imaging). Im MRI-Bild zeigen sich Astrozytome und Oligodendrogliome als helles Areal in den T2-gewichteten MRI-Sequenzen. Obwohl Astrozytome und Oligodendrogliome im MRI klar abgrenzbar sind, finden sich Tumorzellnester bis mindestens 2 cm um den sichtbaren Tumor herum und einzelne Tumorzellen auch darüber hinaus * *. Deshalb handelt es sich bei Astrozytomen und Oligodendrogliomen um infiltrierende Hirntumoren * *.
Neuroimaging
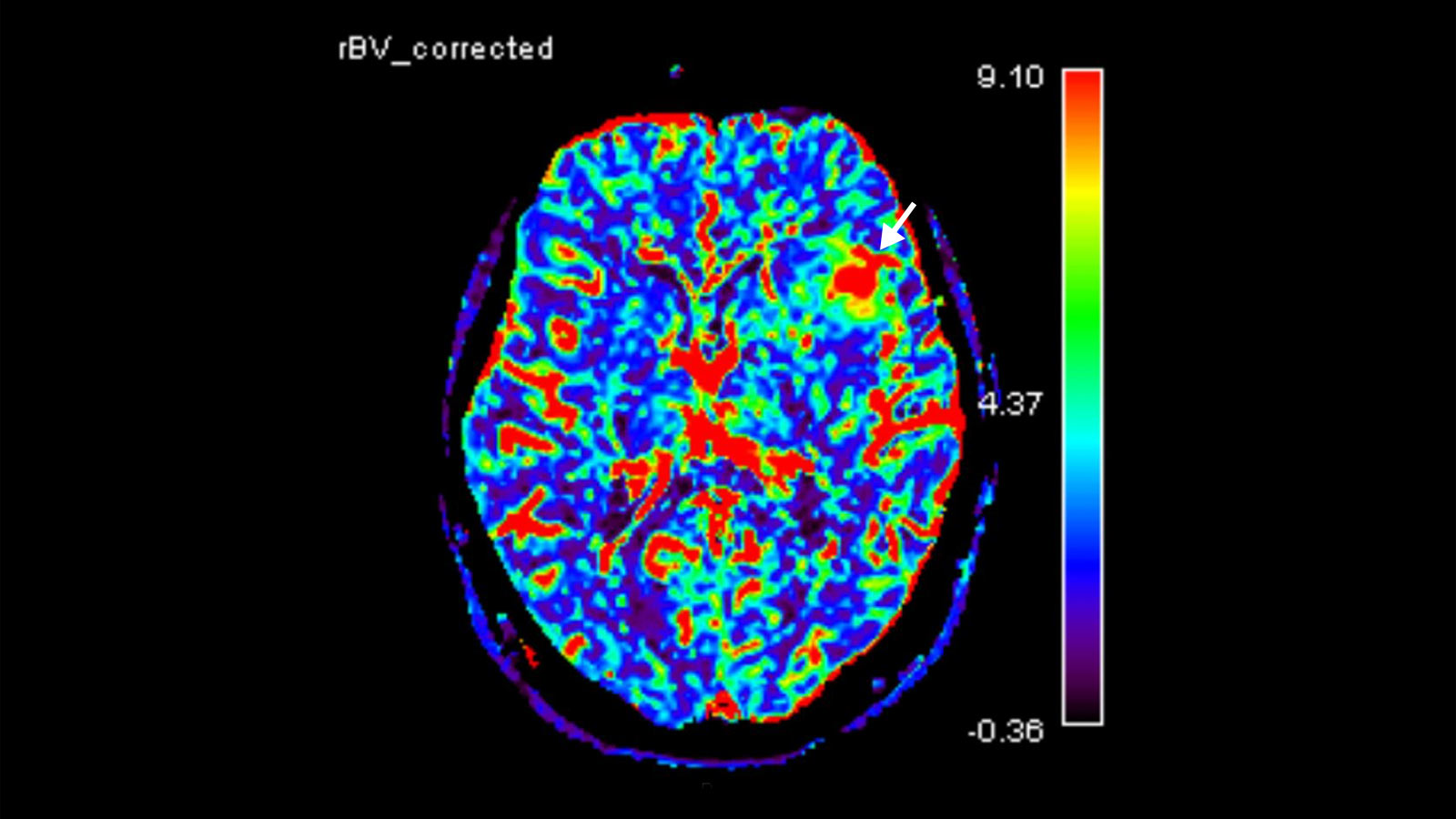
Eine weitere bildgebende Differenzierung kann mittels «Advanced Neuroimaging» erfolgen. Dazu gehören unter anderem Methoden zur Messung des lokalen Blutflusses (Perfusion) sowie zur Messung der lokalen Stoffwechselprodukte (Metabolite) mittels der Magnetresonanzspektroskopie (auch MR-Spektroskopie oder MRS).
Biopsie und Gewebeanalyse
Die Verdachtsdiagnose nach einer MRI-Untersuchung muss jedoch durch eine Gewebeanalyse mittels einer Biopsie oder nach der Tumorentfernung abgesichert werden.
Wie werden niedriggradige Gliome behandelt?
Maligne Transformation
Da niedriggradige Gliome sehr langsam wachsen, ist innerhalb von wenigen Monaten mit keiner wesentlichen Veränderung des Tumors zu rechnen. Aus diesem Grund wurde früher eine Operation oft lange hinausgezögert. Wie man heute weiss, bedeutet dieses lange Abwarten jedoch ein höheres Risiko zur malignen Transformation, also zur Entartung eines Astrozytoms oder Oligodendroglioms in einen bösartigen Tumor.
Obwohl sie teilweise als solche bezeichnet werden, sind niedriggradige Gliome keine wirklich gutartigen Tumoren. Sie wachsen zwar langsam, aber stetig mit durchschnittlich 0,5 bis 4 mm/Jahr * *. Spontanheilungen ohne Therapie kommen nicht vor.
Die maligne Transformation bestimmt die Prognose und Lebenserwartung bei den meisten Patienten. Der Zeitpunkt dafür kann leider nicht vorausgesagt werden. In der wissenschaftlichen Literatur wird das Risiko auf 3–10 % pro Jahr geschätzt, abhängig von der Histologie, den molekularen Eigenschaften und der Tumorgrösse. So steigt das Risiko pro cm Tumorgrösse um etwa 10 % an.
Man weiss heute aber auch, dass eine komplette Tumorentfernung des im MRI sichtbaren Tumors das Risiko für eine bösartige Entartung deutlich reduzieren kann.
Welche Faktoren bestimmen den Langzeiterfolg der Behandlung?
Beeinflussbare Faktoren
- Zeit bis zur Operation
Je länger die Wartezeit in Jahren, desto höher ist die Rate der Entartungen. - Ausmass der Tumorresektion
Standardziel ist die Verkleinerung, aber das optimale Ziel ist die komplette Entfernung mit zusätzlicher Marge (supramarginale Entfernung) für die beste Prognose nach Operation. - Therapie
Durchführung einer Chemotherapie bei inoperablen Tumoren oder Tumorresten, gegebenenfalls in Kombination mit einer Strahlentherapie.
Nicht beeinflussbare Faktoren
- Alter des Patienten
- initiale Grösse des Glioms
- bereits vorliegende neurologische Defizite durch das Gliom
- genetisches molekulares Profil des Glioms
- Gewebetyp
- multiple Tumorlokalisationen
Unser OPTIMISST-Protokoll
Es gibt eine Reihe von Faktoren, die dazu beitragen, dass eine Tumorbehandlung erfolgreicher ist. Wir haben auf Grundlage dieser Faktoren ein eigenes Behandlungskonzept entwickelt, das sogenannte OPTIMISST-Protokoll. OPTIMISST steht dabei für «Optimized Standard and Supportive Therapy» und ergänzt die klassische Therapie bei Hirntumoren. Dieses Protokoll gibt es in dieser Form nur an unserer Klinik.
Operation – die Standardtherapie
Die Standardtherapie bei Astrozytomen und Oligodendrogliomen ist die chirurgische Entfernung oder Resektion * * * * * *.
Für die Operation gibt es 3 Stufen der Radikalität:
- eine Verkleinerung der Tumormasse
- eine komplette Entfernung des im MRI-Bild sichtbaren Tumors
- eine komplette Entfernung des im MRI-Bild sichtbaren Tumors mit Sicherheitszone (supramarginale Resektion)
Je mehr bei der OP vom Tumor entfernt werden kann, umso günstiger der weitere Krankheitsverlauf: Die Erkrankung schreitet langsamer fort, der Zeitpunkt bis zur bösartigen Entartung verzögert sich und die Überlebenszeit verlängert sich * * * * * * * * * * * * * *.
Ziel der Resektion ist es deshalb, den Tumor radikal bis an die Grenze zum funktionierenden Hirngewebe zu entfernen. Da die Unterscheidung zwischen Tumor und Hirngewebe speziell im Randbereich oft schwierig ist, kommen hier verschiedene moderne Technologien zum Einsatz.
Operation mit Marge: die supramarginale Resektion
Astrozytome und Oligodendrogliome haben Tumorzellen, die über den im MRI sichtbaren Rand hinausgehen. Bei einer supramarginalen Resektion wird ein zusätzlicher Sicherheitsabstand von 1–2 cm mit entfernt, was einen positiven Einfluss auf die Wahrscheinlichkeit eines Rezidivs hat * * *.
Während der Operation wird der Tumor mit diesem Sicherheitsabstand entfernt, sofern das Neuromonitoring dort keine wichtigen Areale feststellt. Diese Technik sollte immer gleichzeitig mit neurophysiologischem Monitoring und Mapping durchgeführt werden, um bleibende neurologische Schäden zu vermeiden.
Operationssicherheit
- am Inselspital entwickelt: dynamisches Mapping und Low-Threshold-Mapping
- Inselspital führend auf dem Gebiet der Operationssicherheit durch modernste Mapping-Methoden
- weniger Lähmungen im Vergleich zu bisherigen Methoden
- radikalere Tumorentfernung auch in unmittelbarer Nachbarschaft zu Bewegungszentren und Kraftbahnen möglich
Vor der Operation
Magnetresonanztomografie
Für eine optimale Vorbereitung wird zunächst ein spezielles MRI durchgeführt. So kann der Tumor möglichst genau beurteilt und die Operation präzise geplant werden. Je nach Lokalisation des Tumors sind unter Umständen weitere Untersuchungen erforderlich.
Ein funktionelles MRI (fMRI) kann wertvolle Informationen zur Lokalisation der Sprachfunktion und der Bewegungszentren beitragen.
Navigierte transkranielle Magnetstimulation
Für die genaue Lokalisation der Bewegungszentren wird oft eine navigierte transkranielle Magnetstimulation (nTMS) durchgeführt. Es handelt sich um eine nicht-invasive Untersuchung, welche von den meisten Patienten problemlos toleriert wird und die am Inselspital im Rahmen einer multizentrischen Studie angeboten wird. Die so erhobenen Daten helfen dem Chirurgen bei der Planung des operativen Zugangs und beim Festlegen der operativen Strategie.
Fiber Tracking: Darstellung der Hirnfaserbahnen
Als Traktografie oder Fiber Tracking werden Verfahren bezeichnet, mit denen die Faserbahnen im Gehirn visualisiert werden können. Die Darstellung dieser Bahnen vor der Operation hilft dem Chirurgen, den optimalen und sichersten Weg zum Tumor vorbei an allen wichtigen Faserbahnen zu finden.
Äusserst wichtig ist dies für die Pyramidenbahn. Sie stellt die direkte Verbindung zwischen dem motorischen Zentrum des Gehirns und des Rückenmarks dar und muss bei einer Operation unbedingt geschont werden. Weitere wichtige Faserbahnen betreffen vor allem Hirnfunktionen wie Sprechen und Sehen.
Während der Operation
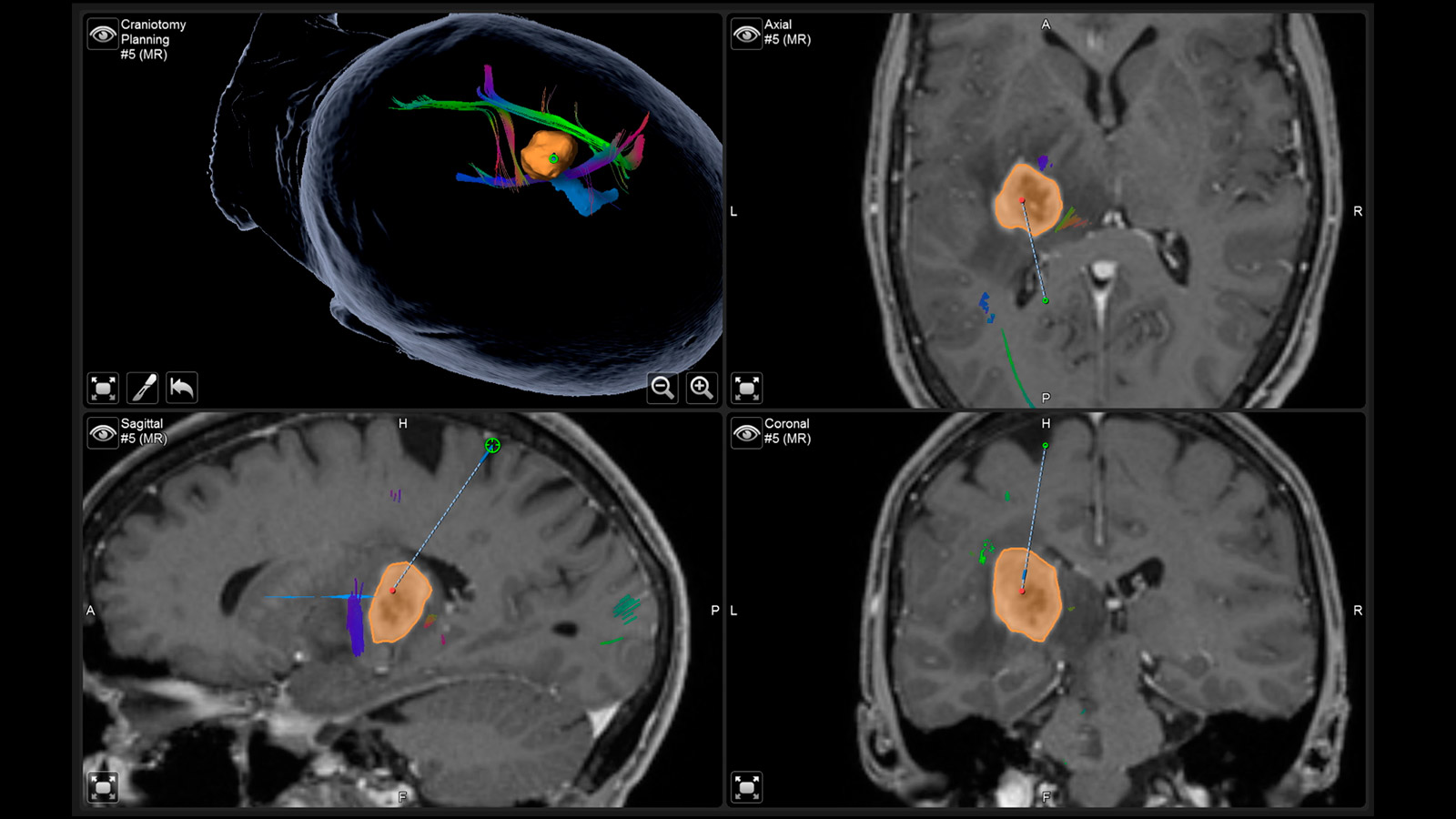
Neuronavigation
Die Neuronavigation funktioniert wie ein «GPS» während der Operation und weist dem Neurochirurgen den Weg, wobei das vor der OP durchgeführte MRI das individuelle «Kartenmaterial» liefert.
Augmented Reality
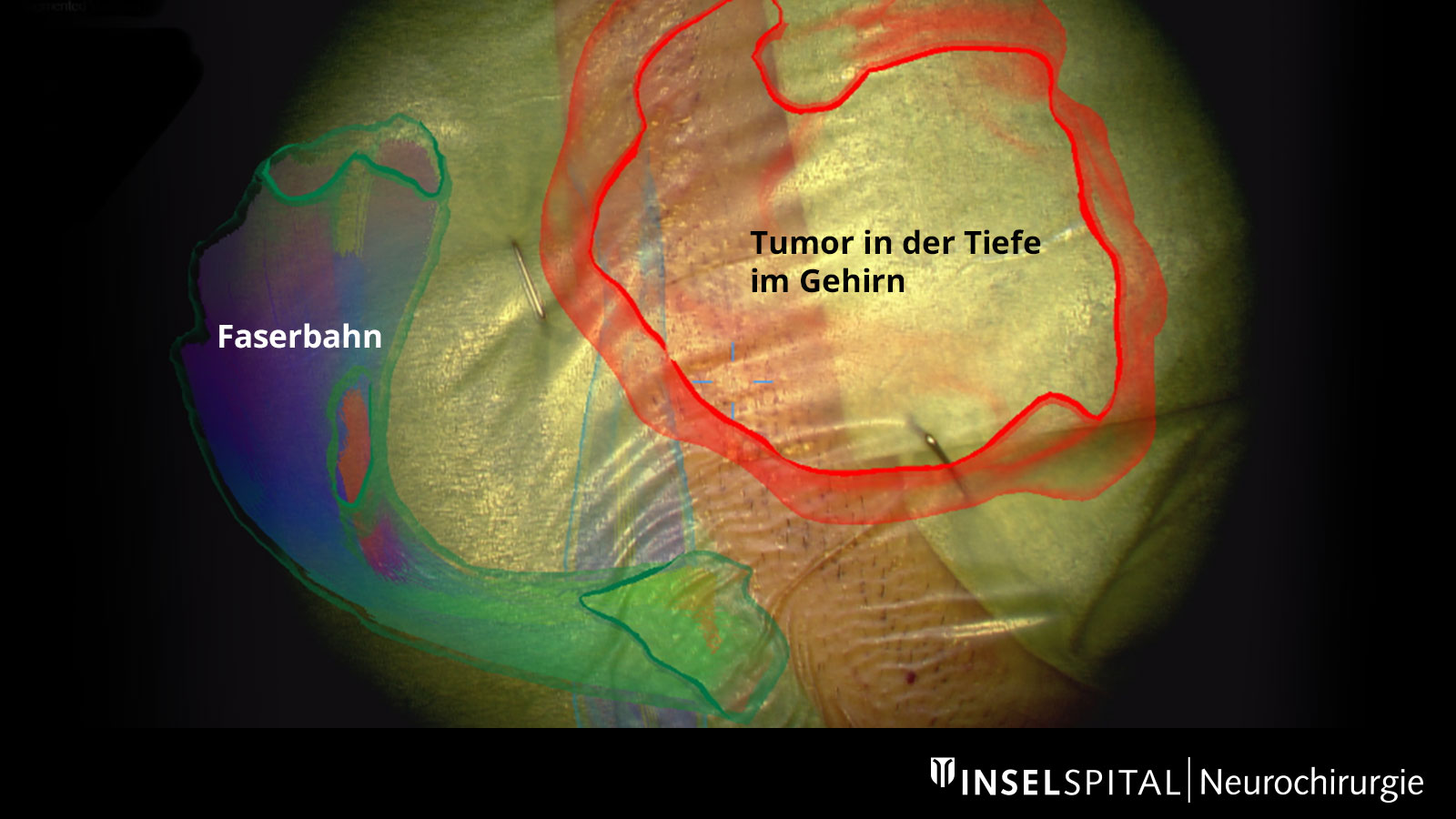
Die bereits vor der Operation eingezeichneten Faserbahnen, ebenso wie der Tumor selbst und weitere wichtige Zentren lassen sich im Operationsmikroskop virtuell einblenden und auf die Kopfoberfläche projizieren. Mit Hilfe dieser Augmented Reality kann sich der Chirurg besser orientieren und den Zugang zum Tumor so klein wie möglich, aber so gross wie nötig planen.
Dynamisches Mapping
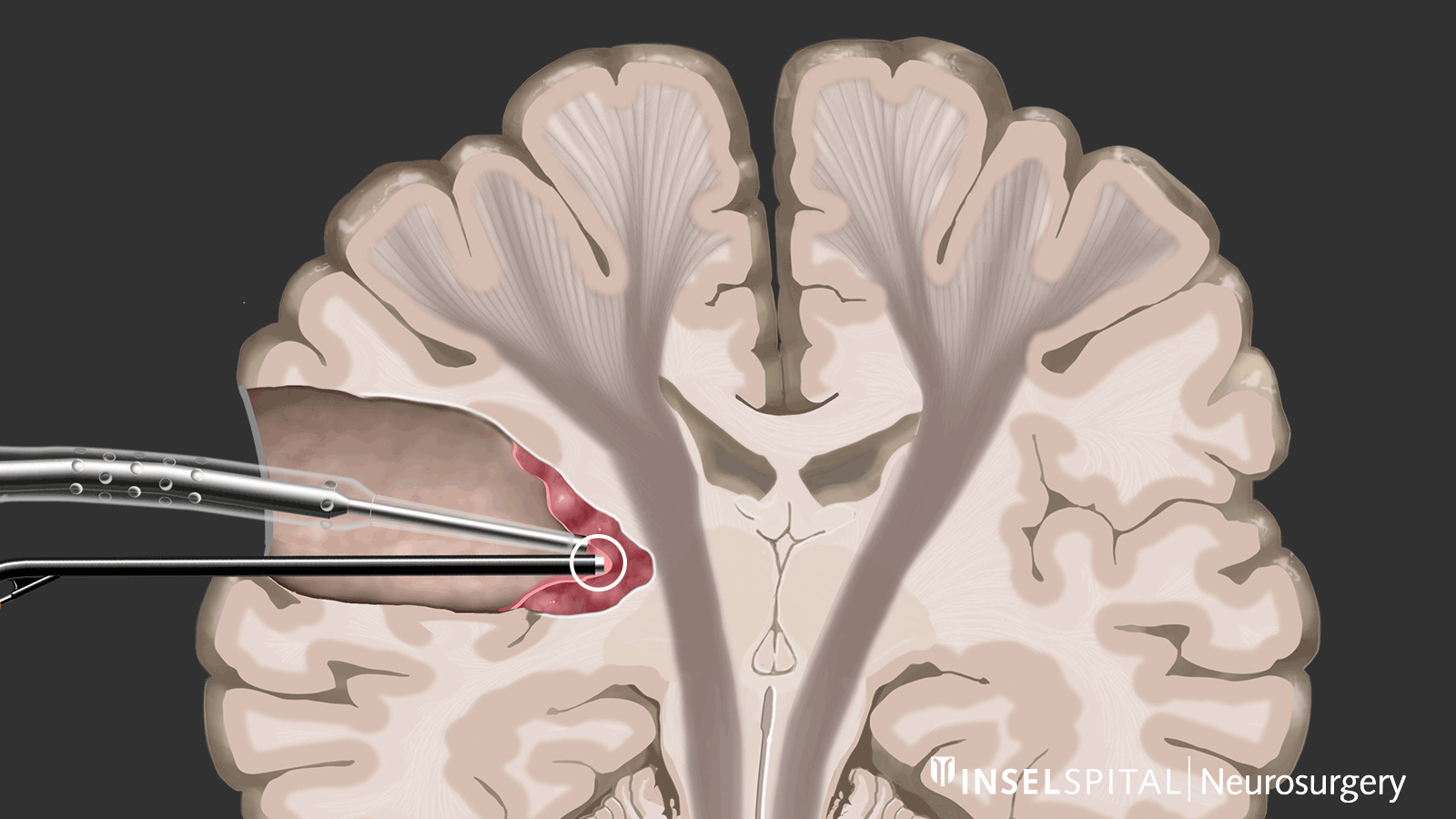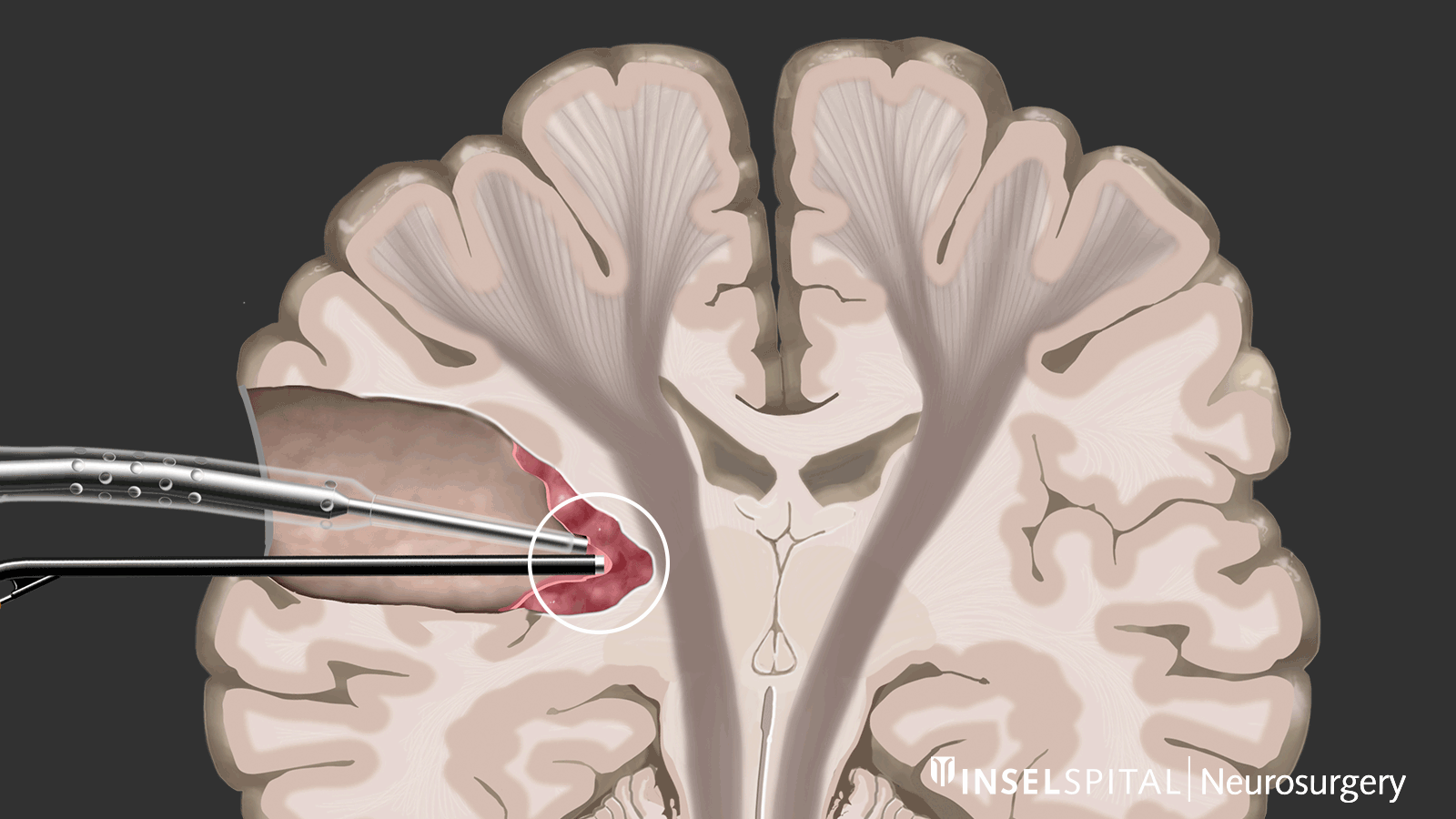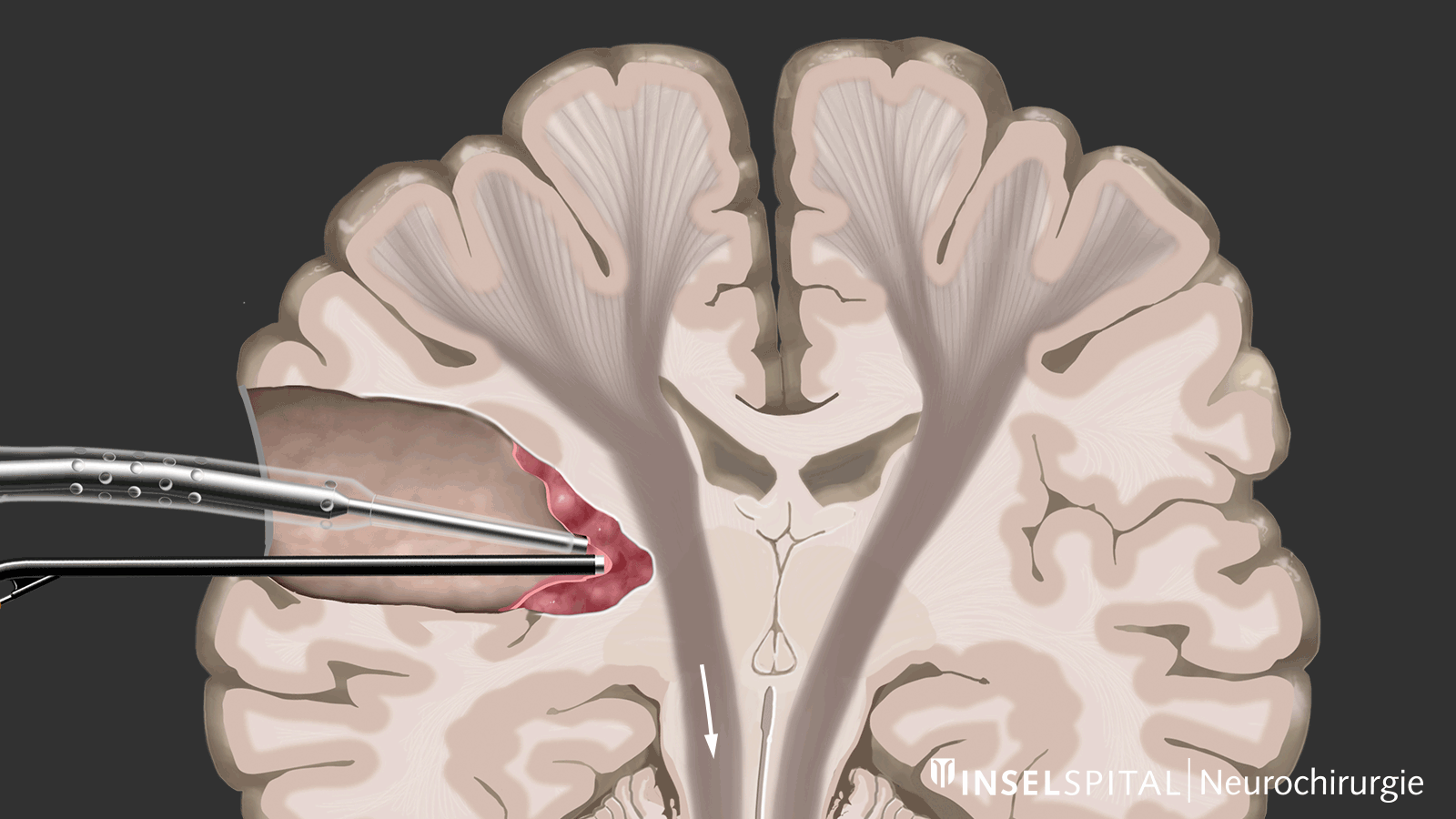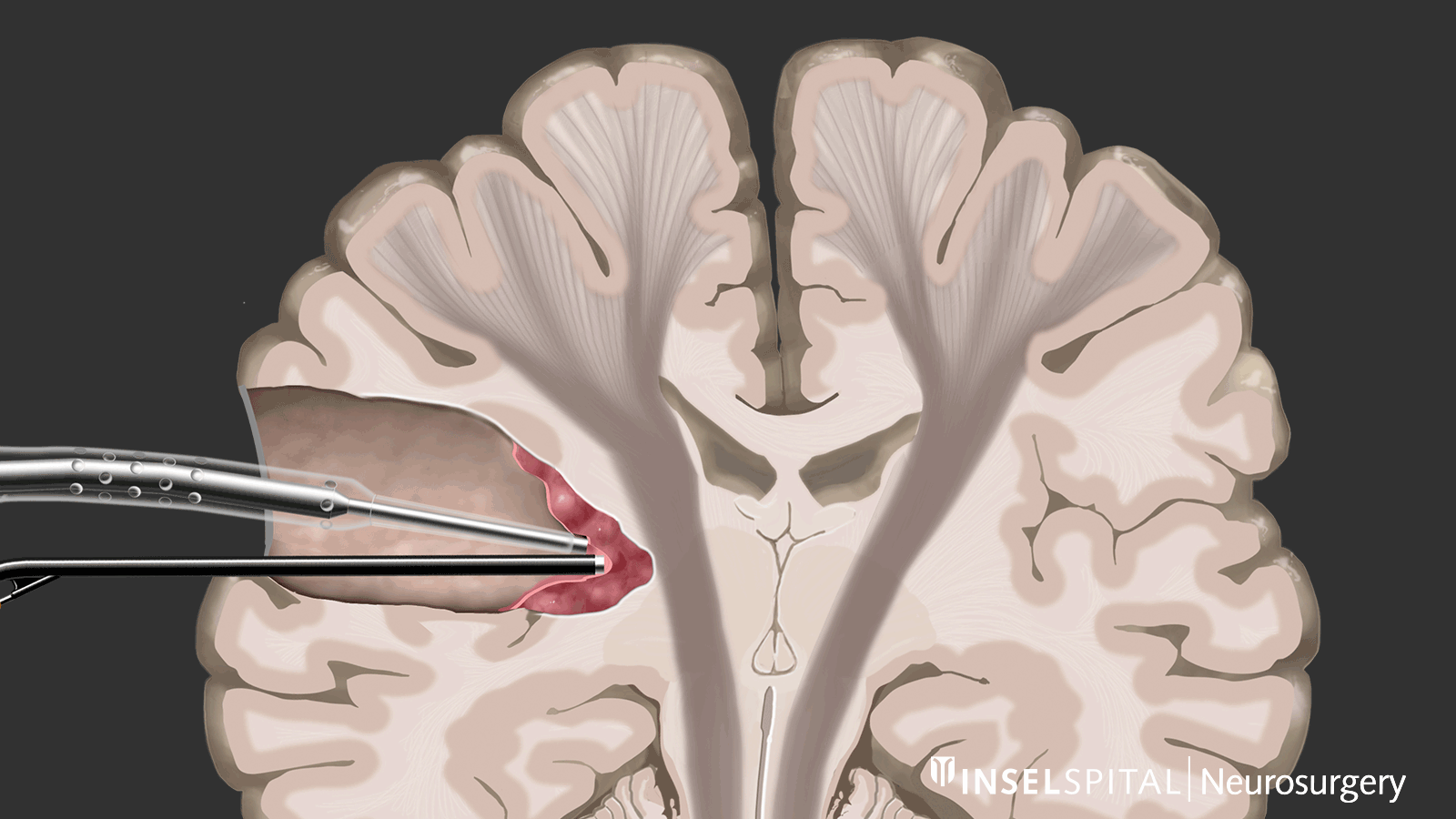
Unter dynamischem Mapping versteht man die kontinuierliche Abtastung des Hirngewebes am Ort der Tumorentfernung mit einem Radar aus Mikroströmen. Die Operation eines Glioms sollte bei kritischer Tumorlage immer mit spezialisiertem Funktionsmapping von Sprache, Bewegung, Sehen und höheren Hirnfunktionen durchgeführt werden.
Dank dieses Verfahrens und des umfassenden intraoperativen Monitorings ist die Komplikationsrate für solche Operationen heutzutage sehr tief * * * * * * * *.
Wachoperation
Im Gegensatz zur Motorik können komplexe Funktionen wie Sprache, Sprachverständnis, Rechnen, Musizieren oder Lesen beim Patienten in Narkose nicht überwacht werden. Daher ist es notwendig, dass der Patient während eines Teils der Operation wach ist und gemeinsam mit einem Neuropsychologen spezielle Tests durchführt. Die Lage eines unsichtbaren Zentrums kann so lokalisiert und bei der Operation geschont werden.
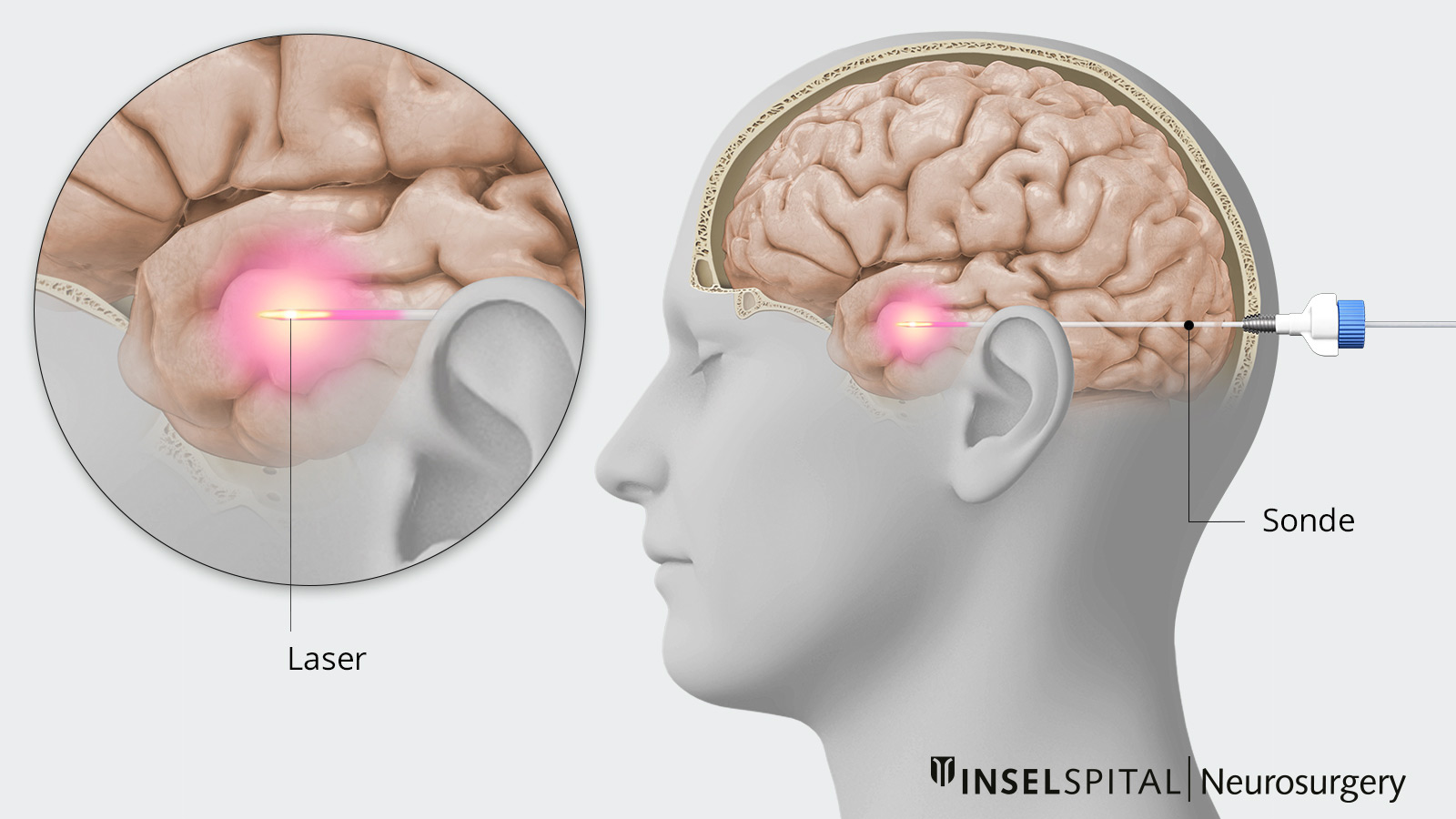
Laserinduzierte Thermotherapie (LITT)
Die laserinduzierte Thermotherapie (auch interstitielle Laserthermotherapie oder kurz LITT) ist ein minimal-invasives, bildgestütztes Verfahren. Dabei wird mithilfe von Laserenergie gezielt Gewebe erhitzt und zerstört. LITT wird vor allem zur Behandlung von Epilepsieherden, Hirntumoren oder anderen tief gelegenen Veränderungen im Gehirn eingesetzt.
Intraoperative Bildgebung
Da die Unterscheidung zwischen gesundem Gewebe und Tumorgewebe selbst unter dem Mikroskop schwierig ist, kommen verschiedene bildgebende Modalitäten noch während der Operation zum Einsatz, um direkt das Resektionsausmass zu überprüfen.
Ultraschall wird routinemässig eingesetzt, hat aber seine Grenzen bei der Darstellung von Resttumorgewebe.
Die genaueste Methode ist die Überprüfung im intraoperativen MRI. Hierzu wird der Patient nach Entfernung des Tumors noch während der Operation ins MRI transferiert. So kann ein Tumorrest, falls vorhanden, noch in der laufenden Operation entfernt werden. Hierzu wurde am Inselspital ein Operationssaal mit direkter Anbindung an ein Hochfeld-MRI-Gerät gebaut.
Nach der Operation
Histologie
Nach der feingeweblichen (histologischen) und molekulargenetischen Untersuchung des entfernten Gewebes wird das weitere Vorgehen von einem interdisziplinären Team von Spezialisten bestehend aus Neurochirurgen, Radioonkologen und medizinischen Onkologen während unseres wöchentlichen Tumor-Boards am Inselspital besprochen.
Nachbehandlung und Kontrollen
In den meisten Fällen kann auf Chemotherapie und Bestrahlung verzichtet werden. Durch engmaschige Nachkontrollen mit MRI alle 3–6 Monate kann ein Wiederauftreten des Tumors frühzeitig erkannt und behandelt werden. Diese Strategie ist insbesondere für jüngere Patienten unter 40–50 Jahren nach vollständiger Entfernung des Tumors angezeigt.
In manchen Fällen ist eine kombinierte Chemo- und Strahlentherapie sinnvoll. Hierzu zählen:
- unvollständige Entfernung des Tumors
- höheres Patientenalter
- sehr grosser Tumor
- neurologische Ausfälle beim Patienten
- Tumor mit WHO-Grad 3
- IDH-Wildtyp-Gliome
Bei Grad-II-Gliomen wird eine Chemotherapie bevorzugt, weil man eine Strahlentherapie aufgrund der relativ langen Lebenserwartung vermeiden möchte.
Neurokognitive Testung
Ziel der Operation ist es, dass Patienten nach der OP rasch in ihr normales Leben zurückkehren können. Ein elementarer Teil des Behandlungskonzepts ist dabei die neurokognitive Testung der individuellen Hirnleistung vor und nach der Behandlung.
Vor der Operation: Es wird ein Ausgangswert für verschiedene neurokognitive Bereiche wie Aufmerksamkeit, Merkfähigkeit etc. erhoben. Eine spezialisierte Testung erlaubt hierbei die Objektivierung von subtilen Defiziten, die einer normalen neurologischen Untersuchung entgehen würden * * * * * * * *.
Nach der Operation: Es erfolgt eine erneute Testung, so dass Unterschiede zu den neurokognitiven Leistungen vor der Operation konsequent erfasst und gegebenenfalls durch neurorehabilitative Massnahmen korrigiert werden können. Mit Hilfe von ambulanten oder stationären Rehabilitationsmassnahmen gleich im Anschluss an die Operation wird eine optimale Wiedereingliederung in Beruf und Alltag erreicht *.
Epileptische Anfälle
Ein weiterer wichtiger Faktor in der Lebensqualität von Patienten mit niedriggradigen Gliomen ist die Kontrolle von epileptischen Anfällen.
Nach einer kompletten Tumorresektion werden bis zu zwei Drittel der Patienten mit vorbestehenden epileptischen Anfällen im ersten Jahr nach der Operation anfallsfrei *. Die Wahrscheinlichkeit für die Anfallsfreiheit ist höher, wenn der Tumor möglichst komplett entfernt werden konnte und die Epilepsie vorher nicht länger als ein Jahr aufgetreten ist.
Treten nach einem anfallsfreien Intervall plötzlich wieder vermehrt Anfälle auf, kann dies ein Hinweis auf ein Tumorrezidiv sein.
Was, wenn nicht operiert werden kann?
Wenn ein Tumor aufgrund seiner Lage in einem funktionell wichtigen Zentrum oder aufgrund seiner diffusen Ausdehnung nicht operiert werden kann, sollte zumindest eine Biopsie zur Gewebeuntersuchung und Diagnosesicherung durchgeführt werden.
Biopsie
Bei einer Biopsie wird über ein kleines Loch zielgenau eine dünne Nadel in den Tumor eingeführt und eine Gewebeprobe entnommen. Das Komplikationsrisiko einer Biopsie ist sehr niedrig, bedrohliche Blutungen treten nur in ca. 1 % der Fälle auf.
Ein häufigeres Problem ist jedoch die falsche Graduierung von Tumoren in bis zu einem Viertel der Fälle *: Da ein Gliom sehr heterogen aus Zellen unterschiedlicher WHO-Grade zusammengesetzt sein kann, führt die Biopsie eines weniger bösartigen Anteils zur falschen Diagnose eines niedriggradigen Glioms, obwohl es sich in Wirklichkeit um ein höhergradiges aggressives Gliom handelt.
Um die Rate an Fehldiagnosen zu mindern, setzen wir bei Biopsien routinemässig Verfahren wie die MR-Spektroskopie oder die FET-PET ein.
Sobald nach der Biopsie eine exakte Diagnose vorliegt, wird der Tumor mittels Bestrahlung und Chemotherapie weiterbehandelt.
In Einzelfällen kann bei einem inoperablen niedriggradigen Gliom eine Chemotherapie vor einer späteren Operation Sinn machen. Durch die Chemotherapie kann der Tumor so weit zurückgedrängt werden, dass aus einem inoperablen ein operabler Tumor wird *. Dies ist jedoch eher eine Ausnahme und stellt kein Standardvorgehen dar.
Was, wenn der Tumor wiederkehrt?
Die weitere Behandlung bei Tumorprogression hängt von verschiedenen Faktoren ab:
- neurologischer Zustand des Patienten
- zeitliche Dynamik
- molekularen Tumormarker
- bereits erfolgten Therapien
Die Therapie der Wahl beim Rezidiv, also einem wachsenden Tumor, ist wieder die chirurgische Entfernung.
Das Hirn verfügt grundsätzlich über die Fähigkeit, Funktionen von einem durch den Tumor gefährdeten Hirnareal auf ein anderes Hirnareal zu verlagern. Man bezeichnet dies als Plastizität. Deshalb ist es durchaus möglich, den Tumor in einer zweiten Operation von einem Ort zu entfernen, bei dem in der ersten Operation noch Hirnfunktionen vorhanden waren.
Eine Bestrahlung und/oder eine Chemotherapie werden dann erwogen, wenn zumindest ein Teil des Tumors nicht mehr operiert werden kann. Die Wahl der Chemotherapie hängt dabei vom genetischen Charakter des Tumors ab.
Chemotherapie
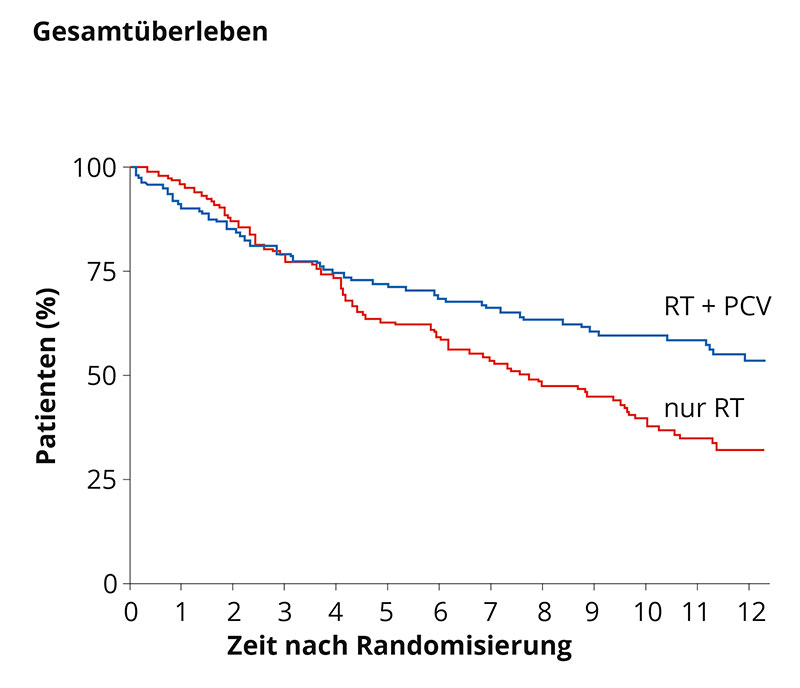
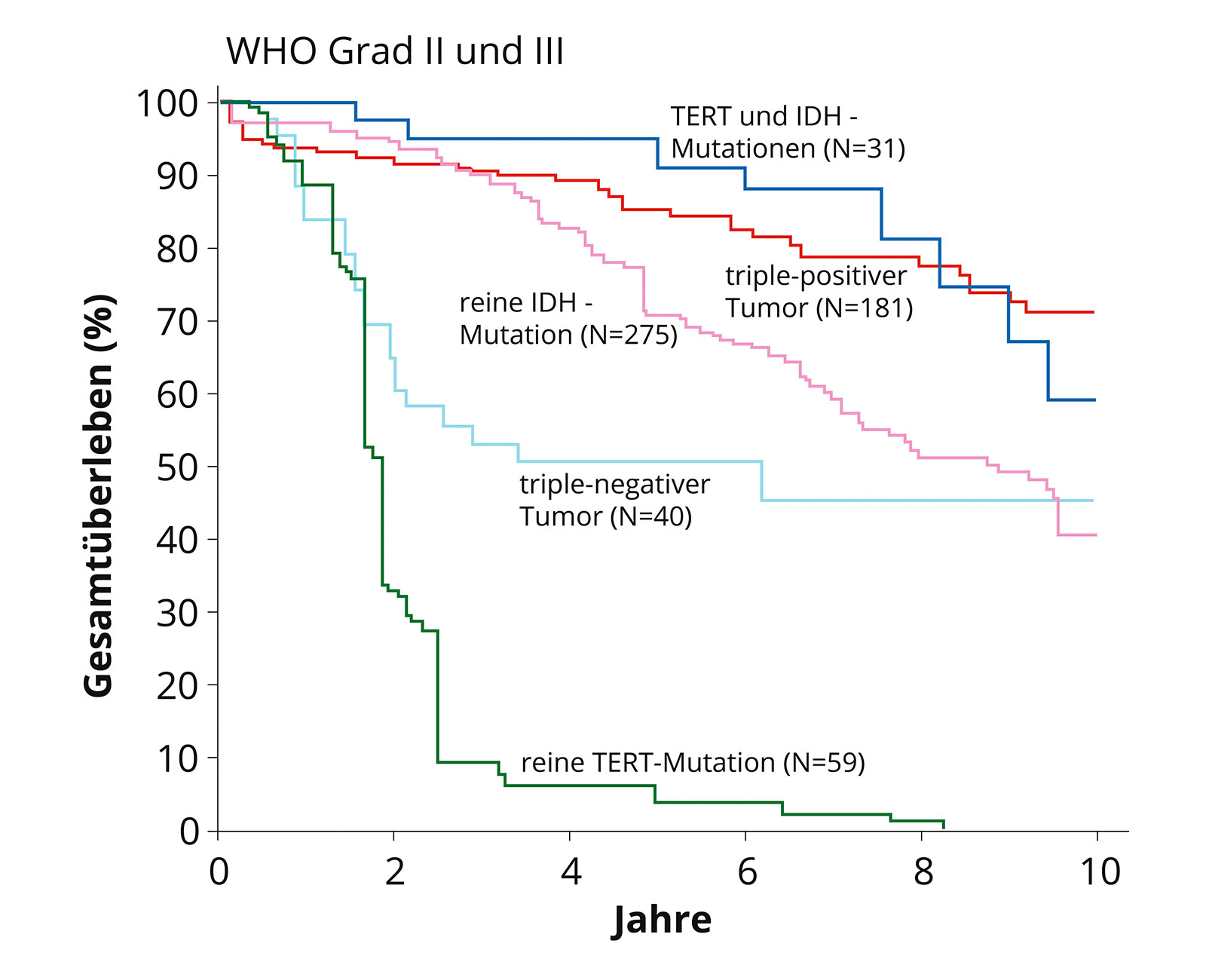
Eine internationale Studie konnte nachweisen, dass Patienten mit einem WHO-Grad-II-Gliom und den oben genannten Risikofaktoren zusätzlich zur Bestrahlung von einer Chemotherapie profitieren *.
In der Grafik rechts wird das Gesamtüberleben von Patienten mit WHO-Grad-II-Tumoren und zusätzlichen Risikofaktoren in zwei Kurven gegenübergestellt. Die blaue Kurve stellt das Gesamtüberleben von Patienten nach einer kombinierten Therapie von Bestrahlung (RT für Radiotherapy) und Chemotherapie (PCV) dar und zeigt ein höheres Gesamtüberleben als die rote Kurve mit Patienten, die eine Strahlentherapie als alleinige Therapie hatten.
Eine Chemotherapie kann allerdings nicht beliebig oft erfolgen, denn Tumoren entwickeln häufig eine Resistenz gegen Chemotherapien. Aus diesem Grund setzt man sie in der Regel nur bei Risikofaktoren oder bei maligner Entartung des Glioms ein.
- Chemotherapeutika
Als Chemotherapeutika kommen einerseits Temozolomid (Handelsname Temodal®) oder PCV zur Anwendung. PCV steht für die Kombination von 3 Substanzen (Procarbazin, Lomustin und Vincristin) und wird in der Regel bei Oligodendrogliomen mit 1p19q-Kodeletion eingesetzt. Bei diffusen Astrozytomen mit ATRX-Mutation kommt häufiger Temozolomid zur Anwendung.
Bestrahlungstherapie
Die Bestrahlung erfolgt in der Regel in 30 Sitzungen mit einer Dosis von je 1,8 Gy bis zu einer Gesamtdosis von 54 Gy. Die häufigsten Nebenwirkungen bei Bestrahlung sind Müdigkeit, Übelkeit, Hautreizungen und Haarverlust. Die Bestrahlung hat zudem den Nachteil, dass Jahre nach der Behandlung Langzeitschäden des Gehirns wie eine Leukenzephalopathie oder eine generelle Verschlechterung der Hirnfunktionen vorkommen können.
Die EORTC-22845-Studie konnte nachweisen, dass eine frühe gegenüber einer späteren Bestrahlung keinen Vorteil hinsichtlich des Gesamtüberlebens bringt *. Eine frühe Bestrahlung verbessert lediglich das progressionsfreie (rezidivfreie) Überleben, jedoch nicht das Gesamtüberleben.
Eine volle Bestrahlung kann auch nur einmal gegeben werden. Aus diesem Grund setzt man sie in der Regel nur bei Risikofaktoren oder bei maligner Entartung des Glioms ein.
Komplementärmedizin
Eine Beratung über die komplementärmedizinischen Therapiemöglichkeiten steht Ihnen auf Wunsch am Institut für Komplementäre und Integrative Medizin auf dem Inselareal zur Verfügung. Wir können Sie gerne in die Sprechstunde überweisen. Das Angebot des Instituts umfasst die anthroposophisch erweiterte Medizin, Phytotherapie, Ernährungsberatung, Kunsttherapien, Heileurythmie sowie eine Beratung zu Lebensführung und Selbstverstärkung.
Spezialfall: Diffuses Astrozytom ohne IDH-Mutation (IDH-Wildtyp)
Die genetischen Marker bei niedriggradigen Gliomen sind äusserst wichtig, da sich unter ihnen auch Tumoren mit einem anderen Wachstumsverhalten «verstecken».
Ein solcher Spezialfall stellen diffuse Astrozytome WHO-Grad II ohne IDH-Mutation dar (IDH-Wildtyp). Obwohl diese von der WHO als Grad II eingeteilt werden, verhalten sie sich biologisch anders, zeigen oft ein aggressiveres Wachstum und sind mit einem kürzeren Überleben assoziiert *. Daher sollte bei diesen Tumoren nach vollständiger Resektion auch eine Nachbehandlung mit Bestrahlung und Chemotherapie erfolgen.
- Genetische Marker IDH-Wildtyp
Die typische genetische Signatur eines diffusen Astrozytoms mit IDH-Mutation ist eine Veränderung im p53- und ATRX-Gen. Demgegenüber weisen diffuse Astrozytome ohne IDH-Mutation (IDH-Wildtyp) Veränderungen in den Tumorsuppressor-Genen von PTEN, NF1 und CDKN2A sowie im Gen für den EGF-Rezeptor und im TERT-Gen auf *.
Beim Produkt des TERT-Gens handelt es sich um ein Enzym, dass die fortschreitende Kürzung der Chromosomenenden bei rascher Zellteilung verhindert. Dadurch wird die Seneszenz einer Zelle hinausgezögert.
Der EGF-Rezeptor nimmt Signale aus der Umgebung einer Zelle auf, welche Wachstum und Teilung einer Zelle vermitteln. Die beiden letztgenannten Gene sind bei einem IDH-Wildtyp-Gliom typischerweise überaktiv.
Die häufigsten Fragen unserer Patienten
- Warum gleich operieren, wenn der Tumor doch nur langsam wächst?
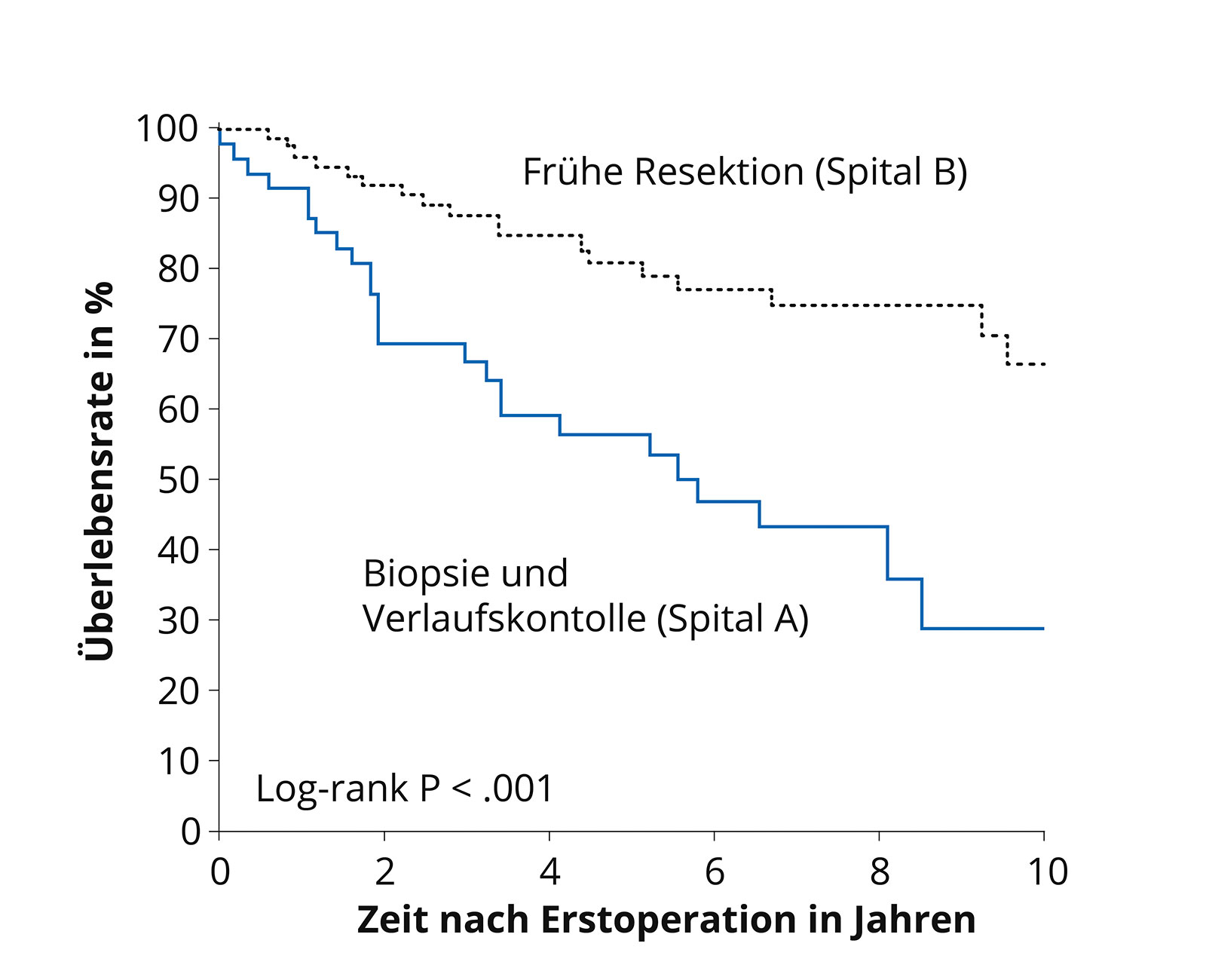
Gegenüberstellung der Behandlungskonzepte. Ein Behandlungskonzept mit früher Resektion (schwarze Kurve) führt zu einem längeren Überleben als ein Konzept, welches nur eine Biopsie bzw. eine abwartende Haltung bevorzugt (blaue Kurve). Quelle: Nach Jakola et al. Comparison of a strategy favoring early surgical resection vs a strategy favoring watchful waiting in low-grade gliomas. JAMA 2012; 308(18):1881-8. Früher wurde bei niedriggradigen Gliomen eher abwartend behandelt und spät operiert. Dies hatte mehrere Gründe. Zum einen, ging es den meisten Patienten zum Zeitpunkt der Diagnose noch sehr gut. Ausserdem war es selten möglich, den Tumor vollständig zu entfernen, da die technologische Entwicklung noch nicht so weit war wie heute. Und auch die modernen Methoden zur Überwachung von Hirnfunktionen und Vermeidung von Defiziten bei einer Operation waren noch nicht sehr ausgereift.
Die moderne Strategie der sehr zeitigen Operation beruht auf relativ neuen wissenschaftlichen Erkenntnissen. Ein Vergleich der Überlebenszeiten von Patienten zweier Universitätsspitäler mit zwei unterschiedlichen, aber konsequent verfolgten Behandlungskonzepten hat einen klaren Überlebensvorteil zugunsten der zeitig operierten Patienten gezeigt. Eine Verlaufsbeobachtung über Jahre oder eine Biopsie mit anschliessender Chemotherapie oder Bestrahlung ohne Operation haben danach häufiger bösartige Entartungen (maligne Transformationen) sowie einen schnelleren Krankheitsverlauf zur Folge *.
Das langsame Wachstumsverhalten dieser Tumoren macht es möglich, den Entscheid zur Operation sorgfältig und ohne Hast zu treffen. Die Operation sollte innerhalb einiger Monate nach Diagnosestellung durchgeführt werden.
- Wo sollte ich die Operation durchführen lassen?
Gliome sollten in einem Neuroonkologisches Zentrum mit grosser Fallzahl, ausgewiesener Erfahrung, modernster Technik und echter interdisziplinärer Kooperation operiert werden. Da der Begriff «Kompetenzzentrum» nicht geschützt ist, lohnt es sich, die Kriterien näher anzuschauen, die wirklich relevant sind für die Beurteilung eines Spitals:
- Vergleich der offiziellen Zahlen operierter Gliome basierend auf der Statistik des Spitals oder der öffentlichen Statistiken des Bunds.
- Zahl der nationalen und internationalen Publikationen, also Veröffentlichungen der spitaleigenen Ergebnisse in wissenschaftlichen Zeitschriften zum Thema Gliome.
- Bestätigung durch eine offizielle Zertifizierung nach den Kriterien der ISO-Normen (ClarCert) und der Deutschen Krebsliga (OnkoZert). Alle am Tumorboard beteiligten Disziplinen – Onkologie, Radioonkologie, Neuroradiologie, Neurologie und begleitende Fächer – müssen hohe Qualitätsnormen erfüllen und sind echte miteinander kooperierende Partner.
- Gliomtherapie als wissenschaftlicher und klinischer Schwerpunkt, sichtbar an eigenen Studien, an der Entwicklung spezieller Techniken und Methoden, an einer eigenen Datenbank zur Erfassung der individuellen Ergebnisse und der Behandlungsqualität sowie einem festen Tumor-Team mit spezialisierter Pflege und Ärzten.
Wir erfüllen in der Neurochirurgie am Inselspital die genannten Anforderungen an ein Neuroonkologisches Zentrum und bieten Ihnen noch mehr!
- Wie sind meine Heilungschancen?
Tumorzellen von Gliomen neigen leider dazu, bereits zu einem sehr frühen Zeitpunkt in die Umgebung des Tumorkerns zu streuen. Wie viele Zellen sich dabei vom Haupttumor entfernen, ist abhängig von der Grösse des Tumors und dessen molekularen Eigenschaften. Bei kleinen Tumoren und günstigen Tumoreigenschaften kann es möglich sein, dass eine supramarginale Operation mehr als 99,9 % der Tumorzellen entfernt und nur wenige zurückbleiben. Da von diesen Restzellen nicht alle Zellen wieder wachsen, gibt es Patienten, bei denen der Tumor sich über Jahrzehnte oder sogar überhaupt nicht mehr ausbildet.
Man spricht bei Gliomen deshalb eher von einer Langzeitkontrolle (engl. long-term disease control) als von einer Heilung. Diese Langzeitkontrolle ist auch Gegenstand aktueller Studien. Die bisher wichtigsten Einflussfaktoren auf das Wiederkehren des Tumors sind die MRI-T2- oder FLAIR-komplette Tumorentfernung sowie günstige molekulare Eigenschaften des Tumors (1p19q deletiert, günstige Methylierung).
- Werden nach der Operation neurologische Ausfälle auftreten?
Bei mehr als 50 % aller Astrozytome und Oligodendrogliome befinden sich kritische, sogenannte «eloquente» Funktionen des Gehirns in unmittelbarer Nähe (weniger als 10 mm) des Tumors. Die Erhaltung dieser eloquenten Funktionen hat immer Priorität, weil neurologische Defizite den Krankheitsverlauf beschleunigen und zu Funktionsstörungen führen können. Damit muss sich das Ziel, den Tumor supramarginal, also mit Sicherheitszone zu entfernen, der Funktionserhaltung unterordnen.
Das neurophysiologische High-end-Monitoring ist ein Schwerpunkt unserer Klinik, bei dem wir zu den weltweit führenden Zentren zählen und kontinuierlich an Weiterentwicklungen mitarbeiten. So haben wir am Inselspital ein spezielles «Bern-Konzept» des Neuromonitorings mit einem kontinuierlichen dynamischen Mapping zur Vermeidung von Lähmungen entwickelt. Bei Tumoren in der Nähe der Bewegungsbahn treten nur bei 3–5 % unserer Patienten dauerhafte Einschränkungen auf. Das ist eine der niedrigsten Zahlen für motorische Defizite weltweit!
Nur mit Hilfe des spezialisierten Mappings oder Funktionsmappings kann genau bis zur kritischen sicheren Entfernung an die eloquente Funktion heran operiert werden. Dadurch wird bei vielen Astrozytomen und Oligodendrogliomen eine supramarginale Operation möglich, wo der Chirurg ohne das Mapping entweder die Entfernung des Tumors zu früh beendet oder die Funktion bereits geschädigt hätte. Mit dieser neuen und innovativen Technik erreichen wir in Bern bei > 90 % aller Operationen eine Schonung oder Erholung der Funktionen.
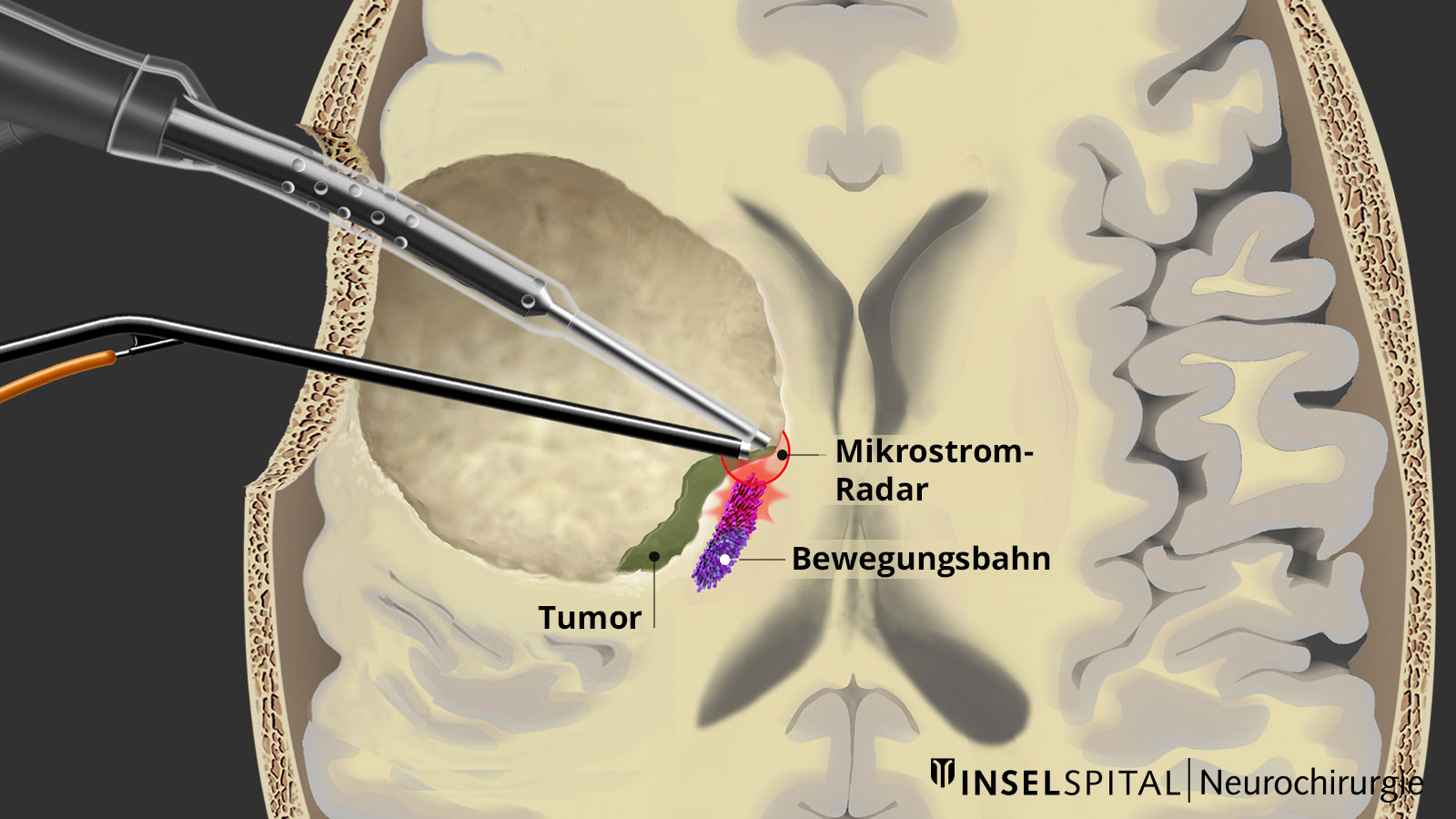
Dynamisches kontinuierliches Mapping. Ein gepulster Mikrostrom spürt während der Tumorresektion wichtige Hirnareale auf, wenn diese in der Nähe liegen. Damit werden der genaue Ort und der Abstand zu diesen Zonen präzise angezeigt und der Chirurg rechtzeitig gewarnt. Bild: Universitätsklinik für Neurochirurgie, Inselspital Bern © CC BY-NC 4.0 - Was kann ich zusätzlich zur Standardtherapie tun?
Es gibt eine ganze Reihe von Faktoren, die zu einer erfolgreicheren Tumortherapie beitragen und so eine wertvolle Ergänzung zur Standardtherapie darstellen. Ziele dabei sind
- eine schnellere Erholung unserer Patienten
- ein kürzerer Aufenthalt im Spital
- mehr Patientenautonomie
- mehr Sicherheit bei der Behandlung
- mehr Lebensqualität
- ein positiver Effekt auf die Tumorkontrolle
Wir haben am Inselspital ein Behandlungsprotkoll entwickelt, das alle diese positiven Faktoren berücksichtigt: das sogenannte OPTIMISST-Protokoll. OPTIMISST steht für «OPTIMIzed Standard and Supportive Therapy».
- Was muss ich nach der OP beachten?
Für die meisten unserer Patienten streben wir nach dem Berner OPTIMISST-Protokoll bereits für den Tag nach der Operation fast das Aktivitätsniveau wie vor der Operation an. Jedoch sollten bei grösseren Tumoren oder eloquenter Lage des operierten Tumors etwa 1–2 Monate nach der Operation zur Erholung eingeplant werden. Hier gilt es, innerhalb der Familie und mit dem Arbeitgeber optimale und stressfreie Verhältnisse für die Zeit nach der Operation zu schaffen.
Bei besonders schwierigen Operationen können Defizite bezüglich Sprache, Kraft, Verständnis oder anderer Fähigkeiten auftreten, die in 95 % der Fälle nur vorübergehend sind. Gerade bei Patienten mit postoperativen Defiziten ist eine intensive Neurorehabilitation wesentlich, damit sich die gestörten Funktionen schneller erholen.
Spätestens eine Woche nach der Operation liegt die Gewebediagnose vor, nach einer weiteren Woche die molekulare Diagnose. Zu diesem Zeitpunkt erfolgt eine individuelle Planung des weiteren Vorgehens (Beobachtung oder weitere Therapie?) im Tumor-Board. Bei speziellen Fällen werden in einer Konferenzschaltung mit Prof. Roger Stupp von der Northwestern University in Chicago, USA, besondere Therapiemöglichkeiten oder Studien diskutiert.
- Wie lange und wie oft muss ich eine MRI-Untersuchung machen lassen?
Bei der Diagnose eines Astrozytoms oder Oligodendroglioms muss eine MRI-Verlaufskontrolle üblicherweise lebenslang erfolgen. Dabei kann das Intervall für die Bildgebung aber angepasst werden. Als Standard gelten folgende Zeiten:
Alle 3 Monate:
- nach der Operation
- bei WHO-Grad III
- bei sichtbaren Tumorresten
- bei IDH-Wildtyp-Tumoren
- bei PET-aktiven Tumorresten
Alle 3–12 Monate:
- je nach Tumorart
- je nach molekularem Profil
- je nach Resektionsgrad
- je nach vorheriger Zeit der Tumorfreiheit
- je nach progressionsfreiem Intervall
- Was passiert, wenn ich schwanger werde? Wächst der Tumor dann schneller?
Diese Frage sollten Sie im konkreten Fall mit Ihrem behandelnden Arzt besprechen. Hier kurz einige wichtige Informationen dazu:
- Nach bisherigem Wissen ist eine Schwangerschaft für ein Gliom kein nachgewiesener Risikofaktor für ein Tumorwachstum. Wie immer gibt es aber in der Medizin gegenteilige Einzelfallberichte. Der Abbruch einer Schwangerschaft angesichts einer Gliom-Diagnose wird nach dem aktuellen Wissensstand nicht empfohlen.
- Aufgrund der Diagnose eines Astrozytoms oder Oligodendroglioms ist die Wahrscheinlichkeit eines Tumorwachstums über die nächsten 3–15 Jahre relativ hoch. Es werden eine Operation oder andere Therapien erforderlich sein. Die Patientin und ihre Familie müssen sich über diese Belastung im Klaren sein.
- Eine vorherige Chemotherapie kann ein erhöhtes Risiko für Mutationen und Missbildungen mit sich bringen. In diesen Fällen wird die Schwangerschaft formal als Risikoschwangerschaft eingestuft und überwacht.
- Eine Routine-MRI-Untersuchung sollte wenn möglich während einer Schwangerschaft vermieden werden.
- Wird mein Tumor wieder wachsen?
Je nach Eigenschaften und Grad des Tumors kann es Monate (IDH-Wildtyp, Astrozytom Grad III) bis Jahrzehnte dauern (günstigster Fall, 1p19q-Kodeletion, andere optimale Faktoren), bis zurückgebliebene Zellen erneut einen sichtbaren Tumor formen. Diese Progression wird in Routine-Verlaufs-MRIs erfasst.
Bei erneutem Tumorwachstum empfehlen wir wieder klar eine Resektion. Das weitere Wachstum und die Wahrscheinlichkeit einer bösartigen Entartung in einen höheren WHO-Grad steigen mit dem Tumorvolumen und der Zeit. Oft rückt der wieder wachsende Tumor auch näher an eloquente Hirnareale – ein spezialisiertes Funktionsmapping ist deshalb meist unabdingbar.
- Wie ist meine Prognose und Lebenserwartung?
Viele Patienten mit niedriggradigen Gliomen haben eine gute Lebensqualität und arbeiten in ihrem erlernten Beruf ohne grössere Einschränkungen im Alltag. Die Lebenserwartung variiert dabei stark und ist von vielen Faktoren abhängig.
Positive Faktoren
Ein wichtiger Faktor ist hier vor allem das Ausmass der Resektion. Patienten mit einer kompletten Resektion haben eine deutlich bessere Überlebensprognose und weniger bösartige Entartungen.
Aus grossen Studien wissen wir, dass auch ein junges Alter des Patienten (unter 40–50 Jahre) einen positiven Einfluss auf die Prognose hat.
Ein weiterer wichtiger Faktor ist das Ausbleiben neurologischer Defizite. So haben Patienten, die als einziges Symptom epileptische Anfälle aufweisen, eine bessere Prognose *.
Negative Faktoren
Ein negativer Faktor für das Überleben ist ein grosses Tumorvolumen von > 4 cm *.
Molekulare Marker
Patienten mit IDH-Mutation weisen eine bessere Prognose auf als solche ohne IDH-Mutation.
Patienten mit IDH-Mutation und zusätzlicher 1p/19q-Kodeletion haben die beste Prognose von allen bekannten Untergruppen.
Lebenserwartung
Bei der Hälfte der Patienten mit Astrozytomen, IDH- und ATRX-Mutation liegt sie bei ca. 7–10 Jahren, bei der anderen Hälfte ist sie kürzer oder länger.
Bei Patienten mit Oligodendrogliomen, IDH-Mutation und 1p/19q-Kodeletion liegt sie in der Regel bei mehr als 10–15 Jahren, ohne maligne Transformation auch bei mehreren Jahrzehnten.
Referenzen
-
Jakola AS, Myrmel KS, Kloster R, Torp SH, Lindal S, Unsgård G, Solheim O. Comparison of a strategy favoring early surgical resection vs a strategy favoring watchful waiting in low-grade gliomas. JAMA. 2012 Nov 14;308(18):1881-8. doi: 10.1001/jama.2012.12807.
-
Smith JS, Chang EF, Lamborn KR, Chang SM, Prados MD, Cha S, Tihan T, Vandenberg S, McDermott MW, Berger MS. Role of extent of resection in the long-term outcome of low-grade hemispheric gliomas. J Clin Oncol. 2008 Mar 10;26(8):1338-45. doi: 10.1200/JCO.2007.13.9337.
-
Duffau H. Is supratotal resection of glioblastoma in noneloquent areas possible? World Neurosurg. 2014 Jul-Aug;82(1-2):e101-3. doi: 10.1016/j.wneu.2014.02.015. Epub 2014 Feb 15.
-
Yordanova YN, Moritz-Gasser S, Duffau H. Awake surgery for WHO Grade II gliomas within "noneloquent" areas in the left dominant hemisphere: toward a "supratotal" resection. Clinical article. J Neurosurg. 2011 Aug;115(2):232-9. doi: 10.3171/2011.3.JNS101333. Epub 2011 May 6.
-
Gil-Robles S, Duffau H. Surgical management of World Health Organization Grade II gliomas in eloquent areas: the necessity of preserving a margin around functional structures. Neurosurg Focus. 2010 Feb;28(2):E8. doi: 10.3171/2009.12.FOCUS09236.
-
Ostrom QT, Gittleman H, Xu J, Kromer C, Wolinsky Y, Kruchko C, Barnholtz-Sloan JS. CBTRUS Statistical Report: Primary Brain and Other Central Nervous System Tumors Diagnosed in the United States in 2009-2013. Neuro Oncol. 2016 Oct 1;18(suppl_5):v1-v75. doi: 10.1093/neuonc/now207.
-
Chang EF, Potts MB, Keles GE, Lamborn KR, Chang SM, Barbaro NM, Berger MS. Seizure characteristics and control following resection in 332 patients with low-grade gliomas. J Neurosurg. 2008 Feb;108(2):227-35. doi: 10.3171/JNS/2008/108/2/0227.
-
Sanai N, Chang S, Berger MS. Low-grade gliomas in adults. J Neurosurg. 2011 Nov;115(5):948-65. doi: 10.3171/2011.7.JNS101238.
-
Potts MB, Smith JS, Molinaro AM, Berger MS. Natural history and surgical management of incidentally discovered low-grade gliomas. J Neurosurg. 2012 Feb;116(2):365-72. doi: 10.3171/2011.9.JNS111068. Epub 2011 Oct 14.
-
Pallud J, Fontaine D, Duffau H, Mandonnet E, Sanai N, Taillandier L, Peruzzi P, Guillevin R, Bauchet L, Bernier V, Baron MH, Guyotat J, Capelle L. Natural history of incidental World Health Organization grade II gliomas. Ann Neurol. 2010 Nov;68(5):727-33. doi: 10.1002/ana.22106.
-
Kelly PJ, Daumas-Duport C, Kispert DB, Kall BA, Scheithauer BW, Illig JJ. Imaging-based stereotaxic serial biopsies in untreated intracranial glial neoplasms. J Neurosurg. 1987 Jun;66(6):865-74. doi: 10.3171/jns.1987.66.6.0865.
-
Pallud J, Varlet P, Devaux B, Geha S, Badoual M, Deroulers C, Page P, Dezamis E, Daumas-Duport C, Roux FX. Diffuse low-grade oligodendrogliomas extend beyond MRI-defined abnormalities. Neurology. 2010 May 25;74(21):1724-31. doi: 10.1212/WNL.0b013e3181e04264.
-
Bauman G, Fisher B, Watling C, Cairncross JG, Macdonald D. Adult supratentorial low-grade glioma: long-term experience at a single institution. Int J Radiat Oncol Biol Phys. 2009 Dec 1;75(5):1401-7. doi: 10.1016/j.ijrobp.2009.01.010. Epub 2009 Apr 22.
-
Claus EB, Black PM. Survival rates and patterns of care for patients diagnosed with supratentorial low-grade gliomas: data from the SEER program, 1973-2001. Cancer. 2006 Mar 15;106(6):1358-63. doi: 10.1002/cncr.21733.
-
Duffau H, Taillandier L. New concepts in the management of diffuse low-grade glioma: Proposal of a multistage and individualized therapeutic approach. Neuro Oncol. 2015 Mar;17(3):332-42. doi: 10.1093/neuonc/nou153. Epub 2014 Aug 2.
-
Pedersen CL, Romner B. Current treatment of low grade astrocytoma: a review. Clin Neurol Neurosurg. 2013 Jan;115(1):1-8. doi: 10.1016/j.clineuro.2012.07.002. Epub 2012 Jul 21.
-
Piepmeier JM. Current concepts in the evaluation and management of WHO grade II gliomas. J Neurooncol. 2009 May;92(3):253-9. doi: 10.1007/s11060-009-9870-z. Epub 2009 Apr 9.
-
Soffietti R, Baumert BG, Bello L, Von Deimling A, Duffau H, Frénay M, Grisold W, Grant R, Graus F, Hoang-Xuan K, Klein M, Melin B, Rees J, Siegal T, Smits A, Stupp R, Wick W. Guidelines on management of low-grade gliomas: report of an EFNS-EANO Task Force. Eur J Neurol. 2010 Sep;17(9):1124-1133. doi: 10.1111/j.1468-1331.2010.03151.x.
-
Weller M, van den Bent M, Tonn JC, Stupp R, Preusser M, Cohen-Jonathan-Moyal E, Henriksson R, Le Rhun E, Balana C, Chinot O, Bendszus M, Reijneveld JC, Dhermain F, French P, Marosi C, Watts C, Oberg I, Pilkington G, Baumert BG, Taphoorn MJB, Hegi M, Westphal M, Reifenberger G, Soffietti R, Wick W; European Association for Neuro-Oncology (EANO) Task Force on Gliomas. European Association for Neuro-Oncology (EANO) guideline on the diagnosis and treatment of adult astrocytic and oligodendroglial gliomas. Lancet Oncol. 2017 Jun;18(6):e315-e329. doi: 10.1016/S1470-2045(17)30194-8. Epub 2017 May 5. Erratum in: Lancet Oncol. 2017 Nov;18(11):e642.
-
Capelle L, Fontaine D, Mandonnet E, Taillandier L, Golmard JL, Bauchet L, Pallud J, Peruzzi P, Baron MH, Kujas M, Guyotat J, Guillevin R, Frenay M, Taillibert S, Colin P, Rigau V, Vandenbos F, Pinelli C, Duffau H; French Réseau d'Étude des Gliomes. Spontaneous and therapeutic prognostic factors in adult hemispheric World Health Organization Grade II gliomas: a series of 1097 cases: clinical article. J Neurosurg. 2013 Jun;118(6):1157-68. doi: 10.3171/2013.1.JNS121. Epub 2013 Mar 15.
-
Nikas DC, Bello L, Zamani AA, Black PM. Neurosurgical considerations in supratentorial low-grade gliomas: experience with 175 patients. Neurosurg Focus. 1998 Apr 15;4(4):e4. doi: 10.3171/foc.1998.4.4.7.
-
Peraud A, Ansari H, Bise K, Reulen HJ. Clinical outcome of supratentorial astrocytoma WHO grade II. Acta Neurochir (Wien). 1998;140(12):1213-22. doi: 10.1007/s007010050241.
-
Sanai N, Berger MS. Glioma extent of resection and its impact on patient outcome. Neurosurgery. 2008 Apr;62(4):753-64; discussion 264-6. doi: 10.1227/01.neu.0000318159.21731.cf.
-
van Veelen ML, Avezaat CJ, Kros JM, van Putten W, Vecht C. Supratentorial low grade astrocytoma: prognostic factors, dedifferentiation, and the issue of early versus late surgery. J Neurol Neurosurg Psychiatry. 1998 May;64(5):581-7. doi: 10.1136/jnnp.64.5.581.
-
McGirt MJ, Chaichana KL, Attenello FJ, Weingart JD, Than K, Burger PC, Olivi A, Brem H, Quinoñes-Hinojosa A. Extent of surgical resection is independently associated with survival in patients with hemispheric infiltrating low-grade gliomas. Neurosurgery. 2008 Oct;63(4):700-7; author reply 707-8. doi: 10.1227/01.NEU.0000325729.41085.73
-
Chaichana KL, Cabrera-Aldana EE, Jusue-Torres I, Wijesekera O, Olivi A, Rahman M, Quinones-Hinojosa A. When gross total resection of a glioblastoma is possible, how much resection should be achieved? World Neurosurg. 2014 Jul-Aug;82(1-2):e257-65. doi: 10.1016/j.wneu.2014.01.019. Epub 2014 Feb 6.
-
Keles GE, Lamborn KR, Berger MS. Low-grade hemispheric gliomas in adults: a critical review of extent of resection as a factor influencing outcome. J Neurosurg. 2001 Nov;95(5):735-45. doi: 10.3171/jns.2001.95.5.0735.
-
Nakamura M, Konishi N, Tsunoda S, Nakase H, Tsuzuki T, Aoki H, Sakitani H, Inui T, Sakaki T. Analysis of prognostic and survival factors related to treatment of low-grade astrocytomas in adults. Oncology. 2000 Feb;58(2):108-16. doi: 10.1159/000012087.
-
Nicolato A, Gerosa MA, Fina P, Iuzzolino P, Giorgiutti F, Bricolo A. Prognostic factors in low-grade supratentorial astrocytomas: a uni-multivariate statistical analysis in 76 surgically treated adult patients. Surg Neurol. 1995 Sep;44(3):208-21; discussion 221-3. doi: 10.1016/0090-3019(95)00184-0.
-
De Witt Hamer PC, Robles SG, Zwinderman AH, Duffau H, Berger MS. Impact of intraoperative stimulation brain mapping on glioma surgery outcome: a meta-analysis. J Clin Oncol. 2012 Jul 10;30(20):2559-65. doi: 10.1200/JCO.2011.38.4818. Epub 2012 Apr 23.
-
Duffau H, Capelle L, Denvil D, Sichez N, Gatignol P, Taillandier L, Lopes M, Mitchell MC, Roche S, Muller JC, Bitar A, Sichez JP, van Effenterre R. Usefulness of intraoperative electrical subcortical mapping during surgery for low-grade gliomas located within eloquent brain regions: functional results in a consecutive series of 103 patients. J Neurosurg. 2003 Apr;98(4):764-78. doi: 10.3171/jns.2003.98.4.0764.
-
Duffau H, Peggy Gatignol ST, Mandonnet E, Capelle L, Taillandier L. Intraoperative subcortical stimulation mapping of language pathways in a consecutive series of 115 patients with Grade II glioma in the left dominant hemisphere. J Neurosurg. 2008 Sep;109(3):461-71. doi: 10.3171/JNS/2008/109/9/0461.
-
Keles GE, Lundin DA, Lamborn KR, Chang EF, Ojemann G, Berger MS. Intraoperative subcortical stimulation mapping for hemispherical perirolandic gliomas located within or adjacent to the descending motor pathways: evaluation of morbidity and assessment of functional outcome in 294 patients. J Neurosurg. 2004 Mar;100(3):369-75. doi: 10.3171/jns.2004.100.3.0369.
-
Raabe A, Beck J, Schucht P, Seidel K. Continuous dynamic mapping of the corticospinal tract during surgery of motor eloquent brain tumors: evaluation of a new method. J Neurosurg. 2014 May;120(5):1015-24. doi: 10.3171/2014.1.JNS13909. Epub 2014 Mar 14.
-
Chacko AG, Thomas SG, Babu KS, Daniel RT, Chacko G, Prabhu K, Cherian V, Korula G. Awake craniotomy and electrophysiological mapping for eloquent area tumours. Clin Neurol Neurosurg. 2013 Mar;115(3):329-34. doi: 10.1016/j.clineuro.2012.10.022. Epub 2012 Nov 21.
-
Spena G, Garbossa D, Panciani PP, Griva F, Fontanella MM. Purely subcortical tumors in eloquent areas: awake surgery and cortical and subcortical electrical stimulation (CSES) ensure safe and effective surgery. Clin Neurol Neurosurg. 2013 Sep;115(9):1595-601. doi: 10.1016/j.clineuro.2013.02.006. Epub 2013 Mar 5.
-
Campanella F, Shallice T, Ius T, Fabbro F, Skrap M. Impact of brain tumour location on emotion and personality: a voxel-based lesion-symptom mapping study on mentalization processes. Brain. 2014 Sep;137(Pt 9):2532-45. doi: 10.1093/brain/awu183. Epub 2014 Jul 15.
-
Shields LB, Choucair AK. Management of low-grade gliomas: a review of patient-perceived quality of life and neurocognitive outcome. World Neurosurg. 2014 Jul-Aug;82(1-2):e299-309. doi: 10.1016/j.wneu.2014.02.033. Epub 2014 Feb 19.
-
Aaronson NK, Taphoorn MJ, Heimans JJ, Postma TJ, Gundy CM, Beute GN, Slotman BJ, Klein M. Compromised health-related quality of life in patients with low-grade glioma. J Clin Oncol. 2011 Nov 20;29(33):4430-5. doi: 10.1200/JCO.2011.35.5750. Epub 2011 Oct 17.
-
Carlesimo GA. Memory disorders in patients with cerebral tumors. J Neurooncol. 2012 Jun;108(2):253-6. doi: 10.1007/s11060-012-0825-4. Epub 2012 Feb 21.
-
Klein M, Heimans JJ, Aaronson NK, van der Ploeg HM, Grit J, Muller M, Postma TJ, Mooij JJ, Boerman RH, Beute GN, Ossenkoppele GJ, van Imhoff GW, Dekker AW, Jolles J, Slotman BJ, Struikmans H, Taphoorn MJ. Effect of radiotherapy and other treatment-related factors on mid-term to long-term cognitive sequelae in low-grade gliomas: a comparative study. Lancet. 2002 Nov 2;360(9343):1361-8. doi: 10.1016/s0140-6736(02)11398-5. Erratum in: Lancet. 2011 May 14;377(9778):1654.
-
Taphoorn MJ, Klein M. Cognitive deficits in adult patients with brain tumours. Lancet Neurol. 2004 Mar;3(3):159-68. doi: 10.1016/S1474-4422(04)00680-5.
-
Teixidor P, Gatignol P, Leroy M, Masuet-Aumatell C, Capelle L, Duffau H. Assessment of verbal working memory before and after surgery for low-grade glioma. J Neurooncol. 2007 Feb;81(3):305-13. doi: 10.1007/s11060-006-9233-y. Epub 2006 Aug 31.
-
Gehring K, Sitskoorn MM, Gundy CM, Sikkes SA, Klein M, Postma TJ, van den Bent MJ, Beute GN, Enting RH, Kappelle AC, Boogerd W, Veninga T, Twijnstra A, Boerman DH, Taphoorn MJ, Aaronson NK. Cognitive rehabilitation in patients with gliomas: a randomized, controlled trial. J Clin Oncol. 2009 Aug 1;27(22):3712-22. doi: 10.1200/JCO.2008.20.5765. Epub 2009 May 26.
-
Muragaki Y, Chernov M, Maruyama T, Ochiai T, Taira T, Kubo O, Nakamura R, Iseki H, Hori T, Takakura K. Low-grade glioma on stereotactic biopsy: how often is the diagnosis accurate? Minim Invasive Neurosurg. 2008 Oct;51(5):275-9. doi: 10.1055/s-0028-1082322. Epub 2008 Oct 14.
-
Blonski M, Taillandier L, Herbet G, Maldonado IL, Beauchesne P, Fabbro M, Campello C, Gozé C, Rigau V, Moritz-Gasser S, Kerr C, Rudà R, Soffietti R, Bauchet L, Duffau H. Combination of neoadjuvant chemotherapy followed by surgical resection as a new strategy for WHO grade II gliomas: a study of cognitive status and quality of life. J Neurooncol. 2012 Jan;106(2):353-66. doi: 10.1007/s11060-011-0670-x. Epub 2011 Jul 22.
-
Buckner JC, Shaw EG, Pugh SL, Chakravarti A, Gilbert MR, Barger GR, Coons S, Ricci P, Bullard D, Brown PD, Stelzer K, Brachman D, Suh JH, Schultz CJ, Bahary JP, Fisher BJ, Kim H, Murtha AD, Bell EH, Won M, Mehta MP, Curran WJ Jr. Radiation plus Procarbazine, CCNU, and Vincristine in Low-Grade Glioma. N Engl J Med. 2016 Apr 7;374(14):1344-55. doi: 10.1056/NEJMoa1500925.
-
van den Bent MJ, Afra D, de Witte O, Ben Hassel M, Schraub S, Hoang-Xuan K, Malmström PO, Collette L, Piérart M, Mirimanoff R, Karim AB; EORTC Radiotherapy and Brain Tumor Groups and the UK Medical Research Council. Long-term efficacy of early versus delayed radiotherapy for low-grade astrocytoma and oligodendroglioma in adults: the EORTC 22845 randomised trial. Lancet. 2005 Sep 17-23;366(9490):985-90. doi: 10.1016/S0140-6736(05)67070-5. Erratum in: Lancet. 2006 Jun 3;367(9525):1818.
-
Chang EF, Smith JS, Chang SM, Lamborn KR, Prados MD, Butowski N, Barbaro NM, Parsa AT, Berger MS, McDermott MM. Preoperative prognostic classification system for hemispheric low-grade gliomas in adults. J Neurosurg. 2008 Nov;109(5):817-24. doi: 10.3171/JNS/2008/109/11/0817.
-
Cancer Genome Atlas Research Network, Brat DJ, Verhaak RG, Aldape KD, Yung WK, Salama SR, Cooper LA, Rheinbay E, Miller CR, Vitucci M, Morozova O, Robertson AG, Noushmehr H, Laird PW, Cherniack AD, Akbani R, Huse JT, Ciriello G, Poisson LM, Barnholtz-Sloan JS, ... Zhang J. Comprehensive, Integrative Genomic Analysis of Diffuse Lower-Grade Gliomas. N Engl J Med. 2015 Jun 25;372(26):2481-98. doi: 10.1056/NEJMoa1402121. Epub 2015 Jun 10.
-
Eckel-Passow JE, Lachance DH, Molinaro AM, Walsh KM, Decker PA, Sicotte H, Pekmezci M, Rice T, Kosel ML, Smirnov IV, Sarkar G, Caron AA, Kollmeyer TM, Praska CE, Chada AR, Halder C, Hansen HM, McCoy LS, Bracci PM, Marshall R, Zheng S, Reis GF, Pico AR, O'Neill BP, Buckner JC, Giannini C, Huse JT, Perry A, Tihan T, Berger MS, Chang SM, Prados MD, Wiemels J, Wiencke JK, Wrensch MR, Jenkins RB. Glioma Groups Based on 1p/19q, IDH, and TERT Promoter Mutations in Tumors. N Engl J Med. 2015 Jun 25;372(26):2499-508. doi: 10.1056/NEJMoa1407279. Epub 2015 Jun 10.